新型肿瘤标志物MEF2D在肝癌侵袭转移中的作用*
(1.青岛大学药学院,山东 青岛 266071; 2.青岛市市立医院内窥镜室,山东 青岛 2660011;3.青岛市市立医院核医学科,山东 青岛 266011)
肝细胞性肝癌(hepatocellular carcinoma,HCC)是世界上最常见的和第三大致死率的癌症[1]。肝癌患者术后5年内的生存率仍然很低。50%以上患者出现转移复发,严重影响患者预后。上皮间质转化(epithelial-mesenchymal transitions, EMT)的发生是促进肝癌侵袭和转移的主要原因之一[2]。临床上有58%的肝癌患者伴随有以E-Cadherin减少为标志的EMT发生[3]。通常用手术的手法去除肿瘤,但是这些病人的预后很差,术后大多发生肿瘤的肝内转移。相比之下,未发生EMT的肝癌患者则很少发生肝内转移的现象[4]。肌肉增强因子2D(myocyte enhancer factor 2d, MEF2D)是一种发挥多种生理功能的细胞内转录因子,据文献报道MEF2D在骨骼肌、心肌、神经组织和免疫系统的发育过程和正常生理功能的维持中发挥重要功能[5]。本课题组通过对GDS4269基因芯片研究发现在TGF-β诱导的EMT过程中MEF2D的表达量上升[6],进一步对于肝癌转移基因芯片GDS3901的分析中,我们发现在肝癌转移灶表达量明显高于原发灶[7]。因此,我们推测MEF2D参与TGF-β诱导EMT的过程,并且具有可作为肝癌诊断和预后的分子标记物的价值。
1 材料与方法
1.1 材料
细胞株PLC/PRF5、HepG2购买于中科院上海细胞库;DMEM培养基购自Gibco公司;胎牛血清(fetal bovine serum, FBS,PANS);Vimentin,E-cadhern,GAPDH抗体购买于Abcam; MEF2D抗体购买于CST公司;TGF-β购买于索莱宝;siMEF2D和Nc 购自中国上海吉玛制药技术有限公司;空载对照质粒和MEF2D质粒购自中国上海吉凯基因化学技术有限公司;基因芯片GDS4269是肝癌Huh-7细胞系经过TGF-β刺激与正常对照两组样本测序;基因芯片GDS3901是分析静脉转移肝癌与原发肝癌组织的测序;转染试剂siRNA Transfection Reagent/DNAfectin 2100 Transfection Reagent均购买于Applied Biological Materials公司;肝癌标本和肝癌切片来自于青岛大学附属医院。
1.2 方法
1.2.1细胞培养 PLC/PRF5、HepG2细胞均采用DMEM培养基(含10%FBS,1%双抗)培养,置于37℃,5%CO2培养箱培养。覆盖率达到80%~90%后,弃去培养液用PBS冲洗,加入1 ml胰酶消化2~3 min,然后传到新的培养瓶中,继续培养。
1.2.2蛋白质印迹检测 肝癌细胞PLC/PRF5和HepG2转染48 h后,加入蛋白裂解液,低温高速离心,提取细胞总蛋白,加入loading buffer变性。用12%聚丙烯酰胺凝胶电泳分离,湿法转膜到PVDF膜上,用TBST摇床洗3×10 min,用5%脱脂奶粉在摇床封闭2 h,TBST摇床洗3×10 min, 在一抗孵育槽中加入用5%脱脂奶粉稀释的一抗(GAPDH 1∶1 000,MEF2D 1∶1 000),用一抗覆盖PVDF膜在4℃冰箱中。隔夜取出膜,TBST摇床洗3×10 min,加入稀释好的二抗(1∶1 000~1∶10 000)1 h,TBST摇床洗3×10 min,将适量的高灵敏度ECL发光液按1∶1比例混合均匀,覆盖到PVDF膜上,在暗室中用Bio-Rad凝胶成像仪显影并记录。
1.2.3siRNA/质粒细胞转染 将PLC/PRF5、HepG2细胞接种于6孔板中,正常情况培养细胞覆盖率达到50%~60%时,每孔加入1.6 ml无血清培养液。将5 μl siRNA Transfection Reagent/DNA fectin 2100 Transfection Reagent和100 μl 无血清培养液混合室温静置5 min之后,与100 μl无血清培养液和5 μl siRNA/质粒混合液混合均匀形成复合物,在室温放置20 min之后加到对应的6孔板中,放置于37 ℃,5%CO2温箱中培养。48 h之后进行后续实验和提取蛋白。
1.2.4Transwell实验 将基质胶放在4℃冰盒融化,用预冷的移液枪头混匀Matrigel基质成匀浆状,按照1∶8的比例加入无血清培养液。每个小室当中加入60 μl混合液包被于小室,置于温箱当中30 min,吸取多余的混合液。将分别转染Nc和siMEF2D的PLC/PRF5细胞做成混悬液,细胞计数制成1×105个/ml混悬液,每个小室加入200 μl的细胞混悬液,24孔板中加入600 μl的含15%FBS的培养液置于温箱当中48 h,培养48 h后,用棉签擦去基质胶和上室内细胞,PBS液洗3×3 min,用4%多聚甲醛固定细胞30 min。再用PBS液洗3×3 min,用结晶紫染色30 min,最后再用PBS液清洗。 将小室置于显微镜下观察并拍照,各小室取5个视野统计细胞个数,细胞相对侵袭率=实验组细胞数/对照组细胞数。
1.2.5划痕实验 将HepG2细胞接种于6孔板,等到覆盖率达到50%~60%转染过表达质粒之后48 h,用200 μl枪头垂直用力划横线,用PBS缓冲液冲洗3次,加入无血清的培养液进行培养,分别于0,48 h用倒置显微镜拍照,用Image J进行划痕测量,细胞迁移率=(初始划痕距离-实验后划痕距离)/初始划痕距离。
1.2.6免疫组化 石蜡切片放置在60 ℃恒温箱中烘烤120 min;然后脱蜡和水化(二甲苯10 min→二甲苯10 min→无水乙醇2×5 min→95%乙醇2×5 min→90%乙醇5 min→85%乙醇5 min →80%乙醇5 min→75%乙醇5 min; 用蒸馏水冲洗25 min;加3%H2O2孵育30 min(室温);蒸馏水洗2次;抗原修复;用PBS洗3×5 min,封闭30 min;滴加一抗,4 ℃过夜或37 ℃孵育2~3 h;用PBS洗3×5 min,滴加二抗,37 ℃孵育30~60 min;用PBS洗3×5 min,DAB液(二氨基联苯胺)显色,自来水充分冲洗;苏木素复染,自来水充分冲洗;脱水、透明各5~10 min;中性树脂封片,加盖玻片,晾干之后显微镜观察拍摄照片。
1.2.7统计学分析 利用SPSS19.0软件进行统计学分析,两组均数的比较用t检验,P≤0.05被认为有统计学意义。
2 结 果
2.1 MEF2D参与TGF-β诱导细胞发生EMT过程
用不同浓度的TGF-β(0、3、5 ng/ml)处理PLC/PRF5细胞48 h,随着TGF-β的浓度梯度增长,细胞之间黏连性降低,细胞间紧密连接遭到破坏(图1A)。为验证MEF2D是否参与EMT的发生过程,免疫印迹法结果显示Vimentin表达量逐渐升高,E-cadhern的表达量下降不太明显,MEF2D的表达量明显升高(图1B )。通过信息学对GDS4269基因芯片进行分析也得出同样的结果,经过TGF-β作用之后,MEF2D的表达量上升幅度很大(图1C)。



A:TGF-β处理PLC/PRF5细胞之后细胞形态的变化;B:TGF-β处理PLC/PRF5细胞之后EMT相关蛋白以及MEF2D的表达量及其定量;C:基因芯片GDS4269显示Huh7经过TGF-β处理后MEF2D表达量。
图1 MEF2D参与TGF-β诱导细胞发生EMT过程
2.2 MEF2D可以明显促进细胞发生侵袭转移
为检测MEF2D与肝癌细胞发生侵袭转移的关系,用NC和siMEF2D分别转染PLC/RPF5细胞系,可观察到MEF2D明显下调(图2A),在Transwell实验中,下调MEF2D的细胞侵袭能力明显弱于对照组(P<0.01)(图2B)。在划痕实验中,用质粒上调HepG2细胞系中的MEF2D表达量(图2C),过表达MEF2D细胞的愈合能力要强于对照组(P<0.01)(图2D)。在细胞实验中,MEF2D可以明显促进细胞的侵袭转移。
2.3 MEF2D在侵袭转移的肿瘤组织中高表达
用肝癌患者的肿瘤和正常标本做免疫组化,MEF2D在肿瘤组织中的表达量高于癌旁组织(图3A)。通过对于基因芯片GDS3901的分析,我们发现在转移的组织当中MEF2D的表达量明显高于非转移的肿瘤组织(图3C),为再次验证这一结论,我们取9例转移病人标本,在转移病人组织中MEF2D的mRNA表达量是原发灶肿瘤的2.5倍。因此MEF2D在病人的转移组织当中高表达(图3B)。
3 讨 论
肝癌细胞的转移是导致患者死亡的主要原因之一。因此,发现肝癌转移的标志性蛋白具有非常重要的临床意义,它可以成为肝细胞癌发生和转移的指标。肌细胞增强因子2家族(myocyte enhancer factor 2,MEF2)是一类发挥多种生理功能的细胞内转录因子,该家族包括MEF2A、MEF2B、MEF2C和MEF2D 4个成员。作为该家族的成员之一,MEF2D在骨骼肌、心肌、神经组织和免疫系统的发育过程和正常生理功能的维持中发挥重要功能[5]。如同其他重要的发育相关因子一样,MEF2D也参与了癌症的发生过程。我们前期的研究发现,沉默MEF2D能够抑制肝癌细胞的增殖和其在体内的成瘤能力,而过表达MEF2D则能够提高肝癌细胞的增殖率。进一步的研究发现,MEF2D通过下调RPRM、CDKN1A、GADD45A和GADD45B促进细胞周期从S期向G2/M期的演进。微小RNA miR-122的下调可能是造成原发肝癌中MEF2D过表达的原因[8]。
近期有文献报道在肝癌细胞中MEF2家族4个成员在TGF-β的刺激下表达会上调[9]。近几年,很多关于MEF2D如何直接调控肿瘤发生的研究机制也陆续报道,最近已有研究表明MEF2D可以结合锌指蛋白从而促进结直肠癌细胞的上皮间质细胞的转移[10],除此之外,MEF2D还可以通过结合Pokemon 的启动子,两者协同促进肝癌细胞的浸润[11-12]。本实验课题中,我们通过对于基因芯片的分析以及细胞实验,验证MEF2D参与TGF-β诱导的EMT的发生,并且与Vimentin的表达量成正比。在前期研究中,蛋白激酶p38 MAPK是TGF-β非经典通路诱导EMT的关键因子之一[13],使用小分子抑制剂或干扰RNA抑制p38 MAPK的活性,会严重削弱TGF-β诱导EMT的效率[14]。有文献提示,在肝脏的星状细胞中蛋白激酶p38 MAPK可以促使MEF2D发生磷酸化[15],磷酸化后MEF2D结合DNA的能力增强,激活靶基因表达的活性也随之升高[16]。因此我们验证MEF2D在细胞侵袭转移当中的作用。本课题中我们下调MEF2D的表达会抑制高侵袭细胞PLC/PRF5的侵袭,相反当我们上调MEF2D的时候可以促进HepG2细胞的迁移能力,说明MEF2D可以促进细胞的侵袭转移。结合基因芯片和临床的样本,我们发现转移灶肿瘤中的MEF2D表达量高于原发灶位置肿瘤,这也再次证明MEF2D在肿瘤的发生当中发挥重要作用[8]。除此之外,有研究发现MEF2D能显著促进肠癌细胞系的迁移和侵袭能力[10],因此我们可以初步得出结论MEF2D可以作为肝癌肿瘤发生和转移的标志蛋白。
在今后的工作中,我们会探索MEF2D是如何结合下游EMT的启动基因,进一步研究MEF2D如何参与细胞侵袭转移的分子机制研究,为肝癌的复发和转移确定诊断标记物,对于肝癌的靶向治疗具有重大基础和临床意义。

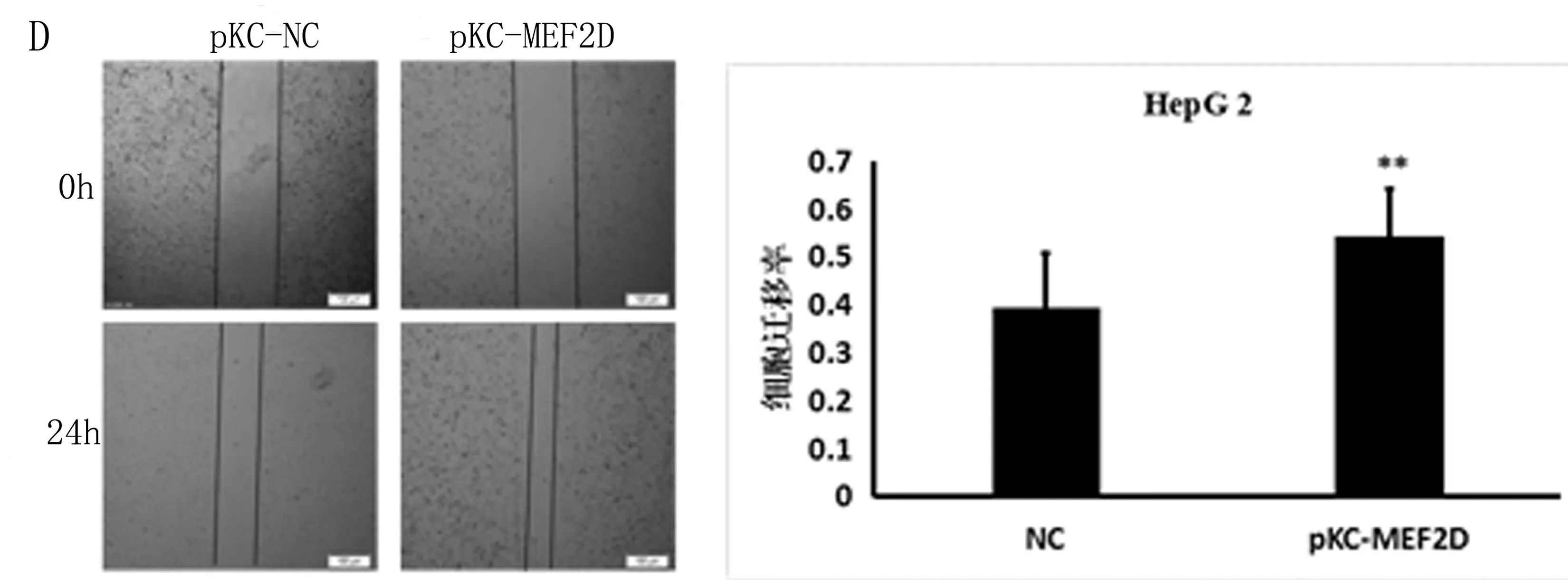
A: si-MEF2D可以有效地下调MEF2D蛋白的表达量; B:敲除MEF2D蛋白质后,对PLC/PRF5细胞侵袭效率的影响; C:质粒pKC-MEF2D上调MEF2D蛋白的表达量; D:过表达MEF2D蛋白对于HepG2细胞划痕的影响
图2 MEF2D参与细胞的侵袭转移


A:MEF2D在肝癌组织与癌旁组织中的表达差异;B:收集9粒肝癌转移样本与原发灶肝癌中验证MEF2D的表达差异;C:基因转移芯片GDS3091显示MEF2D在转移灶肝癌组织中与原发灶肝癌中的表达性差异。
图3 MEF2D在临床样本中的表达量差异
参考文献:
[1] Bao YS,Cao Q,Yang Y,et al. Expression and prognostic significance of Golgiglycoprotein73 (GP73) with Epithelial-mesenchymal transition (EMT) related molecules in Hepatocellular Carcinoma (HCC)[J]. Diagnostic Pathology,2013,8(1):197.
[2] Van ZF, Zulehner G, Petz M, et al.Epithelial-mesenchymal transition in hepatocellular carcinoma[J]. Future Oncology,2009,5(8):1169.
[3] Zhai B,Yan HX,Liu SQ, et al.Reduced expression of E-cadherin/catenin complex in hepatocellular carcinomas[J]. World Journal of Gastroenterology, 2008,14(37):5665-5673.
[4] Fransvea E,Angelotti U,Antonaci S, et al. Blocking transforming growth factor-beta up-regulates E-cadherin and reduces migration and invasion of hepatocellular carcinoma cells[J]. Hepatology,2008,47(5):1557-1566.
[5] Potthoff MJ,Olson EN.MEF2: a central regulator of diverse developmental programs[J].Development,2007,134(23):4131.
[6] Hoshida Y,Nijman SM,Kobayashi M, et al. Integrative transcriptome analysis reveals common molecular subclasses of human hepatocellular carcinoma[J]. Cancer Research,2009,69(18):7385.
[7] Budhu A,Forgues M,Ye Q-H,et al. Prediction of venous metastases, recurrence, and prognosis in hepatocellular carcinoma based on a unique immune response signature of the liver microenvironment[J]. Cancer cell, 2006,10(2):99.
[8] Ma L,Liu J,Liu L,et al.Overexpression of the transcription factor MEF2D in hepatocellular carcinoma sustains malignant character by suppressing G2-M transition genes[J]. Cancer Research, 2014,74(5):1452-1462.
[9] Yu W,Huang C,Wang Q,et al. MEF2 transcription factors promotes EMT and invasiveness of hepatocellular carcinoma through TGF-β1 autoregulation circuitry[J]. Tumour Biology the Journal of the International Society for Oncodevelopmental Biology & Medicine, 2014,35(11):10943-10945.
[10] Su L, Luo Y, Yang Z, et al. MEF2D transduces microenvironment stimuli to ZEB1 to promote epithelial-mesenchymal transition and metastasis in colorectal cancer[J]. Cancer Research, 2016,76(17):5054-5067.
[11] Hong X, Hong XY, Li T, et al. Pokemon and MEF2D co-operationally promote invasion of hepatocellular carcinoma[J]. Tumour Biology the Journal of the International Society for Oncodevelopmental Biology & Medicine, 2015,36(12):9885-9893.
[12] Kong J,Liu X, Li X, et al.Pokemon promotes the invasiveness of hepatocellular carcinoma by enhancing MEF2D transcription[J]. Hepatology International, 2016,10(3):493-500.
[13] Yu L, Hébert MC, Zhang YE.TGF-beta receptor-activated p38 MAP kinase mediates Smad-independent TGF-beta responses[J]. Embo Journal, 2002,21(14):3749.
[14] Galliher AJ,Schiemann WP.Src phosphorylates Tyr284 in TGF-beta type II receptor and regulates TGF-beta stimulation of p38 MAPK during breast cancer cell proliferation and invasion[J]. Cancer Research,2007,67(8):3752.
[15] Wang X,Tang X,Gong X,et al.Regulation of hepatic stellate cell activation and growth by transcription factor myocyte enhancer factor 2[J]. Gastroenterology,2004,127(4):1174-1188.
[16] Rampalli S,Li LF,Mak E,et al.p38 MAPK signaling regulates recruitment of Ash2L-containing methyltransferase complexes to specific genes during differentiation[J]. Nature Structural & Molecular Biology,2007,14(12):1150.

