高锰酸钾对牛粪微生物燃料电池长期产电性能的影响
沈建国,胡春光,辛言君*,王成显,2,张新旺,丁 宁
高锰酸钾对牛粪微生物燃料电池长期产电性能的影响
沈建国1,胡春光1,辛言君1*,王成显1,2,张新旺1,丁 宁1
(1.青岛农业大学资源与环境学院,青岛农村环境工程研究中心,山东 青岛 266109;2.上海应用技术大学化学与环境工程学院,上海 201400)
为探讨KMnO4用作阴极电子受体对牛粪长期发酵产电性能的影响,构建了以牛粪为主要底物的双室微生物燃料电池(Microbial fuel cell,MFC),考察了50,200,800mg/L KMnO4时牛粪MFC开路电势、输出电压、功率密度、有机底物变化及降解情况.结果表明:当KMnO4为800mg/L(MFC-800)时产生的开路电势和输出电压最高,分别达到1148mV和234mV,最大功率密度达177mW/m3,库伦效率和净产能最大,分别为18%和19.5MJ/t;电池运行203d后,MFC-800的COD去除率最高,达68.1%;在电池运行过程中,MFC-800的VFA浓度增加了3.5倍,达388mmol/L; pH值从7.25下降到5.71 下降了1.54;产电结束后,阳极发酵固态剩余物的成分符合《有机肥料》(NY525-2012)标准,可用于有机肥料生产.
微生物燃料电池;高锰酸钾;牛粪;发酵;产电
随着养殖业和农业的快速发展,畜禽粪便和农业秸秆产生量不断增加,对环境的污染威胁日益加剧[1].目前,对禽畜粪便和农业秸秆进行资源化处理利用的方式主要包括有机肥料加工、沼气生产、秸秆饲料化或材料化等[2],而新兴的微生物燃料电池(MFC)技术集发酵与产电为一体,利用产电微生物将有机物中的化学能直接转化为电能,避免了沼气燃烧发电的能量损失,能够大大提高农业固体废弃物的能源转化效率,具有极大的资源化利用效益[3].
微生物燃料电池主要通过阳极产电微生物降解有机物质,在呼吸链中产生电子和质子,电子通过细胞膜和纳米导线等直接或间接地传递到阳极上,然后经外电路到达阴极;质子在电池内部通过质子交换膜等由阳极室传递到阴极室,阴极电子受体接受电子和质子发生反应产生电流[4].近年来,MFC技术引起了科研工作者高度重视,在底物种类、底物预处理、含固率、电极间距、电极材料、阴极种类和电池构型等方面进行了广泛研究[5-7].研究证实MFC降解畜禽粪便的同时可以产生电能,但能量回收率较低,尤其在阴极电子受体方面,传统氧溶解度低且氧扩散对阳极影响较大,难以提高电能输出,需要进一步研究.
为了降低农业固体废弃物对环境的污染,提高其资源化利用效率,本研究以牛粪和玉米秸秆为底物,构建双室型MFC,研究KMnO4作为电子受体对牛粪长期发酵产电性能的影响.在MFC运行过程中监测开路电势和外电压的变化规律,分析MFC输出功率密度、库伦效率与净产能,以及阳极液化学需氧量(chemical oxygen demand, COD)、挥发性脂肪酸(volatile fatty acid,VFA)和pH的变化过程等,探讨KMnO4浓度对牛粪发酵产电、微生物生长和电极的影响.
1 材料与方法
1.1 MFC装置构建与启动
选用双室型MFC反应器如图1所示,由阴极室(6´9´15cm)、阳极室(12´9´15cm)和外电路三部分构成,两室之间由阳离子交换膜(4´4cm)隔开.阴阳极室有效运行体积分别为700mL和1200mL,阴阳极室中石墨颗粒的填充率分别为25%和10%,阴阳电极材料均为石墨碳颗粒-碳棒,阴阳电极由铜线连接并负载1kΩ电阻(R).输出电压由16通道数据采集系统(LR6116A,杭州联测)每隔60s自动采集一次.运行环境温度控制在(30±1)℃.
牛粪和玉米秸秆取自青岛第一奶牛场,两种材料自然风干后粉碎,过1mm筛备用,其主要成分见表1.阴极液为50mmol/L的PBS溶液,电子受体为50,200,800mg/L的KMnO4,由此电池分别表示为MFC-50,MFC-200,MFC-800.阳极液含固率为10%,以牛粪为主要发酵底物,玉米秸秆调节C/N为30.阳极液填充前利用900W超声处理20min,阳极底物采用一批次填充.接种液取自先前研究保存的驯化菌液[5],运行前阳极室通入N2约10min,以保证厌氧状态.阴阳极室均采用强力机械搅拌器每隔1h搅拌3min.
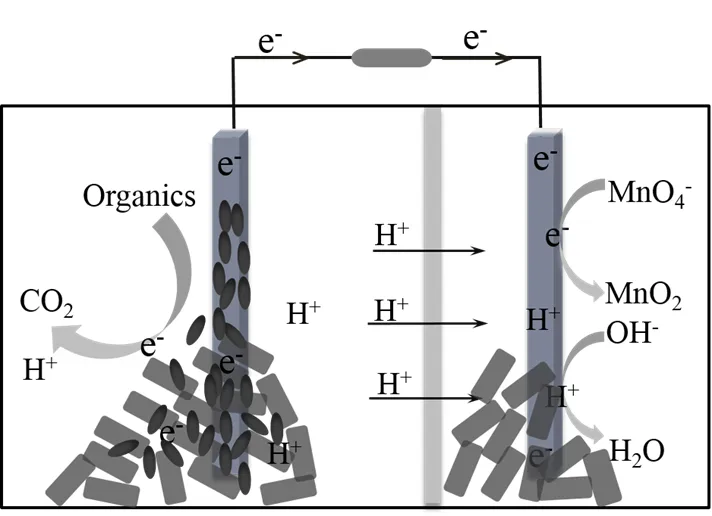
图1 MFC结构示意
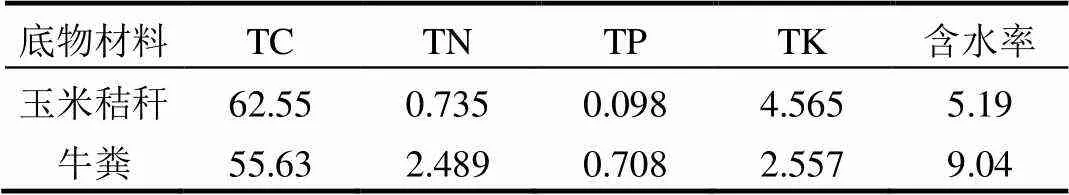
表1 底物材料(干基)的主要成分(%)
1.2 分析方法
采用输出电压、功率密度、库伦效率和净产能等指标对MFC的产电性能进行评价,功率密度和库伦效率计算方法同[8],净产能为单位质量牛粪可回收的电能,计算公式如下:
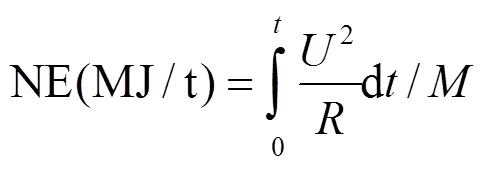
式中:为输出电压;为外阻(1kΩ);为牛粪质量.采用COD(重铬酸钾法),VFA(滴定法),pH(pH计法),总固体(total solid,TS)及挥发性固体(volatile solid,VS)(烘干恒重法)对阳极液特性变化进行分析[9].有机质、总碳(total carbon,TC)、总氮(total nitrogen,TN)、总磷(total phosphorus, TP)、总钾(total potassium,TK)和含水率均按照标准方法(NY525-2012)测定[10].采用扫描电镜(scanning electron microscopy,SEM)对阴阳电极变化进行形貌表征.
2 结果与讨论
2.1 KMnO4浓度对MFC产电性能的影响
2.1.1 对开路电势和外电压的影响 不同浓度KMnO4作为阴极电子受体,负载1kΩ条件下, MFC的开路电势和外电压变化过程如图2所示.由图2可见,随着MFC运行,开路电势(图2a)和外电压(图2b)均先上升后下降.启动运行初期,开路电势和外电压迅速上升,12d后,开路电势趋于稳定,且15d后,外电压趋于稳定.在产电稳定阶段, MFC开路电势和外电压随着KMnO4浓度的增大而增大,由此可见,开路电势和外电压与KMnO4浓度成正比.稳定阶段,MFC-800开路电势和外电压均最高,分别为1153mV和234mV,比MFC-200,MFC-50分别高146,368mV和75, 96mV.随着KMnO4浓度增大,MFC稳定产电周期也变长,运行40d后,MFC-50开路电势开始下降,而MFC-200,MFC-800分别运行43,49d后开路电势才开始下降.MFC-50运行25d后外电压便迅速下降,而MFC-200,MFC-800分别运行30, 40d后外电压才开始下降.整体来看,不同KMnO4浓度条件下,MFC外电压稳定周期均短于开路电势,可能由于底物发酵降解以及电子受体反应引起电池内部浓差极化和欧姆极化加重,导致能量损失[11].
2.1.2 对功率密度的影响 不同浓度KMnO4阴极条件下,日均输出功率密度变化过程如图3所示.由图3可见,随着MFC运行,功率密度先增大再降低.运行稳定前期,随着底物发酵降解,产生的电压快速上升,功率密度不断上升,14d后功率密度达到最大.最高稳定阶段,MFC-800功率密度为177mW/m3,比MFC-200、MFC-50分别高67,107mW/m3,运行25d后功率密度开始下降.整体来看,随着KMnO4阴极液浓度增大, MFC输出功率密度增大,且最高稳定时间也增长,表明电子受体越充足越有利于质子和电子消耗反应,进而促进阳极底物发酵,提高产电能力.
2.1.3 对库伦效率和净产能的影响 不同浓度的KMnO4作为电子受体对MFC库伦效率和净产能的影响如图4所示.由图4可知,随着KMnO4浓度增大,MFC的库伦效率和净产能增大.MFC- 50、MFC-200、MFC-800的库伦效率分别获得9%、11%、18%,净产能分别达到6.58,9.10, 19.5MJ/t,表明阴极电子受体越充足,越会促进阳极底物发酵产电,进而减少非产电消耗,提高有机物中的化学能转化为电能的效率.
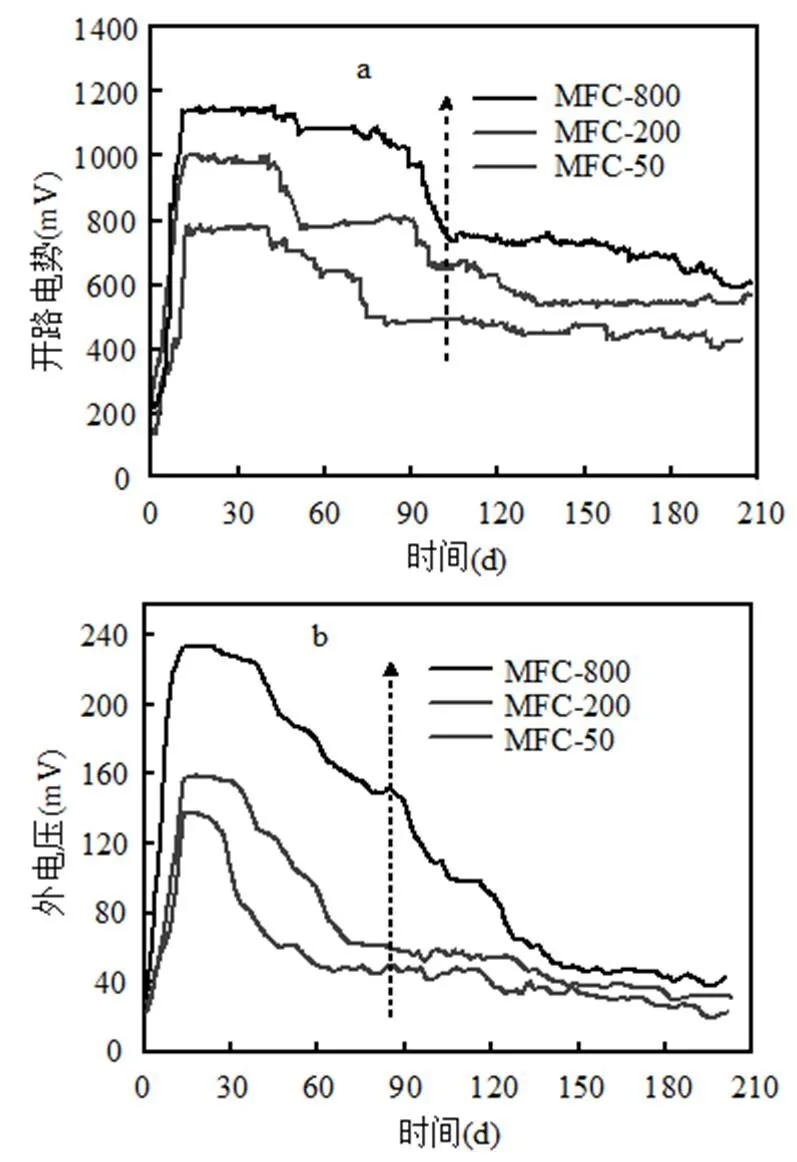
图2 开路电势(a)和外电压(b)随时间变化
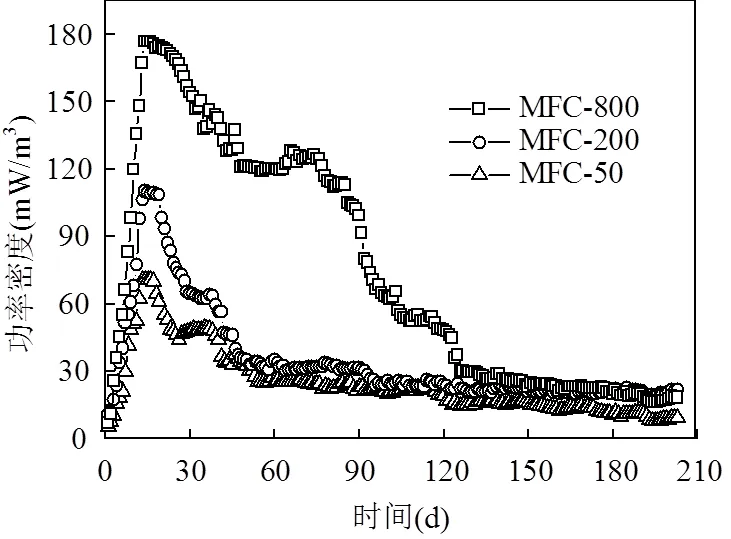
图3 日均输出功率密度随时间的变化
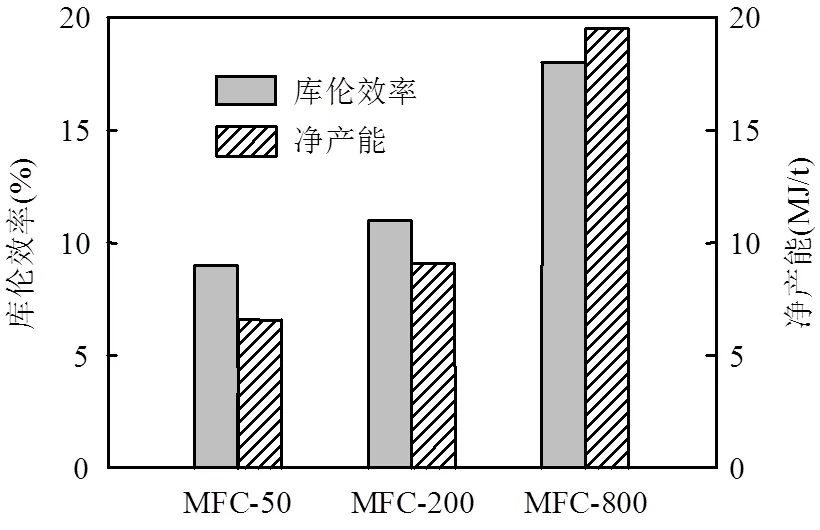
图4 电池库伦效率和净产能输出
2.2 KMnO4浓度对阳极底物发酵过程的影响
2.2.1 COD随时间变化 COD含量与去除变化过程如图5所示.由图5可见,MFC接种启动后,微生物很快适应了新环境,代谢活性增强,COD降解迅速,且降解速率随着KMnO4浓度的增大而加快,运行203d后,MFC-800、MFC-200、 MFC-50阳极液中COD含量从最初的92.58g/L分别减少到29.52,30.33,34.81g/L;MFC-800的COD去除率最大,为68.1%,而MFC-200和MFC-50的去除率分别为67.2%和62.4%.由此可见,不同阴极时电池产电性能差异较大,而最终COD去除率无明显差异,表明被降解的底物中相当一部分被非产电菌利用.
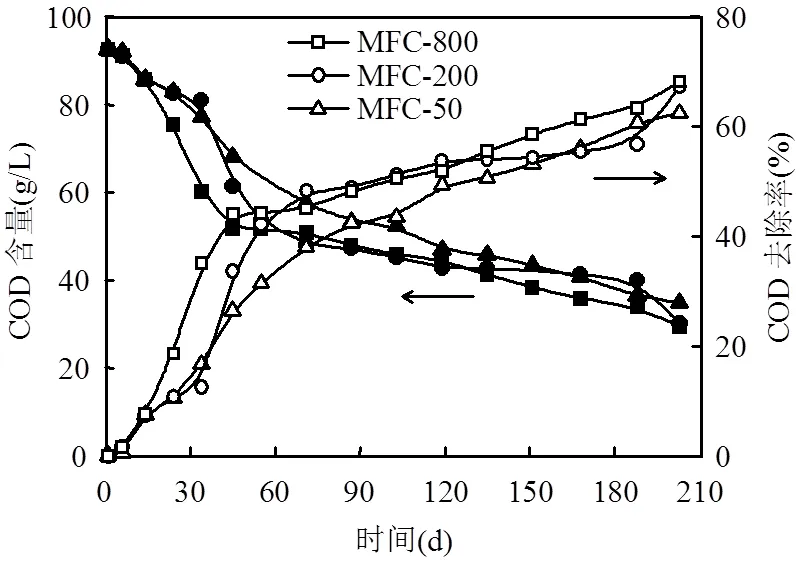
图5 KMnO4浓度对COD去除的影响
2.2.2 VFA和pH随时间变化 底物发酵产电过程中,VFA和pH随时间变化曲线如图6所示.
由图6可见,随着MFC启动运行,阳极液VFA浓度(图6a)快速增加,20d后升到最高,随后逐渐下降;而pH(图6b)快速降低,23d后降到最低,随后逐渐升高并恢复初始pH值.MFC-800、MFC-200、MFC-50阳极液中VFA浓度最高分别达到388,305,221mmol/L,比初始浓度分别增加了302,219,135mmol/L;而pH值最低分别为5.71,5.83,5.98,比初始pH分别降低了1.54,1.38, 1.28;表明KMnO4阴极液浓度越大,VFA浓度上升越高,pH下降越低,进而再次说明阴极电子受体越充足,阳极微生物代谢活性越强,底物发酵转化越多,提高VFA浓度的同时降低了pH值.
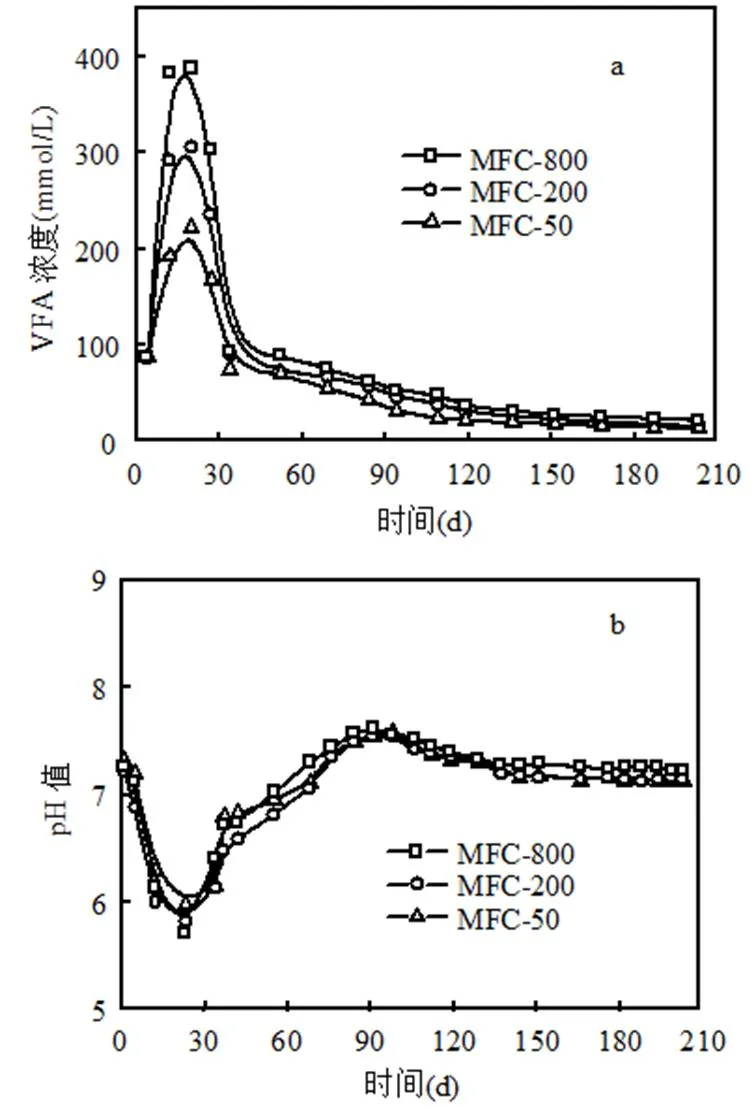
图6 VFA浓度(a)和阳极pH(b)随时间的变化
随着KMnO4浓度增大,阴极接受电子和质子发生还原的能力增强,从而促进阳极底物降解,电能输出增多.MFC启动运行后,前20d,VFA浓度迅速上升,输出电压不断增大并达到稳定,稳定期内VFA产生率与消耗率均很大,而COD含量和pH显著下降,主要由于微生物很快适应环境,底物发酵水解酸化生成VFA的速率高于产电微生物分解VFA的速率,导致VFA在阳极室大量积累而VFA是包括甲酸、乙酸、丙酸、丁酸和戊酸等碳链为1~6的有机脂肪酸,其积累会导致阳极液pH降低[12].从20d至45d,VFA和COD含量快速下降,而pH相应增加,但产电依然稳定一段时间,说明此时的产电菌活性很高,VFA消耗率大于产生率.从45d至90d,VFA和COD含量逐渐下降,而pH值逐渐增加,此阶段COD含量依然很高,电池可维持较长时间的产电,说明底物酸化产生VFA的同时被产电菌消耗产电,且随着运行时间延长,阳极室中易生化降解物质不断被消耗,难降解有机物含量增大,对VFA下降起到了一定作用[13].90d后, COD、VFA、pH值基本趋于稳定.VFA下降,一是由于产电菌和产甲烷菌的消耗,二是底物含量逐渐下降,微生物活性也随至降低,水解产酸减慢[14].pH下降的其他原因可能有微生物在降解底物的同时产生CO2和质子,CO2溶解形成碳酸,而质子不能高效穿过阳离子交换膜传递至阴极室参与反应[15-16].当阳极pH低于6时,会减弱产电菌代谢活性,导致底物发酵降解减慢[17].
2.2.3 阳极液发酵产电前后TS和VS含量变化 不同浓度KMnO4阴极条件下,MFC运行结束时阳极液中TS和VS含量如图7所示.MFC启动运行时,TS、VS含量分别为110,97.5g/L.由图7可知,MFC产电结束后,MFC-800、MFC- 200、MFC-50阳极液中TS含量分别为38.1,41.8, 44.3g/L,而VS含量分别为29.6,32.8,33.1g/L.可见,产电结束后各运行电池阳极液中TS和VS含量并无明显差异,且电池库伦效率均不高,表明被降解的底物中一部分被非产电菌消耗利用,进而解释了各电池运行结束时最终COD去除率无明显差异的原因.
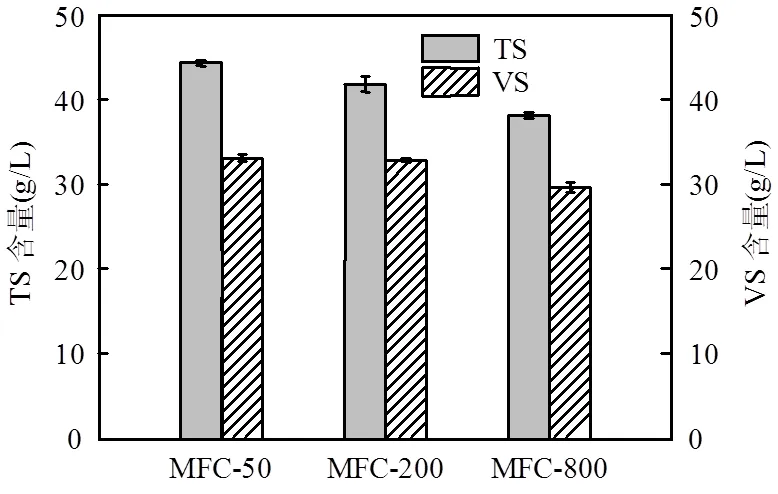
图7 产电后阳极液中TS和VS含量
2.3 KMnO4浓度对阴阳电极的影响

图8 石墨碳(a),运行结束后MFC-50、MFC-200、MFC-800阳极(b,c,d)和阴极(e,f,g)的SEM图;MFC-800阳极(h)和阴极(i)的EDX图
为了分析不同浓度KMnO4作为阴极电子受体时对阴阳电极的影响,使用扫描电镜对阴阳电极进行形貌和元素组成进行了分析,结果如图8和表2所示.与原石墨碳电极(图8a)的SEM图相比,各运行电池阳极表面均有生物膜附着生长,且MFC-50(图8b)、MFC-200(图8c)和MFC-800(图8d)阳极的生物膜厚度依次增大.与原电极相比,MFC-800阳极的EDX图(图8h)和表面元素组成(表2)表明由于生物膜的黏附生长,阳极表面元素组成略发生变化.阴极表面均有一层沉积物覆盖,且沉积物量由低到高依次为MFC-50(图8e)、MFC-200(图8f)和MFC-800(图8g),表明KMnO4浓度越高,质子从阳极室传递至阴极室后,在阴极表面形成越强的氧化环境,同时从外电路传递过来的电子更容易被利用消耗,在阴极表面生成越多的沉积物.MFC-800阴极的EDX图(图8i)和表面元素组成(表2)显示增加的氧(O)量约是锰(Mn)的两倍,表明阴极表面生成的沉积物为MnO2,由于MnO2固态不导电,沉积在阴极表面后会加重阴极极化,从而降低阴极电极电势,影响产电[18].此外,由于离子透过隔膜从阳极扩散到阴极室,引起阴极表面磷(P)、硫(S)、氯(Cl)和钾(K)等元素组成略有增加.
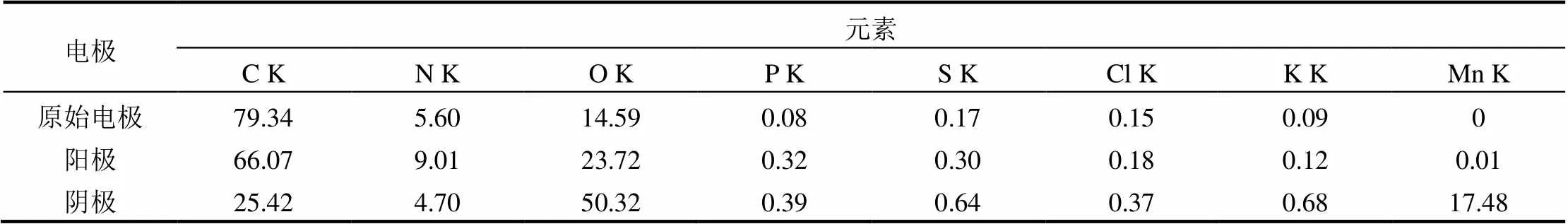
表2 产电前后MFC-800电极表面元素组成(%)
2.4 阳极底物发酵固态剩余物成分分析
根据中华人民共和国农业行业《有机肥料》(NY525-2012)标准要求对阳极底物发酵产电固态剩余物进行了检测,其测定结果见表3.由表3可知,各运行电池阳极底物发酵固态剩余物中的有机质、总养分和pH值均达到标准要求,可以用作有机肥加工原料.
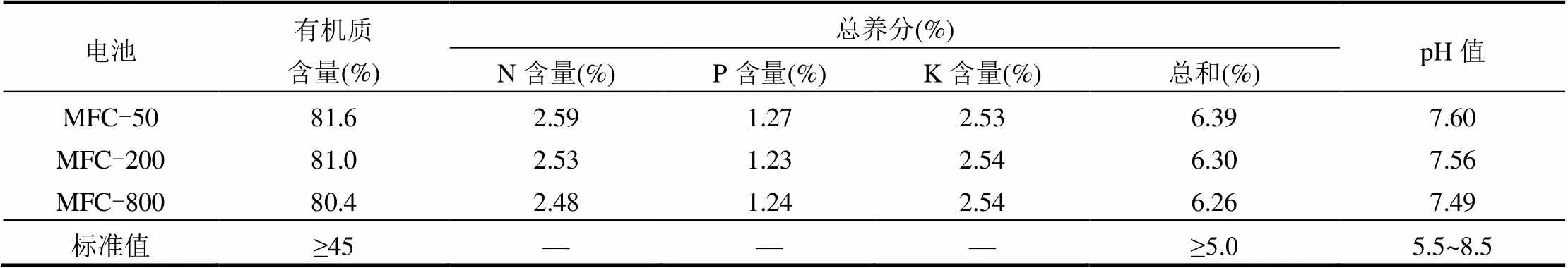
表3 发酵固态剩余物(干基)的特性
注:N, P, K分别以TN, P2O5, K2O计,标准参考中华人民共和国农业行业标准-《有机肥料》(NY525-2012),” —"为无标准值.
3 结论
3.1 KMnO4作为电子受体时,随着KMnO4浓度增大,电能输出能力增强.MFC-800的开路电势和外电压达到最高,分别为1148mV和234mV;功率密度达到最大,为144mW/m3;库伦效率获得18%,净产能实现19.5MJ/t.
3.2 产电过程中,MFC-800的VFA浓度最高,达388mmol/L, pH值最低降至5.71;运行203d后MFC-800的COD去除率最高,达68.1%.
3.3 KMnO4浓度越高,阳极表面生物膜生长越厚,阴极表面MnO2沉积越多.
[1] 王军霞,徐 菲,刘瑞民,等.我国畜禽养殖总量空间热点分析及主要污染物核算 [J]. 农业环境科学学报, 2017,36(7):1316- 1322.
[2] 朱丽平,许修宏,张文浩,等.牛粪堆肥中反硝化细菌与理化参数的关系 [J]. 农业环境科学学报, 2016,35 (9):1781-1787.
[3] Shen, J, Wang, C, Liu, Y, et al. Effect of ultrasonic pretreatment of the dairy manure on the electricity generation of microbial fuel cell [J]. Biochemical Engineering Journal, 2017,129(1):44-49.
[4] Santoro C, Arbizzani C, Erable B, et al. Microbial fuel cells: From fundamentals to applications. A review [J]. Journal of Power Sources, 2017,356(13):225-244.
[5] 陈悦佳,赵庆良,柳成才.冻融处理对不同阴极构型MFC产电及有机物降解的影响 [J]. 中国环境科学, 2015,35(5):1359-1367.
[6] 王成显,沈建国,张小梅,等.C/N比和含固率对牛粪发酵产电性能的影响 [J]. 农业工程学报, 2016,32(5):245-250.
[7] 王成显,张艺臻,吴淑娜,等.含固率和电极间距对牛粪发酵产电性能的影响 [J]. 环境工程学报, 2016,10(1):485-489.
[8] 付国楷,张林防,郭 飞,等.榨菜废水MFC多周期运行产电性能及COD降解 [J]. 中国环境科学, 2017,37(4):1401-1407.
[9] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[10] NY 525-2012中华人民共和国农业行业标准(有机肥料) [S]. 北京:中国标准出版社, 2012.
[11] Molognoni D, Puig S, Balaguer M D, et al. Multiparametric control for enhanced biofilm selection in microbial fuel cells [J]. Journal of Chemical Technology & Biotechnology, 2016,91(6): 1720-1727.
[12] 黄国正,郝小旋,张 姣,等.污泥厌氧发酵液燃料电池的性能及电子供体分析 [J]. 中国环境科学, 2015,35(12):3595-3601.
[13] 李金涛,张少辉.反硝化微生物燃料电池的基础研究 [J]. 中国环境科学, 2012,32(4):617-622.
[14] 刘 玥,袁林江.一株产电菌Klebsiella oxytoca d7的分离及产电机理 [J]. 中国环境科学, 2017,37(9):3540-3548.
[15] Zhao Q, Yu H, Zhang W, et al. Microbial fuel cell with high content solid wastes as substrates: a review [J]. Frontiers of Environmental Science & Engineering, 2017,11(2):13.
[16] 周秀秀,顾早立,郝小旋,等.剩余污泥燃料电池处理含铬废水的效能及机理 [J]. 中国环境科学, 2014,34(9):2245-2251.
[17] Jannelli N, Nastro R A, Cigolotti V, et al. Low pH, high salinity: Too much for microbial fuel cells? [J]. Applied Energy, 2017, 192(4):543-550.
[18] Eliato T R, Pazuki G, Majidian N. Potassium permanganate as an electron receiver in a microbial fuel cell [J]. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2016,38(5): 644-651.
Effects of potassium permanganate on electricity generation of cattle manure microbial fuel cell with a long-term operation.
SHEN Jian-guo1, HU Chun-guang1, XIN Yan-jun1*, WANG Cheng-xian1,2, ZHANG Xin-wang1, DING Ning1
(1.Qingdao Engineering Research Center for Rural Environment, College of Resources and Environment, Qingdao Agricultural University, Qingdao 266109, China;2.School of Chemical and Environmental Engineering, Shanghai Institute of Technology, Shanghai 201400, China)., 2018,38(5):1712~1718
In order to investigate the effects of KMnO4as the electron acceptor on the electricity generation of cattle manure fermentation with a long-term operation, the dual-chamber microbial fuel cell (MFC) was designed with cattle manure as main substrate, and the effects of KMnO4(50, 200, 800mg/L) on electricity generation were analyzed. During MFCs operation, the variation of parameters such as open-circuit potential, external voltage, power density, coulombic efficiency and net energy production were analyzed. Results showed that when the concentration of KMnO4was 800mg/L, the highest open-circuit potential and external voltage of 1148mV and 234mV were obtained, and the power density reached 177mW/m3at 1kΩ external load. The maximum coulombic efficiency and net energy production arrived 18% and 19.5MJ/t. After 203 days, the removal rate of COD arrived 68.1%. During the operation of cells, the concentration of VFA and pH changed obviously. The VFA of MFC-800 increased to 388mmol/L, compared with the initial concentration, increased by 3.5times. The pH value decreased from 7.25 to 5.71. In addition, the nutrition content of anodic fermentation residue met the standard of organic fertilizer (NY525-2012). Therefore, the residue of anode fermentation could be used for organic fertilizer production.
microbial fuel cell;potassium permanganate;cattle manure;fermentation;electricity generation
X712,X713
A
1000-6923(2018)05-1712-07
2017-09-29
国家自然科学基金资助项目(51478490,51408350)
* 责任作者, 教授, xintom2000@126.com
沈建国(1990-),男,山东菏泽人,青岛农村环境工程研究中心硕士研究生,主要从事固体废物资源化利用方面的研究.

