PDCA在我院医疗器械安全(不良)事件管理中的应用
蔡银
重庆市南川区人民医院 医学装备科,重庆 408400
引言
医疗器械安全(不良)事件管理作为医疗器械临床使用安全管理的重要组成部分,越来越受到各级管理部门的重视。国家食品药品监督管理总局建立了网络直报系统,并且每年要求各级药监管理部门对一类设备进行不良事件重点监测,也下达了相应的任务[1-2]。
PDCA是20世纪50年代由美国著名的质量管理专家戴明博士提出,又称为“戴明循环”,PDCA循环是英文计划(Plan)、实施(Do)、检查(Check)和处理(Action)的缩写。其左右能使任何一项活动游戏进行,并在提供管理质量和效益所进行的计划、实施、检查和处理等工作中不断循环,持续改进[3-4]。
我院自2012年起开展医疗器械安全(不良)事件的监测管理工作,并抓住2013年创建三甲医院的契机,引入PDCA质量管理工具狠抓医疗器械不良事件管理工作。通过发现问题、查找原因(计划)、制定措施并严格执行(实施),我院医疗器械安全(不良)事件管理工作到2016年底取得了明显的效果(检查),大幅提升了不良事件的上报例数和上报质量,降低了不良事件造成的后果和带来伤害的机率,促进和完善了我院医疗器械临床使用安全管理体系。
1 发现问题
通过对2013年医疗器械不良事件进行统计分析,我们发现全院在2012~2013年期间存在医疗器械安全(不良)事件上报率不高、报告内容和内涵质量不高等问题,这大大影响了我院医疗器械临床使用安全管理工作,对我院的医疗安全也提出了新的挑战。
1.1 原因分析
通过对我院医疗器械安全(不良)事件管理工作的详细分析,目前管理工作存在问题的主要原因有:① 医务人员责任心不强、安全上报意识淡薄;② 管理制度不完善,各部门分工不明确等[5-7]。
1.2 上报流程不优化
上报人需填写纸质报告单后科室负责人签字才能上交到医学装备科,因为临床工作繁忙多数医务人员抱着多一事不如少一事的心态,导致只要没对病人造成影响则没有人上报。
(1)怕追责。多数医务人员认为上报不良事件后,医学装备科在进行追踪调查时会对个人追责,因此怕承担责任,不愿上报。
(2)意识淡薄。医务人员普遍认为上报不良事件没有实质性的作用,对已发生的事实没有任何补救的效果,质量意识淡薄。
(3)分工不明确。多数医务人员在上报时分不清各类不良事件的主管部门,对于不良事件的分类不清楚,统一将不良事件上报到护理部或者医疗科。
(4)报告内容填写不完善。报告内涉及医疗器械的基本信息填写不全,尤其是注册证号、产品效期、产品批号等填写不清楚,事件发生的初步原因敷衍了事[8]。
2 制定整改措施
针对目前管理工作存在的问题,我院制定了一系列的整改措施[9-11],包括:① 院内建立健全全院“医疗安全(不良)事件制度”,将各类不良事件明确界定,并划分对应的主管部门;② 建立院内不良事件网络直报系统;③ 对不良事件的分类、主管部门、上报流程进行全院培训;④ 将不良事件的上报情况纳入科室考核体系,对漏报的进行扣分惩罚,与绩效挂钩;⑤ 要求科室建立医学装备管理卷,将修改后的“医疗器械不良事件上报制度和流程”装卷,并组织科室学习。
3 实施
3.1 建立制度
(1)由质量与安全管理办公室统一制定全院“医疗安全(不良)事件上报制度”,制度中明确事件类型、主管部门和奖惩措施。制度中明确提出医疗器械不良事件概念,要求凡是与医疗设备、器械和医用耗材相关的不良事件均上报至医学装备科。
(2)由医学装备科制定“医疗器械不良事件监测管理制度”,并优化相应监测上报流程。
3.2 院内网络直报系统操作培训
(1)2013年9月与软件公司签订合同开发网络直报系统,并于2013年11月至2014年1月期间分批对全院员工进行培训。
(2)2014年1月17日,全院正式全面实行网络直报,取消纸质上报。安全(不良)事件上报网址:http://172.168.9.3:8000/IcelineIar/,报告界面,见图1。

图1 安全(不良)事件报告界面
3.3 纳入医疗设备使用情况考核标准
将医疗器械不良事件的上报情况纳入考核,并根据每年不良事件上报情况调整细化该项考核内容,见表1。

表1 2013~2016年度医疗器械不良事件上报考核标准变化表
3.4 建立医学装备卷
要求临床科室建立医学装备管理卷,并将“医疗器械不良事件监测管理制度”下载后学习,将科室上报的医疗器械不良事件报告表存档,将医学装备科下发的全院每季度医疗器械不良事件分析报告存档学习。
3.5 加大追踪分析力度和风险预警的及时发布
医学装备科根据上报的医疗器械不良事件情况,每月统计分析、持续追踪。并对追踪分析和不良事件的处理结果形成纸质报告反馈到科室。而针对风险程度较高、涉及全院多个科室的医疗器械,及时通过院内OA平台发布风险预警,并组织召回和更换[12]。
4 管理成效
经过近几年的实施与整改,全院医疗器械安全(不良)事件管理工作初见成效,促进和完善了医疗器械临床使用安全管理体系,也进一步增强了我院医疗器械风险管理能力。
4.1 报告数量逐年增长
经过大家的共同努力,全院医疗器械不良事件上报例数逐年增加,由2013年的16件上升至2014年的33件,2014年与2013年对比数量翻了一倍;2015年合计上报48例,再增长15例,2016年则共计上报84例,较2015年再增长75%。将2013~2016年的数据进行对比发现不良事件的上报例数呈指数增长,见图2。
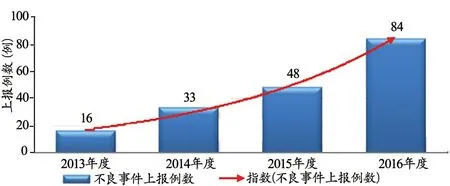
图2 2013~2016年度不良事件上报例数对比图
4.2 报告主体变化
护士仍然占据报告主体的绝大部分,医生主动上报不良事件的例数也有所增加(图3),说明经过宣传教育和培训学习,医生的安全意识和主动报告意识已逐渐加强。另外,技师和装备科工程师及管理人员也逐渐参与进来,2016年工程师等其他工作人员共计上报5例不良事件。
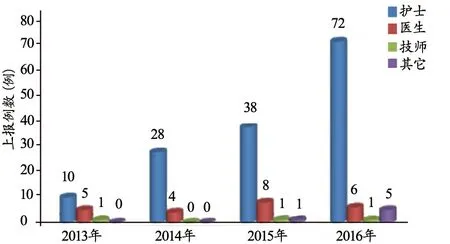
图3 2013~2016不良事件报告主体对比图
4.3 有伤害报告例数逐年下降
从不良事件对病人和医务人员造成伤害的情况进行统计分析发现,造成后果带来伤害的不良事件例数逐年减少,呈下降趋势,见图4。这充分说明由于不良事件管理力度加大,加强了医务人员操作前认真检查核对的意识,有效减少了将存在隐患的医疗器械用于病人的情况,从而降低了不良事件造成后果和带来伤害的发生率。
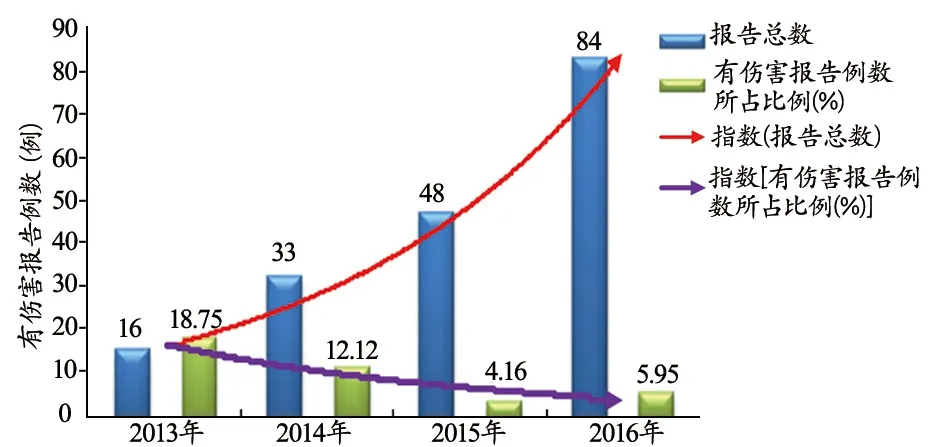
图4 2013~2016有伤害报告例数占比趋势图
4.4 产品管理类别方面
从不良事件涉及医疗器械的管理类别进行统计分析发现,二类产品和三类产品发生不良事件的例数较多,增幅明显,说明医护人员对二类和三类风险较高器械的关注度明显提高;而一类产品上报不良事件的情况呈下降的趋势,整体情况呈正态分布,见图5。

图5 2013~2016不良报告涉及产品类别情况对比图
4.5 排名前三位的医疗器械产品分类目录情况
将2015年度和2016年度前三位医疗器械产品分类目录(表2~3)对比来看,6866医用高分子材料及制品虽然仍处于上报率最高的产品,但其占比有所下降;而6815注射穿刺器械类和6856病房护理设备及器具类取代6845体外循环及血液处理设备及6865医用缝合材料及粘合剂位于第二和第三,且占比均超过10%。以上数据说明医护人员对器械的关注范围增加,不仅仅局限于材料类产品,对平时更多使用的穿刺类和其它设备也更加注意其不良事件的发生情况。

表2 2015年度排名前三位的医疗器械产品分类

表3 2016年度排名前三位的医疗器械产品分类
4.6 事件追踪成果
2014年度完成对心内科一次性使用无菌加药器损坏、中医科输液器漏液和手术麻醉科缝合针断裂这3例事件的追踪分析,更换损坏或疑似有问题的产品,并形成报告反馈到使用科室[13]。
2015年度追踪分析3例,第一例针对中医科针灸针断针事件,组织中医科、医疗科和质量管理办公室进行讨论,通过鱼骨图进行根因分析,提出相应整改措施:要求医生行针时记录患者所用针灸数,取针时进行核对,从而避免将针残留在病人体内的事件再次发生。第二例针对耳鼻咽喉科一次性注射器内有异物事件,向全院发布预警信息,要求各临床科室检查库存的该批次产品是否有类似现象,经调查显示全院其他科室并无这种瑕疵产品。随后我科将该事件反馈厂家,对该批次产品予以更换。第三例针对妇儿手术麻醉科医用缝合线断裂事件,妇儿手术室3个月内连续3次发生缝合线断裂,我科组织厂家、供应商与使用医生沟通,并将断线残余部分送国家食品药品监督管理局北京医疗器械质量监督检验中心进行检验,结果显示该缝线强度没有问题。因此,我科邀请厂家工程师对手术室和妇产科医生进行操作培训,并告知科室在使用时对肥胖病人或者多次剖宫产妊娠的病人选择强度高一点的缝线,且一旦怀疑缝线强度有问题立即更换。以上3例事件,均形成追踪分析报告反馈科室。
2016年度追踪分析16例,由于器械本身原因进行退换货9次,由于操作人员原因邀请厂家培训2次。
4.7 发布风险预警3次
截止到2016年底,发布风险预警3次,分别为:一次性使用流量设定微调式输液器输液速度不精准,一次性使用吸痰管规格型号不符和飞利浦V200呼吸机电源组件存在安全隐患问题。通过风险预警,并召回问题产品,确保临床使用合格产品,保证医务人员和病人的安全。
通过风险预警和持续追踪,完成品牌更换3次:
(1)第一次为2014年度针对一次性使用流量设定微调式输液器输液速度不精准的问题进行全院风险预警发布,并召回全院同型号同批次产品,更换该批次产品。时隔半年,在2015年3月,再次接收到一次性使用流量设定微调式输液器输液速度不精准的不良事件。因此,鉴于该输液器的特殊性,考虑到病人的安全,更换该品牌输液器。
(2)第二次为2016年度针对一次性使用吸氧管内置湿化瓶容易膨胀而存在安全隐患进行全院风险预警发布,同时在与厂家反馈沟通无果后更换该品牌吸氧管。
(3)第三次为2016年针对一次性注射器行持续追踪发现,成都新津事丰的注射器反复出现无针头、针尖和针筒破裂及包装开口事件多达13例,经多次与厂家沟通反馈无果后更换该品牌注射器。
5 经验总结
为了更好的进行不良事件管理,我院引入PDCA质量管理工具,从建立制度、规范流程、宣传培训并形成有效的考核机制等方面进行规范和有效管理。通过这一系列措施的实施,我院医疗器械不良事件的上报例数和上报质量均有大幅度的提升。而通过对典型事件的追踪分析和对病人安全影响较大医疗器械的风险预警,及时有效的中止了隐患产品的使用,有效降低了不良事件造成后果和带来伤害的机率。通过不良事件的有效管理促进和完善了医疗器械临床使用安全管理,为患者提供了安全有效的医疗器械。综上,通过使用PDCA质量管理工具,我院医疗器械安全(不良)事件管理工作得到规范和有效管理,医疗器械临床使用安全管理体系进一步完善,同时我院医疗器械风险管理能力也得到大幅提升[14-16]。当然,我们的管理也还存在不足之处,比如迟报、上报内容填写不完整等,这也正是我们接下来的管理中需改进的地方。
[参考文献]
[1] 郑龙.浅谈基层医院医疗器械不良事件监测体系建立[J].中国医疗设备,2016,12(31):156-158.
[2] 马宁,翟伟,周立新.北京市三级医疗机构医疗器械不良事件监测体系现状评估[J].中国药物警戒,2012,9(8):464-469.
[3] 许良春,郑志远,习湧平,等.应用PDCA循环法管理医院医疗器械不良事件[J].中国医疗设备,2013,5(28):81-83.
[4] 胡立勇,田君鹏,李璟,等.根本原因分析法在医疗器械不良事件分析中的应用[J].中国医疗设备,2012,1(31):166-174.
[5] 张学宁,王玲,王刚,等.医疗器械不良事件报告质量分析及改善对策[J].中国药物警戒,2015,8(12):479-482.
[6] 陈宏军.我院医疗器械不良事件监测人知道调查分析[J].中国医疗设备,2015,10(30):167-169.
[7] 莫喜娟,周建武,张金.我院医疗器械不良事件的综合管理[J].中国医疗设备,2016,3(31):158-160.
[8] 张臣舜,马禄娟,唐思敏,等.医院医疗器械不良事件报告数量偏少的原因[J].医疗装备,2016,29(21):52-53.
[9] 岑铨华,温雪君.医疗器械不良事件监测的管理[J].医疗装备,2017,1(30):89-90.
[10] 房坤,胡淑婷,陈玉俊,等.医疗器械不良事件监管探讨[J].中国医疗器械杂志,2016,6(40):445-447.
[11] 王晓慧,王桂芳,罗晓.护理不良事件分析与防范对策[J].全科护理,2012,10(21):1985-1986.
[12] 黄琳,赵玉娟,田月洁.医疗器械严重伤害事件分析评价方法探讨[J].中国医疗设备,2015,30(8):130.
[13] 刘远,陈文霞,李甜,等.医疗器械不良事件案例分析[J].中国医学装备,2016,13(9):119-120.
[14] 王建波.医院医疗器械不良事件的监测[J].医疗装备,2015,(37):92-93.
[15] 余永强,郑玉建.我国医疗器械不良事件监测现状研究[J].中国药物警戒,2008,5(1):24-27.
[16] 王艳.医疗器械不良事件监测工作的思考[J].医疗装备,2015,28(2):66-68.

