ADC值对乳腺导管原位癌侵袭成分的研究价值
郭宏兵,刘菲,史新乐,赵一林,邹殿俊
河北北方学院附属第一医院 影像科,河北 张家口 075000
引言
乳腺导管原位癌(Ductal Carcinoma in Situ,DCIS)是导管内恶性上皮细胞增殖,尚未侵袭到基底膜。活检是确诊导管原位癌金标准,但因样本取材的限制,可能低估导管原位癌的侵袭成分,低估率达0~59%[1]。单纯导管原位癌和导管原位癌具有侵袭性的治疗方法截然不同,主要治疗不同点在于是否对腋窝淋巴结进行清扫[2]。DCIS侵袭性高危患者必须评估前哨淋巴结情况。因此术前准确评估两者对制定手术治疗方案是非常重要的。一些研究显示应用增强对比磁共振区别DCIS分级,但结果均不一致[3]。另外一些研究显示,DWI中ADC值对于鉴别乳腺良恶性肿瘤具有明显意义[4]。少部分研究DCIS分级与ADC值具有相关性[5]。然而并没有研究关于测量ADC值能否检测到导管原位癌中的侵袭性癌成分。DCIS侵袭性成分病理具有显著异质性,是因为它包括侵袭性癌巢、间质、肿瘤内纤维化和坏死、以及导管成分。本研究的目的是应用最小ADC值和不同ADC值对DCIS侵袭成分进行术前预测评估。
1 材料与方法
1.1 研究对象
回顾性分析2014年6月至2016年10月经病理证实的80例女性DCIS患者,所有患者术前均进行MRI检查。年龄34~82岁,平均年龄54岁。2例患者为双侧乳腺导管原位癌。排除标准:① 进行新辅助化疗(1例);② 无进行动态对比增强扫描或DWI图未见异常信号(4例);③ 脂肪抑制图像不均匀,影像图像质量不佳(2例);④ 3例因病变太小或层面太薄不能有效设置感兴趣区,不能够进行ADC值测量(1例);⑤ 活检后大量持续血肿。最终,69例患者70个病灶进行本次试验。所有患者同意进行本次研究,并签订同意书。通过本单位道德伦理会进行本次研究。
所有69例患者第一次经历乳房X线摄影和超声诊断,均未发现侵袭性癌肿。后超声发现44个病灶,其中42个病变进行14 G空心针乳腺活检,2个病灶进行10 G真空针乳腺活检。26个病变超声检查无任何异常,在乳房X线摄影仅显示微小钙化灶,采用11 G真空针进行乳腺活检。
1.2 MR图像采集
应用3.0 T超导型磁共振扫描仪(Philips公司,Ingenia型号),所有患者采用俯卧位,将两乳腺自然垂直放置8通道乳腺线圈中,先进性平扫后行动态增强扫描。MR图像扫描参数如下:T2压脂像横断位(TR/TE:4529/70 ms,视野320 mm×320 mm,矩阵608×467,层厚5 mm, 采集时199 s),压脂像—弥散加权成像(8000/96 ms),视野340×340 mm,矩阵128×101,层厚5 mm,采集时间132 s,b值0和1000 s/mm2,应用3维压脂T1加权梯度回波序列(5.3/2.6,视野350 mm×350 mm,矩阵480×277,层厚0.9 mm,采集时间68 s),经脉注射0.1mmol/kg钆喷酸。ADC值计数公式为ADC=(1/b)×In(S0/S),S0和S表示感性兴趣区信号强度,弥散梯度因子(b=0和1000 s/mm2)。
1.3 图像后处理
由两名放射专家在双盲情况下进行阅片。在动脉增强扫描图像上测量肿瘤最大直径和评估病变范围,进行多个感性兴趣区测量,将感性兴趣区(ROI)仔细放置病变处,ROI大小为13~45 mm2,见图1。在所有ADC图上。感性兴趣区的大小尽可能覆盖病变大小。对比增强T1加权成像和压脂T2加权成像显示肿瘤囊变/坏死或出血等情况。ROI放置位置由两名专家共同达成一致,见图1。记录每个病变放置感性兴趣区的大小和数量。然后从多个ROI测量值中选出最小ADC值,选出最大ADC值。同时计算最大ADC值和最小ADC值间的差值,即差值ADC,后比较DCIS和DCIS侵袭成分的最小ADC值和差值ADC。ADC值标准差<0.2×10-3mm2/s。
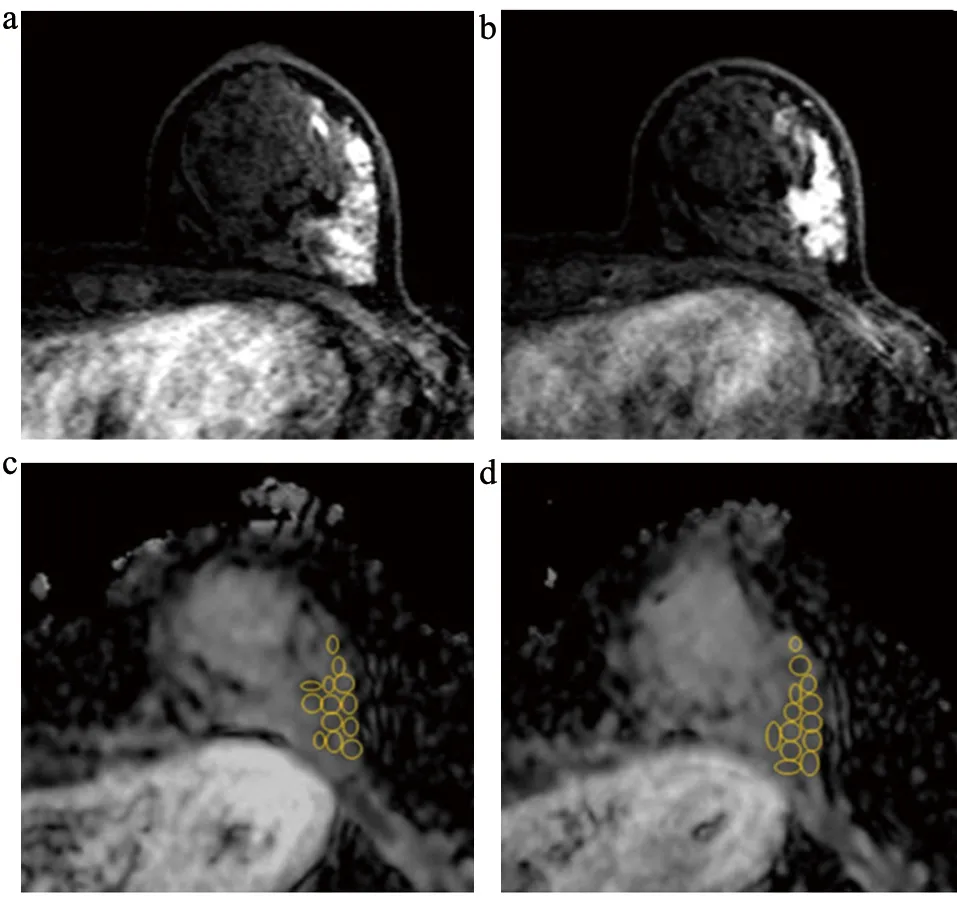
图1 设置感性兴趣区方法
1.4 病理评估
所有患者进行乳腺切除术和病变切除术后,外科样本病理取材。样本应用甲醛溶液进行固定和在切成5 μm切片。通过经验的病理医师评估核级、肿瘤坏死和原发性导管癌的级别。记录侵袭性癌的大小、数量和部位。
1.5 统计学分析
应用SPSS 18.0统计软件进行数据录入和统计分析,计量资料以均数±标准差(x-±s)表示,采用t检验或Mann-Whitney U检验比较最小ADC值和差值ADC。Pearson相关性评估最小ADC值和差值ADC的相关性。ROC曲线分析评估最小ADC值和差值ADC敏感性和特异性。P<0.05具有统计学差异。
2 结果
11个癌肿患者进行乳腺切除术,59个癌肿患者进行病灶切除术。病理显示51个病变为单纯DCIS,19个病灶为DCIS侵袭性成分(具有一个或多个侵袭性癌巢)。51个单纯DCIS,24个为低级别,19个为中等级别,8个高级别。19个DCIS侵袭性成分中,2个具有巨大侵袭性癌巢,直径≥10 mm,17个病变具有小侵袭性癌巢,直径<10 mm。在侵袭性癌巢周围可见大量导管和胶原纤维成分(图2)。
DCIS侵袭性成分和DCIS最大直径[(33.7±17.5) mm vs. (28.5±16.8) mm]无明显差异(P=0.29)。DCIS侵袭性成分和平均ROI[(26.1±5.4) mm2vs. (28.5±16.8) mm]大小无统计学差异(P=0.33)。DCIS侵袭性成分最小ADC值明显低于DCIS[(0.99±0.04)×10-3mm2/s vs. (1.15±0.03)×10-3mm2/s],P=0.0037,见图3。DCIS侵袭性成分差值ADC值明显高于DCIS [(0.38±0.05)×10-3mm2/s vs.(0.17±0.03)×10-3mm2/s],P=0.0007,见图4。最小ADC值与差值ADC值具有明显负相关性(r=0.65),见图5。
ROC分析显示最小ADC值最有效阈值低于1.1×10-3mm2/s,有助于鉴别DCIS侵袭性成分和DCIS,敏感性和特异性分别为72%和77%。ADC差值最有效阈值高于0.23×10-3mm2/s,同样,有助于鉴别DCIS侵袭性成分和DCIS,敏感性和特异性分别为68%和76%。最小ADC值曲线下面积为0.71,差值ADC曲线下面积为0.77,见图6。
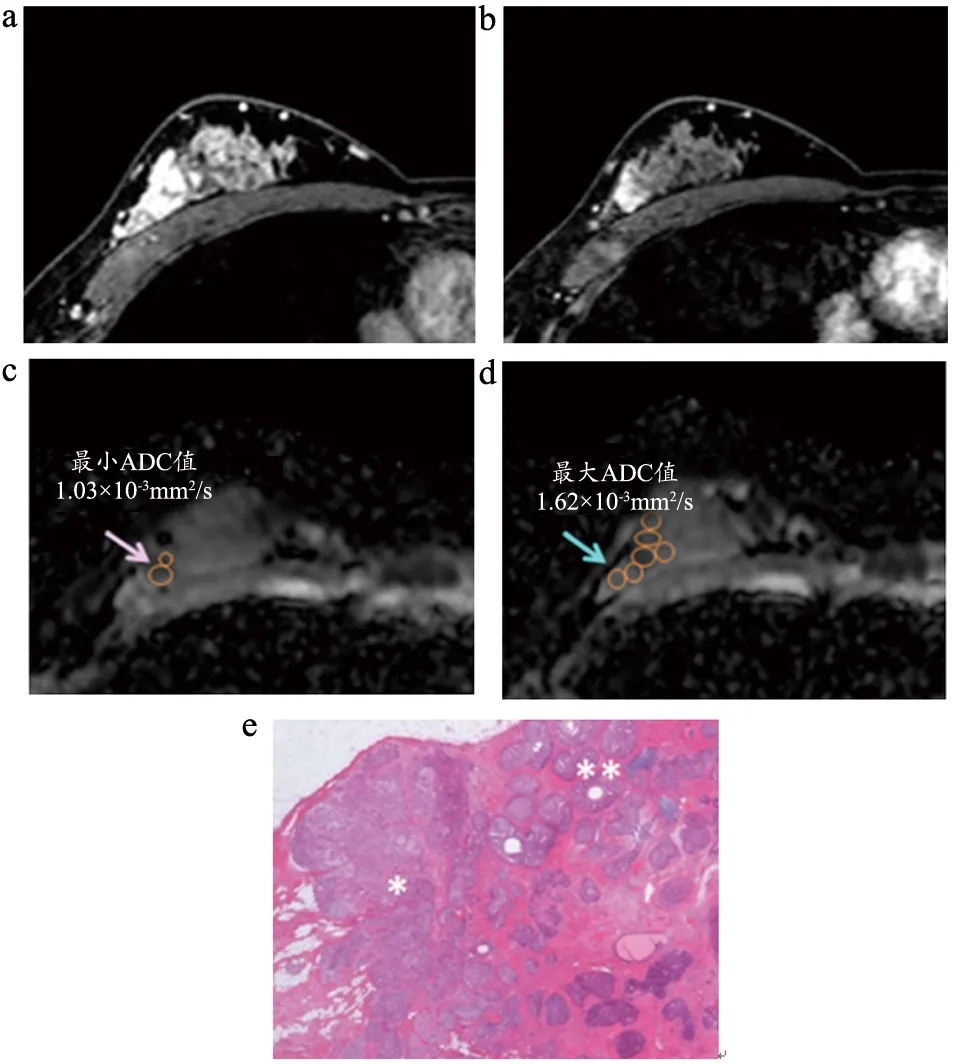
图2 同一病例乳腺导管原位癌侵袭成分设置
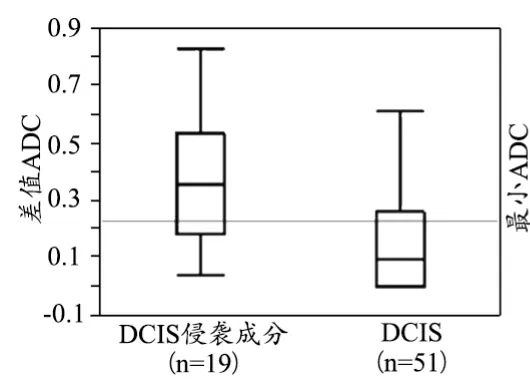
图3 差值ADC值箱图显示
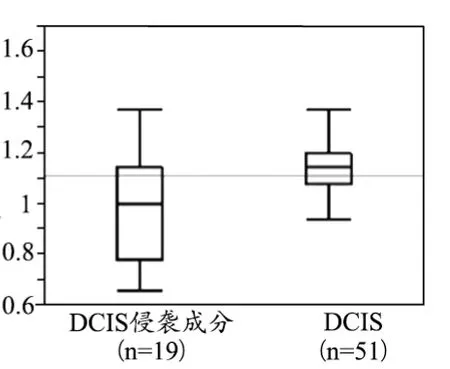
图4 最小ADC值箱图显示
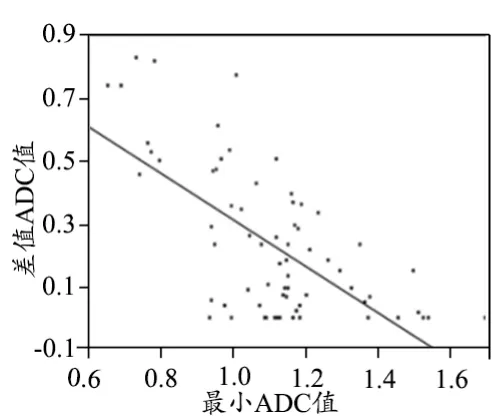
图5 差值ADC值与最小ADC值相关性
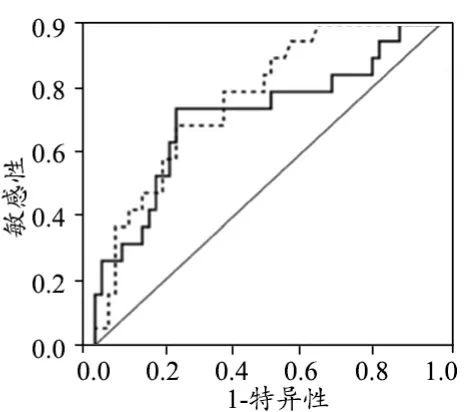
图6 差值ADC值与最小ADC值ROC曲线
19个DCIS侵袭性成分中,14个病变为最小ADC值<1.1×10-3mm2/s,病理显示侵袭成分范围为直径为2~18 mm,平均为4 mm;5个病变最小ADC值≥1.1×10-3mm2/s,病理显示侵袭成分范围为直径为1.5~6 mm,平均4 mm;13个病变ADC差值>0.23×10-3mm2/s,病理显示侵袭成分直径为1.5~18 mm,平均3 mm;6个病变最小ADC差值≤0.23×10-3mm2/s,病理显示侵袭成分直径为1.5~8 mm ,平均3 mm。两个最大≥10 mm侵袭性成分,最小ADC值<1.1×10-3mm2/s和ADC差值>0.23×10-3mm2/s。
3 讨论
乳腺导管原位癌为乳腺导管恶性上皮原位增生性肿瘤,未突破基底膜,无侵犯间质,是乳腺癌早期病变,约33%为多中心性,10%侵犯双侧乳腺[6]。据资料统计[7],DCIS占所有乳腺癌类型的0.8%~5%,其发病率呈逐年上升及年轻化趋势,在1981~2001年间女性发病率为(2.4~27.7)/10万[8-12],大约5%有临床症状。DCIS患者中,部分DCIS组织学具有侵袭性成分。若导管原位癌具有侵袭性成分,在治疗上需要清扫腋窝淋巴结。因此术前准确诊断DCIS侵袭性成分对患者预后和长期生存质量就会明显延长。
本次研究结果显示DCIS经测量,最小ADC值<1.1×10-3mm2/s和差值 ADC>0.23×10-3mm2/s存在侵袭癌。本研究也通过ROC分析,通过测量ADC值能够发现DCIS侵袭性成分。大多研究显示肿瘤DWI表现和ADC值与肿瘤细胞密度和缺少细胞外间隙有关[12-16]。本研究没有进行放射学和病理学的相关性研究,也没有在图像上和标本上进行点对点的研究,因患者位置不同导致肿瘤形态结构不同,因此不能够准确进行点对点的研究。然而,本研究认为最小ADC值对应的是病灶的最高细胞密度,反映了侵袭性癌巢的位置。差值ADC对应的是不同密度组织细胞,反映各种病理成分,如侵袭性癌巢,导管内成分,间质和纤维化。
本研究显示导管原位癌中侵袭性成分中,对于癌巢 <10 mm,病灶的最小ADC值<1.1×10-3mm2/s。对于病变信号不均匀的成分,ADC差值>0.23×10-3mm2/s,可能反应细胞密度微小差别。3.0磁共振成像系统具有高信噪比和空间分别率,能够探查到更多较小的病变。然而,病理学分析指示侵袭性癌巢即使直径<5 mm,也常伴随着密集导管和胶原纤维。因此,本研究认为最小ADC值<1.1×10-3mm2/s测量侵袭成分区域大小要比实际癌巢本身大得多,这样更有利于探查到病变。虽然差值ADC能够相同探测到DCIS侵袭成分结果,但是因需要测量大量ROI,因此不能够在实际中应用。相反,目测评估ADC图的不均匀性能够代替实际测量,表明测量最小ADC值能够准确发现肿瘤侵袭性癌巢。
本次研究的研究的局限性:① 因T2压脂像层厚较厚,难以避免出血和囊性成分对诊断结果准确性的影;② 本研究把感性兴趣放置在所有ADC图横断面,以观察病变情况,但感性兴趣区大小设置受病变形态和大小限制,所以进行多次测量,后取平均值;③ 本研究样本量较少,需要大样本量进一步研究。
总之,最小ADC值和差值ADC有助于发现侵袭成分,确定侵袭成分有助于术前决定是否清扫前哨淋巴结和腋窝淋巴结。本研究认为测量最小ADC值和ADC差值能够成为诊断DCIS侵袭成分的MRI常规检查。
[参考文献]
[1] De Santis C,Ma J,Bryan L,et al.Breast cancer statistics, 2013[J].CA Cancer J Clin,2014,64(1):52-62.
[2] Orzalesi L,Casella D,Criscenti V,et al.Microinvasive breast cancer: pathological parameters, cancer subtypes distribution, and correlation with axillary lymph nodes invasion. Results of a large single-institution series[J].Breast Cancer,2015,20(1):48-53.
[3] 连臻强,张嫣,王颀,等.乳腺X线和磁共振诊断导管原位癌及其微浸润的对比研究[J].中华普通外科杂志,2014,29(5):351-354.
[4] 吴洁莹.乳腺X线摄影X线联合MRI诊断乳腺导管原位癌的相关分析[J].临床医学,2015,35(2):34-35.
[5] 薛春升.乳腺导管原位癌及微浸润的MRI影像学表现[J].深圳中西医结合杂志,2015,25(16):75-76.
[6] 崔晓琳,周纯武,李静,等.MRI乳腺影像报告和数据系统在非肿块强化病变中的诊断价值研究[J].临床放射学杂志,2015,34(4):532-537.
[7] 连臻强,张嫣,王颀,等.乳腺X线和磁共振诊断导管原位癌及其微浸润的对比研究[J].中华普通外科杂志,2014,29(5):351-354.
[8] Gojon H,Fawunmi D,Valachis A.Sentinel lymph node biopsy in patients with microinvasive breast cancer: a systematic review and meta-analysis[J].Eur J Surg Oncol,2014,40(1):5-11.
[9] 王双玉,段青.3.0 T磁共振扩散加权成像在乳腺良恶性病变鉴别诊断中的价值[J].中国CT和MRI杂志,2009,7(4):18-21.
[10] Møller P,Stormorken A,Jonsrud C,et al.Survival of patients with BRCA1-associated breast cancer diagnosed in an MRI-based surveillance program[J].Breast Cancer Res Tr,2013,139(1):155-161.
[11] Rahbar H,De Martini WB,Lee AY,et al.Accuracy of 3 T versus 1.5 T breast MRI for pre-operative assessment of extent of disease in newly diagnosed DCIS[J].Eur J Radiol,2015,84(4):611-616.
[12] Houssami N,Turner R,Morrow M.Preoperative magnetic resonance imaging in breast cancer: Meta-analysis of surgical outcomes[J].Ann of Surg,2013,257(2):249-255.
[13] Pilewskie M,Kennedy C,Shappell C,et al.Effect of MRI on the management of ductal carcinoma in situ of the breast[J].Ann Surg Oncol,2013,20(5):1522-1529.
[14] Richard R,Thomassin I,Chapellier M,et al.Diffusionweighted MRI in pretreatment prediction of response to neoadjuvant chemotherapy in patients with breast cancer[J].Eur J Radiol,2013,23(9):2420-2431.
[15] Hassanien AE,Moftall HM,Azar AT,et al.MRI breast cancer diagnosis hybrid approach using adaptive ant-based segmentation and multilayer perceptron neural networks classifier[J].Appl Soft Comput,2014,14(6):62-71.
[16] Choi S,Chang Y,Park H,et al.Correlation of the apparent diffusion coefficiency values on diffusion-weighted imaging with prognostic factors for breast cancer[J].Brit J Radiol,2014,18(3):602-608.

