DCE-MRI定量参数在前列腺病变诊断中的价值及与Gleason评分的相关性
周红梅,徐向阳,李莹,刘祥,杨建,黄德珍
华中科技大学同济医学院附属梨园医院 放射科,湖北 武汉 430070
引言
前列腺癌是男性第二常见的恶性肿瘤,在男性癌症的病死率中居于第6位[1]。随着医学和计算机技术的发展,不断涌现新的检查方法并广泛应用于前列腺疾病的筛查和诊断。其中定量动态增强核磁共振扫描成像(Dynamic Contrast-Enhanced MRI,DCE-MRI)是一种无创性的评估正常组织或病变组织间质与血管间进行物质交换的一种成像方法。其基本原理是肿瘤导致血管和肿瘤新生血管的密度、分布和通透性等解剖、病理和生理学改变;这样通过静脉团注法注射对比剂后即可示踪观察对比剂在血管及软组织间隙内浓度变化,从而比较肿瘤和非肿瘤组织的血管分布、血管通透性及血管的灌注情况[2]。过去,有诸多关于DCE-MRI定量分析参数对比:如从血管内到血管外转移速率即容量转移常数(Volume transfer Constant,Ktrans),血管外细胞外的间隙的容量分数(Fraction Volume of the Extravascular Extracellular Space,Ve)、对比剂从血管外细胞外间隙(Extravascular Extracellular Space,EES)重新回到血管内的速率常数分数(Fractional Transfer Rate,Kep)的研究,但是关于Ktrans、Kep、造影剂浓度在血浆容积(Volume Blood Plasma,Vp)和Ve值的平均值、标准差、百分位数在诊断前列腺癌和非癌组织的价值研究及其在前列腺分级诊断中应用甚少[3-4]。为此,本文目的是探讨DCE-MRI定量参数在前列腺癌和前列腺增生鉴别诊断中的价值,以及评估定量参数与前列腺癌病理Gleason评分的关系。
1 材料与方法
1.1 材料
研究对象:收集我院2014年1月至2015年10月期间行前列腺核磁共振检查,同时经病理活检确认的前列腺增生患者95例,平均年龄(67.21±8.62)岁;前列腺癌患者61例,平均年龄(70.27±7.88)岁,两组的平均年龄无统计学差异。DCE-MRI检查前所有患者均签署患者知情同意书,MRI检查后均行病理活检。患者如出现以下情况,则不纳入本研究:① 未在本院行前列腺的穿刺或根治术的病理检查;② 既往有内分泌治疗或放化疗治疗病史;③ 图像质量不清晰或信噪比差,或有明显运动伪影。
1.2 方法
1.2.1 MR成像
所有的MR成像检查在Simens 3.0 T(Magnetom Verio Tim,Germany)扫描仪上完成,使用8通道体部联合线圈。MRI扫描参数包括冠状位T2WI-FS序列,横轴位T1WI、T2WI和T2-FS,横轴位体素不相干运动(Introvoxel Incoherent Motion,IVIM)(b=0、700、1400、2100 s/mm2)、弥散峰度成像(Diffuse Kurtosis Imaging,DKI)(b=0、50、150 s/mm2)DWI(b=1400 s/mm2) 和 DCE-MRI、DCE-MRI-减影成像。DCE-MRI使用一个3D T1-VIBLE序列,TR/TE/角度=3.6 ms/1.13 ms/15°,视野=260 mm×260 mm。DCEMRI扫描前使用3个一次性序列进行预扫描,角度分别为5°、10°、15°,用于测定T1信号强度。前列腺全腺体覆盖小视野扫描,在满足SNR=1.0的情况下,采用最小时间分辨率,横轴位图像采集大约8.4 s间隔。使用高压注射泵通过肘静脉注射钆喷酸葡胺注射液(0.1 mmol/kg;速率2.5 mL/s),接着注射相同容积的生理盐水冲洗。扫描参数包括4次基础性的扫描,目的是为了在增强剂注射之前评估组织和血管的初始信号强度。而后在第5个序列剩余7~6 s时开始注射造影剂。观察患者的状态,严防造影剂渗漏、患者有造影剂过敏反应等不适症状。具体参数,见表1。
1.2.2 MR数据和组织病理学的相关性
前列腺癌组织病理切片上限制在可以明确的定义为肿瘤的组织,有明显的细胞异型性,测量病灶组织与上下左右的关系,尿道,精囊、钙化灶等可以作为组织学标记,根据上述值确定病灶在前列腺中的位置。比较MRI扫描的图像,测量前列腺大小,根据病理切片上病灶的上下左右的关系从而确定病灶在MRI图像上的位置。结合MRI扫描的所有参数,作为确认病灶组织的定位。有两位分别有20年和10年工作经验的放射科医生与两位分别为2年和4年工作经验的住院医师共同分析图像,在前列腺的定位中达成一致,最终结果以高年资医师的诊断为主。然后在DCE-MRI图像上勾画出感兴趣肿瘤区病变组织的轮廓。在非肿瘤区寻找并勾画出感兴趣非肿瘤区。
1.2.3 勾画肿瘤病灶与非肿瘤病灶的条件
结合患者的T2WI、表观弥散系数图(Apparent Diffusion Coefficient,ADC)、DKI图,勾画肿瘤病灶与非肿瘤病灶。两位5年以上影像诊断工作经验医师一起勾画感兴趣肿瘤病变区和非肿瘤病变区的边缘轮廓,两次勾画的面积大小基本相等,形状可以不同。同时避开钙化或出血区、精囊、尿道、前列腺周围的血管等影响结果的组织结构。

表1 MRI参数选择
1.2.4 动脉输入函数血管的选定
选择以左侧髂外动脉作为基准,在左侧髂外动脉内勾画患者的动脉输入函数感兴趣区轮廓,勾画感兴趣区轮廓的条件是:选择的种子动脉层面邻近上下层没有明显动脉主干分支,动脉壁没有明显增厚即没有动脉粥样软斑块或硬斑块形成,管腔没有明显局限性狭窄,选择的动脉层面尽量与横轴位层面垂直,每次选择的感兴趣区包含在动脉管腔内并应尽量与动脉中心重叠,绝对不能超出动脉管壁外,像素面积大小约47~49 mm2。
1.2.5 获取前列腺肿瘤组织的病理结果
前列腺患者一般在MRI扫描后4~7 d进行直肠超声导引下的定位穿刺,或8~15 d后进行前列腺癌的根治术。对于经直肠超声定位下进行组织活检的患者,标记超声下前列腺的定位部位和进针长度,记录与前列腺边缘的关系,而后将组织浸入福尔马林溶液,进行组织切片检查。对于进行前列腺癌根治术的患者,在室温中固定在福尔马林溶液中,在病理科进行组织切片,与此同时标记病变的位置和大小。在所有的病例中,每个病理切片使用数字注解、固定和石蜡包埋,固定载玻片和用苏木精和伊红染色,并进行免疫组化分析。
1.3 数据统计分析
采用SPSS 21.0软件进行统计分析。前列腺增生与前列腺癌患者的DCE-MRI定量参数比较,符合正态分布时采用独立样本t检验,不符合正态分布时采用Mann-Whitney检验。对于有显著性差别的参数(P<0.05),用受试者工作曲线(ROC曲线)分别评价这些参数在前列腺增生和前列腺癌鉴别诊断中的价值。对于鉴别诊断效能较高的参数,再用ROC曲线分析该参数不同阈值鉴别前列腺增生和前列腺癌的敏感度和特异性。对于前列腺癌患者,用线性相关评估DCE-MRI定量参数与病理Gleason评分的关系,当确定系数(r2)>0.81(即|r|>0.9,r为相关系数)时,说明该参数与Gleason评分线性相关程度较高,用线性回归确定其线性回归方程式。本研究中,ROC曲线作图在SPSS 21.0软件上完成,其它作图均在GraphPad Prism 5软件上完成。
2 结果
2.1 患者基本资料
本文156例前列腺病变患者中,前列腺增生患者95例,平均年龄(67.21±8.62)岁;前列腺癌患者61例,平均年龄(70.27±7.88)岁,两组的平均年龄无统计学差异,影像结果,见图1~2。
图1 前列腺癌患者(a)与前列腺增生患者(b)DCE-MRI结果
图2 前列腺癌患者DCE-MRI结果
2.2 前列腺增生与前列腺癌的Ktrans值比较
前列腺癌患者T2WI显示左侧周围带信号减低良性前列腺增生患者,与前列腺增生患者相比,前列腺癌患者Ktrans值的平均值、标准差、50%位数、75%位数、90%位数明显较高(P值分别为 0.0002、<0.0001、0.0022、0.0001、<0.0001),见表 2。
2.3 前列腺增生与前列腺癌的Kep值比较
与前列腺增生患者相比,前列腺癌患者Kep值的10%位数明显较低(P=0.0402),其它参数无明显差别(表3)。
2.4 前列腺增生与前列腺癌的Ve值比较
与前列腺增生患者相比,前列腺癌患者MRI的Ve值的平均值、标准差、50%位数、75%位数、90%位数明显较高(P值分别为0.0032、0.0070、0.0031、0.0019、0.0012),见表4。
2.5 前列腺增生与前列腺癌的Vp值比较
与前列腺增生患者相比,前列腺癌患者MRI-Vp值的平均值、标准差、50%位数、75%位数、90%位数明显较高(P值分别为0.0041、0.0015、0.0027、0.0026、0.0020),见表5。
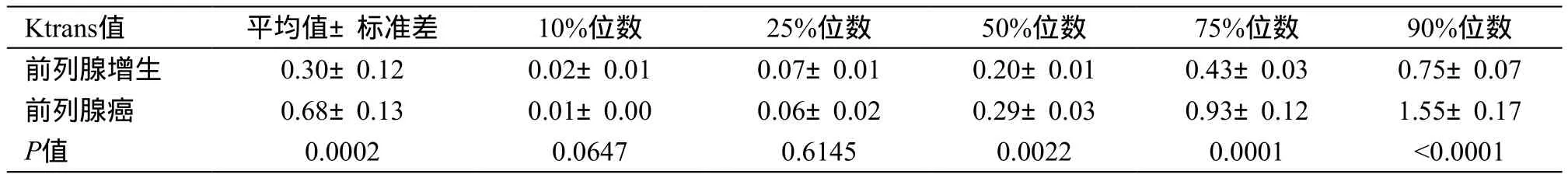
表2 前列腺增生与前列腺癌患者Ktrans值对比

表3 前列腺增生与前列腺癌患者Kep值对比
2.6 前列腺增生与前列腺癌DCE-MRI中显著性差异参数的ROC曲线
前列腺增生与前列腺癌患者的Ktrans值、Kep值、Ve值、Vp值对比中,共11个参数有显著性差异(P<0.05)。分析发现,仅Kep值10%位数的曲线下面积大于0.5(AUC=0.782,P=0.016),说明Kep值10%位数在前列腺增生与前列腺癌的鉴别诊断中有一定价值。不同临界值所对应的诊断敏感度和特异性,见图3。前列腺增生与前列腺癌的鉴别诊断中,如果以Kep值10%位数<0.0101诊断为前列腺癌,诊断敏感度为66.7%,特异性为72.7%。
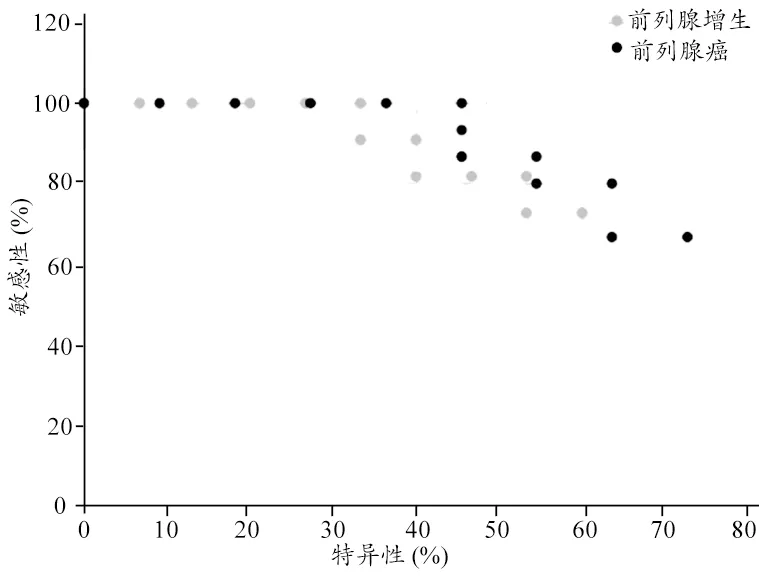
图3 Kep值10%位数不同水平在前列腺增生和前列腺癌鉴别诊断中的敏感度和特异性分布
2.7 前列腺增生与前列腺癌受累的不同部位的Kep值10%位数比较
前列腺增生与前列腺癌受累的不同部位(左侧外周带、左侧中央带、右侧外周带、右侧中央带)的Kep值10%位数比较,见表6。两者各部位未见明显差别(P值均>0.05)。
2.8 前列腺癌DCE-MRI定量参数与病理Gleason评分的相关性分析
61例前列腺癌患者均行病理检查,Gleason评分均为6、7或8分,分别对Gleason评分与Ktrans值、Kep值、Ve值、Vp值的各参数(平均值、标准差、10%位数、25%位数、50%位数、75%位数、90%位数)进行线性相关分析,其确定系数(r2,r为相关系数),见表7。结果发现,以上指标与Gleason评分的线性相关程度较高(r2>0.81,即|r|>0.9)。根据与Gleason评分线性相关程度最高的Ve值50%位数,求得线性方程:前列腺癌患者病理Gleason评分=2.590×(Ve值50%位数)+5.405。
3 讨论
前列腺增生和前列腺癌是是中老年男性中较常见的疾病,随年龄增加,发病率不断增高。目前,前列腺癌已成为老年男性常见恶性肿瘤及死亡原因之一。MRI作为一种全面、直观、准确的影像学检查方法,在前列腺疾病的筛查、诊断及前列腺肿瘤和非肿瘤性病变的鉴别诊断中发挥着重要作用[5-6]。DCE-MRI不仅能提供病变部位的形态学特征,还能提供病变部位血流动力学情况[7],对前列腺癌的诊断达到了一个新的高度[8]。其次,探究DCE-MRI定量参数与肿瘤组织病理Gleason评分的相关性,有助于无创性提示肿瘤的恶性程度,为临床医师对前列腺癌的病理分期、治疗方案、手术计划及疗效检测提供帮助[9]。
本研究回顾性分析156例前列腺增生和前列腺癌患者的DCE-MRI定量参数Ktrans、Kep、Vp和Ve值及其平均值、标准差、百分位数,统计学对比后发现前列腺癌患者Ktrans值、Ve值、Vp值的平均值、标准差、50%位数、75%位数、90%位数明显较高,而前列腺癌患者Kep值的10%位数明显较低。既往研究多为Ktrans、Kep、Vp和Ve值的整体水平比较,较少比较其平均值、标准差、百分位数[10-11],本研究比较后的结果也说明,前列腺癌患者与前列腺增生患者各参数值有显著差异,可能与肿瘤本身的生理学差异有关。Chung等[12]回顾性分析经病理检查确诊为前列腺癌的58例患者的MRI结果,发现DCE-MRI定量参数中,Ktrans值与患者前列腺癌特异抗原含量明显相关。对于前列腺中央区肿瘤,Ktrans值与肿瘤最大直径以及PSA明显相关,但外周区前列腺癌无明显相关。该研究说明DCE-MRI定量参数与前列腺癌的发展有密切相关,且不同的病变部位,DCE-MRI值与疾病相关性也不同。本研究中,前列腺增生与前列腺癌患者总体Kep值10%位数有显著性差异(P值均<0.05),但是分别在左侧外周带、左侧中央带、右侧外周带、右侧中央带,两者却无明显差异,这也从侧面说明了DCE-MRI可能在不同病变区域间存在差异。Vargas等[13]对50例行拟行前列腺切除术的前列腺癌患者的DCE-MRI结果回顾性分析后,发现定量参数Ktrans值和Ve值与患者自我评价的性功能明显相关(P=0.0020~0.0252),Kep值则与之没有明显关系(P=0.7665)。说明Ktans值和Ve值可能与部分生理功能相关,总体的Kep值则可能没有显著性关系,与本研究报道相似。Rosenkrantz等[14]回顾性分析了106例前列腺移行带恶性肿瘤患者的核磁共振成像结果,发现3位独立的影像科医师应用T2加权成像(T2WI)联合扩散加权成像(DWI)(b=1000 s/mm)和表观弥散系数的诊断敏感性明显高于单独应用T2加权成像。当T2WI提高b至2000 s/mm,两位医师的诊断敏感性增加(74.2%,62.9%,P≤0.011),另一位医师联合DCE-MRI进一步提高了诊断敏感性(61.3%,P=0.013)。以上诊断特异性均达到90%以上。但是,单独应用DCE-MRI不能提高诊断的敏感性(P≥0.054)。相似的是,本研究中,前列腺癌患者DCE-MRI多个参数均明显高于前列腺增生患者,但是诊断效能均较低,唯独Kep值10%位数存在一定诊断价值(AUC=0.782,P=0.016),若以Kep值的10%位数<0.0101诊断为前列腺癌,诊断敏感性为66.7%,特异性为72.7%。诊断敏感性与特异性均显著低于Rosenkrantz等[14]报道的其它MRI参数。在Fennessy等[15]前瞻性研究中,对30例拟行根治性前列腺切除术的前列腺癌患者行前列腺MRI检查,比较不同动脉输入函数在DCE-MRI中鉴别外周带前列腺癌区和非增生性区的作用,发现自动的和模式化的AIF效果都很好,如果DCE-MRI定量参数要用作前列腺癌的生物标记时,这个检查中AIF应该保持一致。这也说明DCE-MRI定量参数影响因素较多,Kep值10%位数诊断效能不是很高,可能与之有关,但是联合其他指标,进行多参数分析,可以明显提高诊断的敏感性和特异性。在meta分析中[16],也证实了多参数联合有助于提高MRI对前列腺癌的诊断敏感性和特异性。
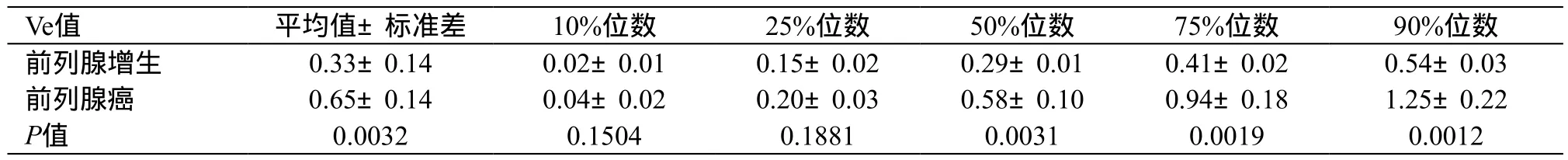
表4 前列腺增生与前列腺癌患者Ve值对比

表5 增生患者与肿瘤患者的MRI-Vp值对比

表6 前列腺增生与前列腺癌受累的不同部位的Kep值10%位数比较 [x-±s,(n)]
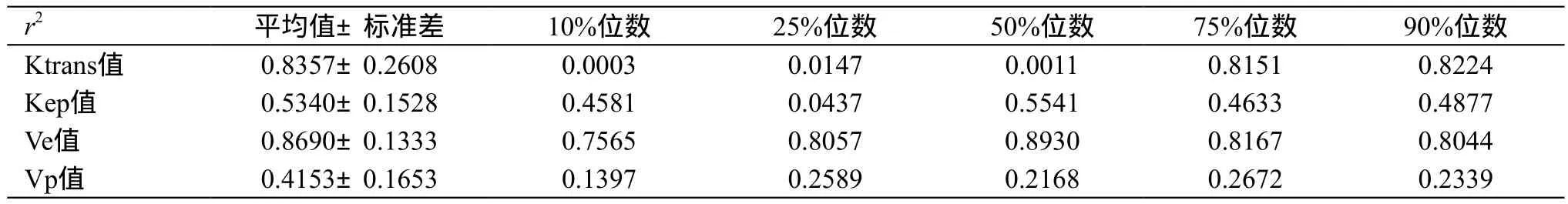
表7 Ktrans值、Kep值、Ve值、Vp值的各参数分别与Gleason评分线性相关分析的确定系数
本研究中,线性相关分析发现,前列腺癌患者DCEMRI定量参数中,Ktrans值平均值、Ktrans值75%位数、Ktrans值90%位数、Ve值平均值、Ve值标准差、Ve值50%位数、Ve值75%位数均与Gleason评分(本研究中,前列腺癌患者评分均为6、7或8分)的线性相关程度较高(确定系数分别为0.8357、0.8151、0.8224、0.8690、0.8333、0.8930、0.8167)。根据线性相关程度最高的Ve值50%位数,求得前列腺癌患者病理Gleason评分=2.590×(Ve值50%位数)+5.405。Oto等[17]分析了73例前列腺癌术前的DWI和DCE-MRI后发现,前列腺癌患者肿瘤平均直径15.2 mm(5~28 mm)。73例患者中,5例(6.8%)病理Gleason评分为6分,46例(63%)评分为7分,22例(30.1%)评分在7分及7分以上。表观弥散系数与Gleason评分间存在中度负相关(r=-0.376,P=0.001),但与肿瘤血管生成参数不相关。DCE-MRI定量参数与Gleason评分以及血管内皮细胞生长因子的表达无明显关系(P>0.05)。与之不同的是,本研究中发现DCE-MRI 定量参数与Gleason评分相关。此外,Oto等[17]研究中还发现前列腺癌的平均血管计数以及平均血管体积分数参数与Kep值成正相关(r=0.440,P=0.001;r=0.453,P=0.001),说明前列腺癌中Kep值可能与肿瘤微血管密度相关。而在本研究中,前列腺癌与前列腺增生患者的Kep值整体水平没有显著性差异,且前列腺癌患者的Kep值10%位数明显小于前列腺增生患者。研究之间存在较大差异,尚需大规模的前瞻性研究来验证DCE-MRI定量参数在前列腺癌Gleason评分的作用。
综上所述,本文研究发现,DCE-MRI无创性定量反映前列腺组织微血管分布和灌注信息;其中多项定量参数能用于鉴别前列腺增生和前列腺癌组织,Kep值10%位数特异性和敏感性较高;且多项参数与Gleason评分线性相关,能反映病变分级信息。
[参考文献]
[1] 林奈尔,柴伟明,华佳.定量动态增强MRI在乳腺癌中的研究进展[J].国际医学放射杂志,2013,36(4):336-339.
[2] 中华放射学杂志编辑委员会,中华放射学杂志前列腺疾病诊疗工作组.前列腺癌MR检查和诊断共识[J].中华放射学杂志,2014,48(7):531-534.
[3] 叶锦棠,蔡文超,王岳,等.体素内不相干运动扩散加权成像对前列腺癌的诊断价值[J].放射学实践, 2014,29(5):474-476.
[4] 曹曙,曹惠霞,胡卫列.体素内无规则运动核磁共振成像技术在前列腺癌诊断中的价值[J].中国男科学杂志,2014,28(1):25-28.[5] 夏国金,龚洪翰,曾献军,等.MR扩散张量成像在前列腺癌诊断中的价值[J].中华放射学杂志,2012,46(6):526-528.
[6] Mocikova I,Babela J,Balaz V.Prostate cancer-the role of magnetic resonance imaging[J].Biomed Pap Med Fac Univ Palachy Olomouc Czech Repub,2012,156(2):103-107.
[7] Kuhl CK,Schild HH.Dynamic image interpretation of the breast[J].JMRI,2000,11:965-974.
[8] Dynamic contrast-enhanced MRI for the detection of prostate cancer: meta-analysis[J].AJR Am J Roentgenol,2015,20(4):439-448.
[9] Barrett T,Davidson SR,Wilson BC,et al.Dynamic contrast enhanced MRI as a predictor of vascular-targeted photodynamic focal ablation therapy outcome in prostate cancer post-failed external beam radiation therapy[J].Can Urol Assoc J,2014,8(9-10):708-714.
[10] 王世健,范明,张娟,等.乳腺癌DCE-MRI影像特征与分子分型的关联性研究[J].中国生物医学工程学报,2016,35(5):533-540.
[11] 刘伟,嵇鸣,李若坤,等.MRI鉴别诊断慢性乳腺炎与乳腺癌的价值[J].实用放射学杂志,2016,(2):212-215.
[12] Chung MP,Margolis D,Mesko S,et al.Correlation of quantitative diffusion-weighted and dynamic contrast-enhanced MRI parameters with prognostic factors in prostate cancer[J].J Med Imaging Radiat Oncol,2014,58(5):588-594.
[13] Vargas HA,Donati OF,Wibmer A,et al.Association between penile dynamic contrast-enhanced MRI-derived quantitative parameters and self-reported sexual function in patients with newly diagnosed prostate cancer[J].J Sex Med,2014,10(10):2581-2588.
[14] Rosenkrantz AB,Kim S,Campbell N,et al.Transition zone prostate cancer: revisiting the role of multiparametric MRI at 3 T[J].AJR Am J Roentgenol,2015,204(3):266-772.
[15] Fennessy FM,Fedorov A,Penzkofer T,et al.Quantitative pharmacokinetic analysis of prostate cancer DCE-MRI at 3T:Comparison of two arterial input functions on cancer detection with digized whole mount histopathological validation[J].Magn Reson Imaging,2015,15(7):47-48.
[16] De Rooij M,Hamoen EH,Futterer JJ,et al.Accuracy of multi parametric MRI for prostate cancer detection: a metaanalysis[J].AJR Am J Roentgenol,2014,202(2):343-351.
[17] Oto A,Yang C,Kayhan A,et al.Diffusion-weighted and dynamic contrast-enhanced MRI of prostate cancer: correlation of quantitative MR parameters with Gleason score and tumor angiogenesis[J].AJR Am J Roentgenol,2011,197(6):1382-1390.

