149例老年患者肿瘤相关性贫血的临床分析
魏佳宁,王 凤,卢蕻迪,刘苗苗,崔鹏飞,李祥春,刘子玲
(吉林大学白求恩第一医院 肿瘤科,吉林 长春130021)
肿瘤相关性贫血(cancer related anemia,CRA)主要是指肿瘤患者在疾病的发展过程中及治疗过程中发生的贫血。近年随着人们生活水平的不断提高,人口老龄化的不断加剧,老年恶性肿瘤患者也在不断增多,老年恶性肿瘤患者所占比例较大[1],而贫血也随之成为老年恶性肿瘤患者常见的并发症之一,贫血不但对老年恶性肿瘤患者的生活质量有着非常大的影响,同时与老年恶性肿瘤疾病进展和复发密切相关,使肿瘤治疗决策难度、风险也大大的增加。针对不同肿瘤患者相关性贫血多有文献报告,但多忽略老年恶性肿瘤患者,因此老年恶性肿瘤患者化疗后的相关性贫血值得我们进一步研究。本文希望通过对老年恶性肿瘤患者贫血相关性的分析,了解老年恶性肿瘤患者贫血特点,进而提高对这些人群关注,必要时及早干预,提高治疗疗效及生活质量。老年患者肿瘤相关性贫血的发生与多种因素密切相关,其中包括肿瘤本身以及治疗相关因素,本文回顾性分析2017年1月-2017年12月于吉林大学第一医院肿瘤中心住院接受治疗的978例患者,收集根据NCCN指南老年(≥65岁)恶性肿瘤贫血患者的年龄、性别、贫血发生率、贫血程度、以及与肿瘤类型、临床分期、化疗药物的相关性等方面,分析整理如下。
1 资料与方法
1.1 一般资料
依据临床回顾性分析的病例纳入与排除标准,共收集2017年1月-2017年12月于吉林大学第一医院肿瘤中心149例老年住院患者(≥65岁),其中男性77例,女性72例,中位年龄70岁所有患者均经病理诊断为恶性实体肿瘤。肺癌67例,胃肠道肿瘤45例,乳腺癌17例,妇科肿瘤8例,泌尿系统肿瘤5例,其他肿瘤患者7例。
1.2 病例选入标准
1)年龄≥65岁,2)经病理诊断证实为恶性实体肿瘤,3)有明确的肿瘤分期4)均接受≥3疗程标准化疗;4)既往无其他恶性实体肿瘤、无血液系统疾病史; 5)签署病情告知书及化疗知情同意书。
1.3 贫血分级与分类
分别依据美国国立肿瘤研究所(National Cancer Institute,NCI)贫血分级标准[2]以及全国高等学校教材内科学第8版贫血的细胞学分类标准进行分类[3]。详细查阅(149)例老年恶性实体瘤患者的年龄、性别、肿瘤类型、TNM分期、血红蛋白、平均血红蛋白体积(mean corpuscular volume,MCV)、平均血红蛋白量(mean corpuscular hemoglobin,MCH)、平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)化疗周期、化疗药物应用情况等资料。
1.4 统计学分析
应用SPSS17.0统计软件进行数据处理。计数资料采用卡方检验。P<0.05为差异有显著性意义。
2 结果
2.1 一般资料
老年恶性实体肿瘤患者149例,出现贫血的老年患者65例(43.6%),其中男性77例,伴贫血40例52%,女性72例伴贫血25例(35%)。伴贫血的老年患者年龄范围65-80中位年龄70岁,其中65-69岁32例(49.2%),70-74岁22例(33.8%),75-79岁10例(15.4%),≥80岁1例(1.5%)。与同周期、同类型未出现贫血的老年肿瘤患者在性别结构比上无明显差异。位于65-69岁的老年患者相对较多,这可能与此年龄阶段患病人数有关。
2.2 贫血发生率
共149例老年恶性实体肿瘤患者,其中伴贫血65例,发生率为(43.6%)。胃肠道老年肿瘤患者伴贫血发生率最高47.7%,其次为肺癌47.05%,而乳腺、泌尿、妇科肿瘤患者肿瘤相关性贫血发生率相对较低,均远低于贫血总体发生率。(见表1)

表1 各癌种贫血的发生率
2.3 不同类型、分期恶性实体肿瘤患者伴发贫血情况及贫血严重程度
根据不同肿瘤分期标准对65例贫血患者进行疾病分期,结果提示不同分期患者贫血发生率明显不同:65例患者中,Ⅰ-Ⅱ期患者21例,占总贫血人数(32.3%),Ⅲ-Ⅳ期老年患者伴贫血占 (67.7%)。(见表2)
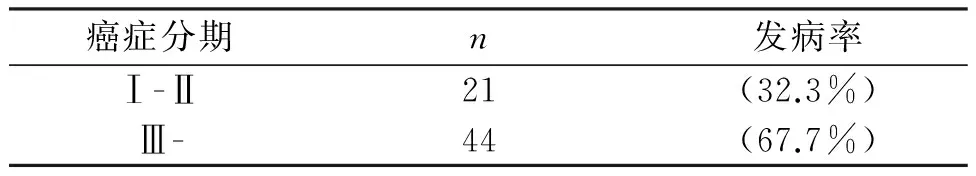
表2 不同分期患者贫血发生率
2.4 应用化疗药物后老年恶性肿瘤患者伴贫血的 细胞形态学分类
对65例贫血患者进行分类,其中正细胞贫血53例占总贫血患者的81.5%,小细胞贫血1例占总贫血1.5%,大细胞贫血11例占总贫血16.9%。由此可见,各种类型肿瘤伴贫血中以正细胞性贫血为主。进一步分析不同类型贫血与肿瘤类别间的关系可发现,大细胞性贫血在妇科肿瘤和胃肠道肿瘤患者中相对较高,分别为23.8%和33.3%,但均未达到50%。小细胞贫血则出现在胃肠道肿瘤患者中为4.7%,见表3。
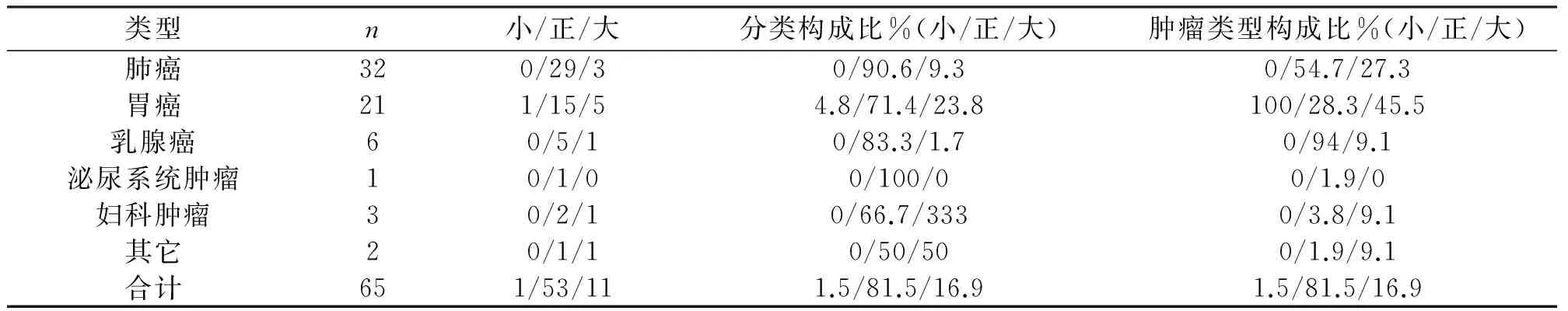
表3 各癌种患者贫血细胞形态学分类
2.5 应用不同化疗药物、不同化疗周期后老年恶性肿瘤患者伴贫血
非小细胞癌患者应用含铂药物后出现贫血患者为百分比66.7%,未应用含铂类药物出现贫血患者百分比25%,(P<0.05有统计学意义)(见表4)。应用1、2、3疗程化疗后出现贫血发生率分别为58.5%、67.7%、84.6%(见表5),可见随化疗疗程增加患者贫血发生率增高。

表4 不同化疗方案后患者贫血发生率
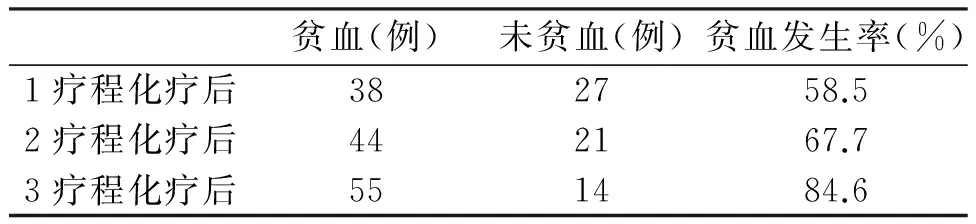
表5 不同化疗周期后患者贫血发生率
3 讨论
通过本研究,我们发现老年肿瘤患者接受化疗后贫血发生率为43.6%,高于相关研究结果[4],这可能本研究中研究对象年龄偏大有关。老年患者本身一般状态相对年轻患者差,机体对营养物质吸收减弱;其次年龄限制接受有限相关化疗后导致的骨髓抑制;加之老年患者肝、肾功能减退导致解毒能力、排泄功能下降[5],故易发生贫血。而本文的研究结果又低于欧洲癌症贫血调查组(The Euroupean Cancer Amerecan Survey,ECAS)揭示的经治疗后肿瘤患者贫血的发生率[6]。这可能与研究对象的年龄,所患肿瘤的类型,接受抗肿瘤方案不同有关。在所有老年恶性肿瘤伴发贫血患者中,胃肠道老年肿瘤患者伴贫血发生率高达47.7%,高于老年肿瘤患者化疗后贫血的总体发生率。这可能与以下因素相关:1)肿瘤的生长部位及由于肿瘤所产生的并发症等决定了患者并不能通过正常的进食来吸收营养,而通过其他途径输送的营养不能被良好的吸收,从而造成造血原料如铁等的缺失;2)肿瘤本身对营养物质的大量消耗,夺走了大量正常机体所需的营养;3)胃肠道肿瘤患者易并发出血等相关并发症,血的丢失也成为了贫血的发生的原因之一;4)经过多次化疗的患者常伴发恶心、呕吐、厌食等症状,进食量的减少与单一又进一步加重了贫血的发生。同时我们的数据显示男性胃癌患者伴贫血发病率相对较高,这可能与相关报道胃癌患者男性与女性比例为3/1有关,其他癌症未见明显差异。
研究显示Ⅲ-Ⅳ期肿瘤患者贫血发生率明显高于Ⅰ-Ⅱ患者,就贫血的分级而言, 1-2级贫血更为常见,这与相关研究结果一致[7]。轻中度贫血患者症状轻,且多容易被原发病症状所掩盖,为此在疾病的诊断以及治疗过程中更应引起我们的重视。
老年恶性实体肿瘤患者,经我们的研究显示以正细胞性贫血为主,这与相关研究[8],肿瘤相关性贫血的早期阶段通常为正常细胞性贫血相符,其红细胞也成呈正常大小。而胃肠道肿瘤患者中也出现了不同程度的小细胞、大细胞性贫血,这可能与造血原料铁、维生素B12等在胃肠道吸收障碍有关。
经过不同周期化疗的患者,恶性实体肿瘤老年患者分别经过1、2、3个化疗周期后贫血发生率为(58.5%)(67.7%)(84.6%),由此可见化疗毒性的累积加重了贫血的发生。这与化疗对骨髓的抑制、肾脏的损伤等有关,并与相关文献报道相符[9-11]。不同的化疗方案对老年肿瘤患者贫血发生的影响不同,研究显示铂类药物更易诱发贫血[12],铂类药物以水合阳离子的形式与细胞内DNA结合形成链间、链内或蛋白质DNA交联,从而破坏DNA的结构和功能。同时肾脏毒性、骨髓抑制也是铂类药物常见不良反应,这些是加重贫血发生的主要因素。
众所周知,导致贫血的原因有很多,肿瘤患者的可能原因亦有很多,包括缺铁性贫血[13],营养不良性贫血[14],肿瘤相关出血等。于条件所限,本研究未能对患者血清铁、铁蛋白、叶酸及维生素 B12 等指标进行详细检测及分析,因此未能对贫血原因做更进一步详细分析。
综上,贫血在恶性肿瘤患者中常有发生,而在老年恶性肿瘤患者中更为常见,我们通过分析研究老年恶性肿瘤患者贫血的特点及相关因素,从而更加清晰、透彻的认识到了老年恶性肿瘤患者贫血的相关状况,做到及早预防、及早期干预,提高老年恶性肿瘤患者的生活质量。
作者简介:魏佳宁(1989-),女,硕士研究生,研究方向:恶性肿瘤基础研究;刘子玲(1964-),女,博士生导师,硕士生导师,教授,主任医师,研究方向:主要从事恶性肿瘤基础研究。
参考文献:
[1]Yancik R,Ries LA.Cancer in older person:An internation issue in an aging word[J]. Semin Oncol,2004,31:128
[2]Del Mastro L,Gennari A,Donati S. Chemotherapy of non-small-cell lung cancer:role of erythropoietin in the management of anemia[J].Ann Oncol,1999,10 (Suppl 5):91.
[3]陈灏珠,钟南山,陆再英.全国高等学校教材内科学[M].第8版.北京:人民卫生出版,2013:543-547.
[4]苏 贺,张凌云,刘云鹏.老年恶性肿瘤患者术后化疗相关性贫血的临床分析[J].中国肿瘤杂志,2015,4:290.
[5]欧汝奋.85例抗肿瘤药物不良反应临床分析[J].北方药学,2012,9(3):14.
[6]秦 瑞,吴达荣,胡 俊.晚期癌性贫血患者血清促红细胞生成素的检测及临床意义[J].临床和实验医学杂志,2006,5(2):107.
[7]姜 慧,杨 雷,白 鸥.1560例恶性实体肿瘤患者贫血状况分析[J].中国实验诊断学,2012,16(3):518.
[8]宋国红,刘淑俊,邸立军,等.肿瘤伴发贫血及其对肿瘤患者生活质量影响的调查[J].肿瘤防治杂志,2003,10(11):1186.
[9]Komidis P ,Krzakowski M. Anemia profiles in patients with lung cancer :what have we learned from the European Cancer Anaemia Survey(ECAS)?[J].Lung Cancer,2005,50(3):401.
[10]Gauthier I,Ding K,Wintion T,et al.Impact of hemoglooin level on outcomes of adjuvant chemotherapy in resected non-small.cellung cancer:the JBR.10 trial experience[J].Lung cancer,2007,55(3):357.
[11]Caro JJ,Salus M,Ward A,et al.Anemia as an independent prognostic factor for survival in patients with cancer:a systemic,quantita—tive review[J].Cancer,2001,91(12):2214.
[12]于之颖,王振江.7种化疗方案致肿瘤患者贫血及相关因素分析[J].中国药房,2010,21(14):17.
[13]Agrawal M,Aggarwal N,Sikka P.Unsuspected metastatic choriocarcinoma presenting as unexplained severe anaemia[J].J Obstet Gynaecol,2013,33(5) :536.
[14]Durigova A,Lamy PJ,Thezenas S.Anemia and iron biomarkers in patients with early breast cancer.Diagnostic value of hepcidin and soluble transferrin receptor quantification[J].Clin Chem Lab Med,2013,51(9):1833.

