NOD1 rs2075819A>G和rs2075820G>A遗传变异与肺癌发病的关系
董静,杨振邦,刘冲,刘睿,张雪梅,张志
(1华北理工大学附属唐山工人医院,河北唐山063000;2华北理工大学生命科学学院)
模式识别受体是进化保守的机体先天性免疫系统感受器,通过识别外源致病物(病原体相关分子模式)和内源致病物(损伤相关分子模式)激活胞内特异的信号途径,进而启动免疫应答。目前发现有5个模式识别受体家族,包括Toll受体、核苷酸结合寡聚域样受体(NOD)、AIM受体、GIG-1受体(RLRs)和C型凝集素受体。若模式识别受体信号失调,会导致感染、炎症和肿瘤发生[1]。NOD1是NLRs家族的重要一员,广泛表达于胚胎和成体的多种组织细胞中[2],定位于细胞质和细胞膜[3]。NOD1天然识别一种称为GM-TriDAP(GlcNAc-MurNAc-L-Ala-D-Glu-mesoDAP)的肽聚糖结构,这种结构存在于绝大多数革兰阴性菌和部分革兰阳性菌的胞壁中,其中,iE-DAP(γ-D-Glu-mesoDAP)是NOD1的最小活性配体[4]。除了直接结合细菌病原体(外源致病物)外,NOD1受体还可感知Rho GTPases活性改变[5]、细胞骨架组装异常[3]、内质网应激[6]和病毒寄生虫入侵[7](均为内源致病物),从而启动先天性免疫应答,并与恶性肿瘤[8]的发生密切相关。
肺癌是目前严重威胁人类健康的恶性肿瘤[9]。目前认为,肺结核、肺炎、哮喘和慢性阻塞性肺疾病等炎性肺部疾病可能是肺癌发生发展的诱因[10],提示模式识别受体基因多态性可能赋予个体对环境不同的敏感度,进而影响罹患肺癌的风险。研究表明,NOD1基因多态性可影响多种肿瘤发病风险[11,12],但关于NOD1基因多态性与肺癌易感性之间的关系少见报道。本研究旨在探讨NOD1基因rs2075819A>G和rs2075820G>A遗传变异与肺癌发病的关系。
1 资料与方法
1.1 临床资料 收集2008年3月~2012年12月在唐山市工人医院经病理检查确诊的原发性肺癌患者706例(病例组),男471例、女235例,年龄平均59.26岁,腺癌404例(57.2%)、鳞状细胞癌273例(38.7%),其他类型29例(4.10%)(腺鳞癌15例,支气管肺泡癌9例和大细胞肺癌5例),吸烟者316例(44.8%),吸烟量平均22.36支/d,非吸烟者390例(55.2%);选择同一时期该院的体检健康者706例作为对照组,男474例、女232例,年龄平均59.05岁。吸烟者200例(28.3%),吸烟量平均25.64支/d,非吸烟者506例(71.7%)。既往无肿瘤史。病例组与对照组性别、年龄分布差异均无统计学意义。病例组较对照组有更多的吸烟者(P<0.01)。用查阅病历资料结合问卷调查方式收集研究对象一般人口学资料及临床病理资料,并获得知情同意。本研究获得华北理工大学伦理委员会批准。
1.2 NOD1基因rs2075819A>G和rs2075820G>A遗传变异的基因分型 采用聚合酶链式反应-限制性片段长度多态性分析(PCR-RLFP)法。DNA提取:收集研究对象的外周静脉血2 mL,采用北京天根生化科技有限公司提供的DNA提取试剂盒提取DNA。NOD1 rs2075819上游引物:5′-GCAACTCGCAGATGCCTAC-3′,下游引物:5′-CATTCCCATACTTCCAAAG-3′。NOD1 rs2075820上游引物:5′-CACGGGCCGGCTAGACGCAGGGGT-3′,下游引物:5′-AGGCGCGCAGGTGGCTGGGGGAGA-3′。PCR反应体系为11 L,含上下游引物各0.3 L(10 mmol/L),基因组DNA 1~100 ng,2×PCR mix(2×Es Taq MasterMix,康为世纪生物科技公司)6 L,加水补足。PCR反应条件:94 ℃、3 min,94 ℃、40 s,56 ℃、1 min(rs2075819)/65 ℃、1 min(rs2075820),72 ℃、30 s,共35个循环,72 ℃、3 min。酶切反应体系为10 L,含PCR产物6 L,10×CutSmart Buffer(NEB公司)1 L,FBS(Gibco公司)0.1 L,限制性内切酶BsmFⅠ(rs2075819,NEB公司)0.1 L/BseRⅠ(rs2075820,NEB公司)0.25 L,加水补足。酶切条件为65 ℃水浴2 h(rs2075819)/37 ℃水浴3 h(rs2075820)。酶切产物于2%琼脂糖凝胶电泳进行基因型判断和分析。
1.3 统计学方法 采用SPSS16.0统计软件。计数资料以频次或百分比表示,比较采用χ2检验;用Logistic回归分析评价NOD1基因rs2075819A>G和rs2075820G>A变异与肺癌遗传易感性之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 基因型判读 NOD1 rs2075819A>G酶切后三种基因型:AA基因型产生一个338 bp的片段;AG基因型产生338 bp、247 bp和91 bp三个片段;GG基因型产生247 bp和91 bp两个片段。NOD1 rs2075820 G>A酶切后三种基因型:AA基因型产生一个419 bp片段;GA基因型产生419 bp、267 bp和152 bp三个片段;GG基因型产生267 bp和152 bp两个片段。每个检测单元均设立阴性对照及两个以上随机重复样本进行质量控制,并于总样本中随机抽取30个进行测序验证。
2.2 NOD1基因rs2075819A>G和rs2075820G>A遗传变异与肺癌发病风险的关系 Logistic回归分析表明,与NOD1 rs2075819AA基因型携带者相比,rs2075819AG基因型携带者发生肺癌的风险降低(OR=0.79,95%CI=0.63~0.99,P<0.05)。而NOD1 rs2075820各基因型在两组的分布差异无统计学意义(P均>0.05)。
2.3 NOD1基因rs2075819A>G和rs2075820G>A遗传变异对肺癌发病影响的分层分析 年龄分层显示,在≤60岁组中,rs2075819 AG基因型携带者具有较低的肺癌发病风险(OR=0.69,95%CI=0.51~0.94,P=0.018),而在>60岁组中差异无统计学意义(P>0.05)。吸烟分层显示,在不吸烟者中,rs2075819 AG基因型携带者具有较低的肺癌发病风险(OR=0.74,95%CI=0.56~0.98,P=0.037)。见表1。rs2075820G>A遗传变异在年龄和吸烟分层中差异均无统计学意义。见表2。
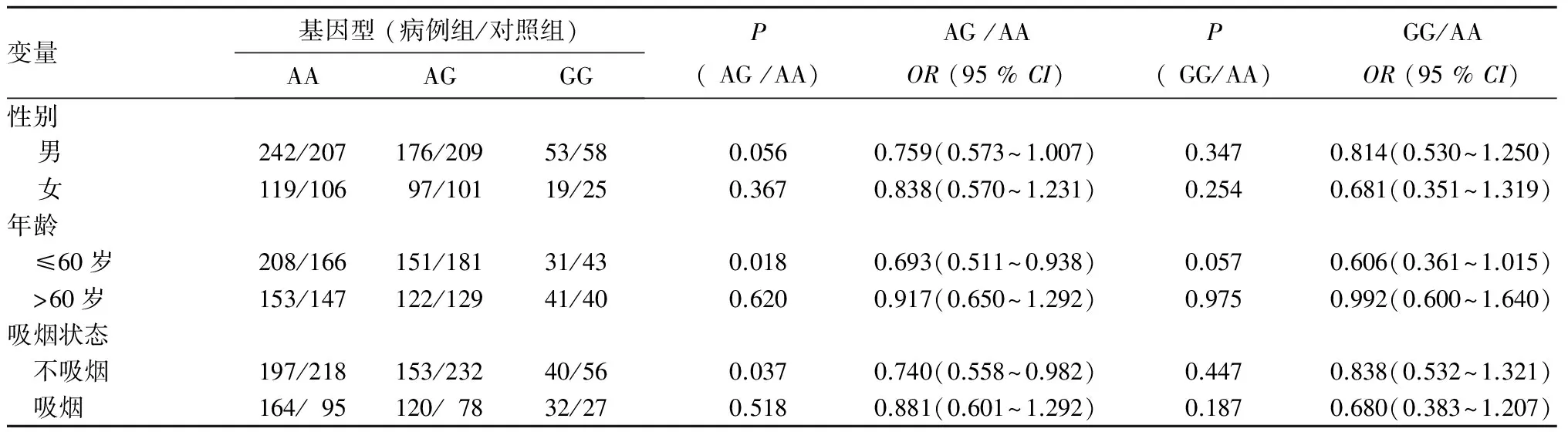
表1 NOD1 rs2075819A>G遗传变异与肺癌发病风险关系分层研究

表2 NOD1 rs2075820G>A遗传变异与肺癌发病风险关系分层研究
3 讨论
NOD1基因位于人染色体7p14-15,编码953aa,蛋白由3段结构域构成:C端亮氨酸重复序列结构域,直接识别外源致病物和内源致病物[13];中央核苷酸结合寡聚化结构域,具有天然ATP酶活性,负责与配体结合后发生自身寡聚化,从而招募下游信号蛋白[14];N端半胱天冬酶募集结构域(CARD),与适配蛋白RIP2通过同型CARD-CARD相互作用激活神经生长因子κB、丝裂原激活的蛋白激酶和干扰素刺激基因因子3等信号通路及转录因子激活蛋白1[15,16],进而启动免疫应答,介导炎症反应。通过分析癌症基因数据库数据信息,我们发现,NOD1在肺腺癌和肺鳞癌中均呈现显著性低表达,尽管有研究显示乳腺癌细胞中低表达的NOD1可能通过抑制肿瘤细胞凋亡的形式而促进肿瘤生长[8],但这种失调对于肺癌发生发展的影响机制尚不明确,也可能是弱化机体免疫对肺癌细胞的监控,从而促进肺癌细胞的生存和发展[17]。
本研究首次发现,NOD1基因rs2075819A>G变异影响中国北方人群非小细胞肺癌发病风险,与NOD1rs2075819AA基因型携带者相比,rs2075819AG基因型携带者具有较低的肺癌发病风险。通过年龄分层分析,我们发现在≤60岁者中,rs2075819AG基因型携带者具有较低的肺癌发病风险,而在>60岁者中差异无统计学意义,这个结果同Möckelmann等[11]在德国人群中对结直肠癌的研究结果一致,显示仅在<50岁组中,rs2075819A>G会降低结直肠癌发病风险。NOD1 rs2075819位于NOD1基因第5号内含子中,该位点多态性的功能意义不十分清楚,可能位于剪接元件中影响转录本的剪接效率。此外,我们同时对NOD1 rs2075820G>A对非小细胞肺癌遗传易感性的影响进行了研究,未发现具有相关性。这与Möckelmann等[11]的研究结果不一致,提示NOD1 rs2075820遗传变异可能在不同人种、不同组织中具有不同的作用机制。NOD1 rs2075820G>A(也称NOD1 E266K)位于NOD1基因第6号外显子中,G>A变异使编码谷氨酸变为赖氨酸,导致氨基酸性质发生改变,但关于这种变异如何影响NOD1基因功能未有报道。
吸烟是导致肺癌发病的高风险环境因素。本研究病例组中44.8%的患者为吸烟者,而对照组中仅有28.3%为吸烟者,差异具有统计学意义,证实了吸烟因素增加肺癌发病风险。有研究显示吸烟会直接影响NOD1信号通路[18],我们进一步对NOD1 rs2075819A>G和NOD1 rs2075820G>A进行吸烟分层分析,结果显示rs2075819A>G遗传变异与肺癌易感性相关只发生在不吸烟者中。
本研究同Ozbayer等[12]的研究均表明NOD1基因多态性与肺癌发病相关,证实了先天性免疫受体在肿瘤发生发展中的重要作用,提示包括NOD1受体在内的先天性免疫受体作为肺癌治疗靶点的潜能。然而,本研究对NOD1多态位点的功能学机制未做深入研究,同时所研究的多态位点较少,因此还需要更多的多态位点在更大的样本量中进一步研究。
参考文献:
[1] Werts C, Rubino S, Ling A, et al. Nod-like receptors in intestinal homeostasis, inflammation, and cancer[J]. J Leukoc Biol, 2011,90(3):471-482.
[2] Uehara A, Fujimoto Y, Fukase K, et al. Various human epithelial cells express functional Toll-like receptors, NOD1 and NOD2 to produce anti-microbial peptides, but not proinflammatory cytokines[J]. Mol Immunol, 2007,44(12):3100-3111.
[3] Kufer TA, Kremmer E, Adam AC, et al. The pattern-recognition molecule Nod1 is localized at the plasma membrane at sites of bacterial interaction[J]. Cell Microbiol, 2008,10(2):477-486.
[4] Girardin SE, Boneca IG, Carneiro LA, et al. Nod1 detects a unique muropeptide from gram-negative bacterial peptidoglycan[J]. Science, 2003,300(5625):1584-1587.
[5] Keestra AM, Winter MG, Auburger JJ, et al. Manipulation of small Rho GTPases is a pathogen-induced process detected by NOD1[J]. Nature, 2013,496(7444):233-237.
[6] Keestra-Gounder AM, Byndloss MX, Seyffert N, et al. NOD1 and NOD2 signalling links ER stress with inflammation[J]. Nature, 2016,532(7599):394-397.
[7] Fan YH, Roy S, Mukhopadhyay R, et al. Role of nucleotide-binding oligomerization domain 1 (NOD1) and its variants in human cytomegalovirus control in vitro and in vivo[J]. Proc Natl Acad Sci U S A, 2016,113(48):E7818-E7827.
[8] Chen GY, Shaw MH, Redondo G, et al. The innate immune receptor Nod1 protects the intestine from inflammation-induced tumorigenesis[J]. Cancer Res, 2008,68(24):10060-10067.
[9] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[10] Engels EA. Inflammation in the development of lung cancer: epidemiological evidence[J]. Expert Rev Anticancer Ther, 2008,8(4):605-615.
[11] Möckelmann N, von Schonfels W, Buch S, et al. Investigation of innate immunity genes CARD4, CARD8 and CARD15 as germline susceptibility factors for colorectal cancer[J]. BMC Gastroenterol, 2009,9:79.
[12] Ozbayer C, Kurt H, Bayramoglu A, et al. The role of NOD1/CARD4 and NOD2/CARD15 genetic variations in lung cancer risk[J]. Inflamm Res, 2015,64(10):775-779.
[13] Vijayrajratnam S, Pushkaran AC, Balakrishnan A, et al. Understanding the molecular differential recognition of muramyl peptide ligands by LRR domains of human NOD receptors[J]. Biochem J, 2017,474(16):2691-2711.
[14] Koonin EV, Aravind L. The NACHT family—a new group of predicted NTPases implicated in apoptosis and MHC transcription activation[J]. Trends Biochem Sci, 2000,25(5):223-224.
[15] Allison CC, Kufer TA, Kremmer E, et al. Helicobacter pylori induces MAPK phosphorylation and AP-1 activation via a NOD1-dependent mechanism[J]. J Immunol, 2009,183(12):8099-8109.
[16] Watanabe T, Asano N, Fichtner-Feigl S, et al. NOD1 contributes to mouse host defense against Helicobacter pylori via induction of type I IFN and activation of the ISGF3 signaling pathway[J]. J Clin Invest, 2010,120(5):1645-1662.
[17] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011,144(5):646-674.
[18] Qian YJ, Wang X, Gao YF, et al. Cigarette smoke modulates NOD1 signal pathway and human beta defensins expression in human oral mucosa[J]. Cell Physiol Biochem, 2015,36(2):457-473.

