FOXQ1-siRNA对甲状腺乳头癌TPC-1细胞侵袭迁移的影响及其机制
钟烨,杨光华,肖童,王晓涛,田炜,张国志
(1华北理工大学附属医院,河北唐山 063000;2华北理工大学医学实验中心)
近年来,甲状腺癌发病率逐年增加,其中最常见的病理类型是甲状腺乳头状癌(PTC)[1]。目前PTC的治疗主要采用手术切除治疗和放射性131I治疗,虽治疗效果尚可,但是有一定的复发率[1~3]。尽管PTC预后良好且恶性程度低,但仍然有10%PTC具有侵袭性,部分患者采用常规的治疗方法达不到理想效果[3]。因此近几年来生物学治疗成为该领域的研究热点,已经鉴定出多种癌基因参与人PTC的发生[4,5]。叉头框(FOX)基因家族功能庞大,最早在1989年由Weigel等[6]研究证实,这种转录因子从酵母到人类都广泛存在。作为FOX蛋白家族的重要成员, FOXQ1是一种可以调控细胞分化的转录因子,它与肿瘤的发病机制显著相关[7]。近年研究表明FOXQ1作为一种广泛存在的转录因子,可以激活多条信号通路从而参与调控肿瘤的发生发展、侵袭转移及细胞增殖等生物学功能[7, 8]。2017年8~12月,本研究通过siRNA沉默人TPC-1细胞中FOXQ1基因的表达,探讨FOXQ1-siRNA对于TPC-1细胞侵袭迁移的影响及其可能的机制,为PTC的基因靶向治疗提供新的思路。
1 材料与方法
1.1 材料 TPC-1细胞由天津医科大学医学实验中心赠予,用含10%胎牛血清(FBS)、1%青链霉素混合液的DMEM(高糖)培养基于37 ℃、5% CO2细胞孵箱中常规培养。DMEM培养基和FBS均购于Gibco公司,FOXQ1-siRNA、无义序列RNA购于苏州吉玛基因有限公司,RNA提取试剂盒购于日本TaKaRa公司、反转录试剂盒购于北京GenStar公司,SYBR Green qPCR Master Mix、FOXQ1引物及LipofectamineTM2000均购于美国 Invitrogen公司,兔抗人FOXQ1多克隆抗体购于英国Abcam公司,兔抗人MMP7、MMP9、AKT及p-AKT(Ser473)均购于美国CST公司,HR标记的山羊抗兔二抗、GAPDH抗体、Western相关试剂盒均购于上海碧云天公司,24孔Transwell小室购于美国Corning公司;Matrigel购于北京索莱宝科技有限公司。倒置高分辨率荧光显微镜购于日本OLYMPUS公司,qRT-PCR仪器购于中国香港Gene Company Iimited公司。
1.2 FOXQ1-siRNA转染细胞的干扰效果评估 取处于对数生长期的细胞,然后将TPC-1细胞消化制备成单个的细胞悬液,将密度调整为3×105/mL后取出细胞悬液1 mL接种于六孔板中,放于细胞培养箱中常规培养。当融合率达到70%时随机将细胞分为空白组、无义序列组及实验组进行转染;空白组中加入等量的磷酸盐缓冲液,无义序列组中加入LipofectamineTM2000和带有荧光标记的NC-siRNA(sense 5′-UUCUCCGAACGUGUCACGUTT-3′ ,antisense 5′-ACGUGACACGUUCGGAGAATT-3′),实验组加入转染试剂LipofectamineTM2000及带有荧光标记的FOXQ1-siRNA(sense 5′-GCACGCAGCAAGCC-AUAUATT-3′,antisense 5′-UAUAUGGCUUGCUGCG-UGCTT-3′),在同样的条件下转染TPC-1细胞。每组设置3个复孔。6 h后换液,分别在24、48、72 h利用荧光倒置显微镜观察荧光蛋白表达情况,当转染效率达到80%以上,放入培养箱继续培养用于qRT-PCR、Western blotting进一步检测FOXQ1-siRNA的干扰效率。
1.3 细胞FOXQ1基因mRNA相对表达量的检测 采用qRT-PCR法。转染48 h后,按TRIpure 说明书提取各组细胞总RNA,逆转录后进行PCR扩增。FOXQ1的上下游引物序列分别为5′-ATTTCTTGCTATTGACCGATGC-3′和5′-CCCAAGGAGACCACAGTTAGAG-3′。内参GAPDH上下游引物序列分别为5′-CCTGGAAGATGGTGATGGGATT-3′和5′-GGTGAAGGTCGGAGTCAACGG-3′。PCR扩增的条件: 预变性95 ℃、30 s,95 ℃、5 s, 60 ℃、30 s,延伸72 ℃、40 s,40个循环。以GAPDH为内参,各组的FOXQ1的CT值均经过GAPDH校正后,采用2-ΔΔCT法计算FOXQ1 mRNA相对表达量。每组设置3个复孔,进行平行实验3次。
1.4 细胞FOXQ1、p-AKT、MMP7、MMP9蛋白相对表达量的检测 采用Western blotting法。成功转染细胞后,提取各组细胞总蛋白,将蛋白裂解液与蛋白酶抑制剂按100∶1混匀后提取各组TPC-1细胞中总蛋白,BCA法蛋白定量,蛋白变性后按照每个泳道蛋白量30 μg上样,7.5%SDS-PAGE电泳并转膜。脱脂奶粉封闭2 h,分别加入一抗FOXQ1(1∶500)、AKT(1∶1 000)、p-AKT(1∶1 000)、MMP7(1∶2 000)、MMP9(1∶1 000)、GAPDH(1∶1 000)。4 ℃摇床过夜后,0.1%TBST洗膜3次,HR标记二抗(1∶1 000)室温孵育1 h,0.1% TBST洗膜3次,ECL荧光显色,用AI600化学发光成像仪(美国GE公司)成像。采用Image J软件分析各组条带灰度值。实验重复3次。
1.5 各组细胞迁移、侵袭能力的检测 采用Transwell小室试验。细胞的迁移能力:转染24 h后,将TPC-1细胞用0.25% 胰酶消化后用不含双抗的培养基制备成细胞悬液。将细胞悬液200 μL(2×105/mL)均匀接种于Transwell小室的上室内,在下室中每孔分别加入10% FBS DMEM培养基600 μL。48 h后,将放置于37 ℃细胞孵箱中的24孔Transwell小室取出。清除上室内未穿膜的细胞,用磷酸盐缓冲液冲洗干净,然后将黏附在下室面的细胞用4%多聚甲醛固定30 min,苏木素染色。在100倍的倒置显微镜下,每组随机选取5个视野,计算各组穿膜的细胞数。实验重复3次,计算各组细胞的平均值。细胞的侵袭能力:首先制备Transwell小室,按照1∶3的比例将提前预冷的不含血清DMEM与Matrigel稀释后,取稀释液40 μL均匀滴加在Transwell小室的上室面,放置于37 ℃恒温孵育箱过夜,次日紫外线灯下照射30 min。依照24孔小室检测细胞的迁移试验进行其余的步骤。显微镜下每组随机挑选5个视野,计算穿过小室膜的细胞数,分析侵袭能力的变化。各实验重复3次。
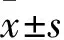
2 结果
2.1 FOXQ1-siRNA转染TPC-1细胞的干扰效果 无义序列组和实验组的siRNA转染到TPC-1细胞有绿色荧光蛋白的表达,在48 h时细胞转染率达80%以上。
2.2 各组TPC-1细胞中FOXQ1 mRNA及蛋白的表达比较 空白组、无义序列组、实验组FOXQ1 mRNA相对表达量分别为1.00±0.00、0.93±0.04、0.23±0.47;与空白组和无义序列组相比,实验组FOXQ1 mRNA表达量降低(P均<0.05);空白组和无义序列组比较,P>0.05。空白组、无义序列组、实验组FOXQ1蛋白的相对表达量分别为1.52±0.19、1.48±0.22、0.32±0.03。实验组FOXQ1蛋白表达量较空白组和无义序列组降低(P均<0.05),空白组与无义序列组比较,P>0.05。
2.3 各组TPC-1细胞中p-AKT、MMP7、MMP9蛋白的表达比较 实验组TPC-1细胞中p-AKT、MMP7、MMP9蛋白的相对表达量低于空白组和无义序列组(P均<0.05),空白组与无义序列组比较,P均>0.05。见表1。
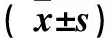
表1 各组TPC-1细胞中p-AKT、MMP7、MMP9蛋白的相对表达量比较
2.4 各组TPC-1细胞侵袭、迁移能力比较 迁移试验结果:实验组中穿过Transwell小室膜的TPC-1细胞数[(19.38±3.86)个/Hp]少于空白组[(68.23±7.38)个/Hp]和无义序列组[(65.12±6.36)个/Hp](P均<0.05);侵袭试验结果:实验组中穿过Transwell小室膜的TPC-1细胞数[(15.58±4.89)个/Hp]低于空白组[(48.62±6.28)个/Hp]和无义序列组[(45.38±5.63)个/Hp](P均<0.05)。
3 讨论
甲状腺癌是最常见内分泌肿瘤之一,目前已经成为女性第五位常见的肿瘤[9]。在甲状腺癌中,PTC约占80%,好发于女性和儿童,早期淋巴结转移发生率较高,这是影响PTC患者预后及复发的关键因素[10]。因此对于PTC侵袭转移相关机制的研究尤为重要。近年研究表明,转录因子FOXQ1参与多种肿瘤的生物学行为过程[11]。FOXQ1异常表达与肿瘤疾病的发生发展密切相关,可能是预测肿瘤疾病预后的关键性因子[12,13]。研究证实,FOXQ1在结直肠癌、肝癌、乳腺癌、膀胱癌等肿瘤中出现异常表达,其表达水平明显高于其癌旁正常组织,这种异常表达与肿瘤浸润及淋巴结转移显著相关,可能通过调控血管形成和抗凋亡作用导致肿瘤生长[14~16]。
研究发现,FOXQ1在PTC组织中也异常高表达,与淋巴结转移及TNM分期密切相关,它可能是调控PTC发生及发展过程中的关键因子。这些研究提示FOXQ1有可能是PTC分子生物治疗靶点的重要基因。siRNA是一种阻断特定基因的技术,具有高度的序列特异性,可以特异性地抑制RNA序列,从而极高效率地阻断目的蛋白的表达水平。本研究通过FOXQ1-siRNA瞬时转染TPC-1细胞,结果显示细胞内绿色荧光蛋白表达的转染效率达到80%以上,实验组中FOXQ1 mRNA和蛋白的相对表达量低于空白组和无义序列组。
研究表明,在PTC中PI3K/AKT信号通路异常改变,其参与基质金属蛋白酶(MMPs)活性的调节,与肿瘤浸润程度及淋巴结的转移存在密切联系。MMPs在多种肿瘤中过表达,是肿瘤的恶性程度及侵袭转移的相关蛋白。在PTC中MMP7、MMP9均存在高表达,且MMP7蛋白表达水平与肿瘤的大小及淋巴结的侵袭转移能力呈正相关;而MMP9的表达量与PTC肿瘤的侵袭转移有关,但与肿瘤的大小无关。Zhang等[8]研究发现,在乳腺癌中,上皮-间质转化(EMT)促进癌症侵袭和转移,敲低FOXQ1在形态学和分子水平上阻断TGF-β1诱导的EMT,从而抑制乳腺癌细胞的侵袭及转移能力。因此我们进一步探讨FOXQ1沉默对TPC-1细胞侵袭转移的影响及其可能的相关机制。本研究通过FOXQ1-siRNA沉默TPC-1细胞中FOXQ1基因后,体外侵袭迁移试验显示实验组中细胞的侵袭迁移能力低于空白组和无义序列组,说明FOXQ1是PTC侵袭转迁能力的重要调控因子。与Zhu等[16]在膀胱癌中siRNA靶向沉默FOXQ1可以通过逆转EMT抑制细胞侵袭迁移能力的研究结果相一致。进一步探讨沉默TPC-1细胞FOXQ1基因后抑制侵袭转移能力的相关机制,本研究结果表明实验组中PI3K/AKT信号通路关键因子p-AKT,以及与肿瘤的浸润侵袭转移密切相关的MMP7、MMP9蛋白的相对表达量低于空白组和无义序列组,提示FOXQ1基因可能是通过PI3K/AKT通路影响MMPs表达,从而对PTC的侵袭转移能力进行调控。
总之,本研究表明FOXQ1-siRAN转染TPC-1细胞可以有效地沉默FOXQ1的表达,并且FOXQ1基因可能通过PI3K/AKT信号通路抑制TPC-1细胞侵袭迁移能力,FOXQ1基因有可能成为PTC患者生物学治疗及预后的一个新靶标。但是FOXQ1在PTC中与肿瘤的微循环、细胞增殖的关系及相关细胞信号通路的调控机制尚有待于进一步研究。
参考文献:
[1] Sonkar AA, Rajamanickam S, Singh D. Papillary thyroid carcinoma: debate at rest[J]. Indian J Cancer, 2010,47(2):206-216.
[2] Moo TA, Fahey TJ. Lymph node dissection in papillary thyroid carcinoma [J]. Semin Nucl Med, 2011,41(2):84-88.
[3] Cohen Y, Xing M, Mambo E, et al. BRAF mutation in papillary thyroid carcinoma [J]. J Natl Cancer Inst, 2003,95(8):625-627.
[4] Nikiforov YE, Nikiforova MN. Molecular genetics and diagnosis of thyroid cancer[J]. Nat Rev Endocrinol, 2011,7(10):569-680.
[5] Greco A, Borrello MG, Miranda C, et al. Molecular pathology of differentiated thyroid cancer [J]. Q J Nucl Med Mol Imaging, 2009,53(5):440-453.
[6] Weigel D, Jürgens G, Küttner F, et al. The homeotic gene fork head encodes a nuclear protein and is expressed in the terminal regions of the Drosophila embryo [J]. Cell, 1989,57(4):645-658.
[7] Li Y, Zhang Y, Yao Z, et al. Forkhead box Q1: a key player in the pathogenesis of tumors (Review)[J]. Int J Oncol, 2016,49(1):51-58.
[8] Zhang H, Meng F, Liu G, et al. Forkhead transcription factor FOXQ1 promotes epithelial-mesenchymal transition and breast cancer metastasis[J]. Cancer Res, 2011,71(4):1292-1301.
[9] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016,66(1):7-30.
[10] Grant CS. Recurrence of papillary thyroid cancer after optimized surgery[J] . Gland Surg, 2015,4(1):52-62.
[11] 张锦锦,唐慧.叉头框Q1基因调控肿瘤发生和发展的研究进展[J].肿瘤,2017,37(2):177-183.
[12] Liang SH, Yan XZ, Wang BL, et al. Increased expression of FOXQ1 is a prognostic marker for patients with gastric cancer[J]. Tumour Biol, 2013,34(5):2605-2609.
[13] Zhou YL, Li YM, He WT. Application of mesenchymal stem cells in the targeted gene therapy for gastric cancer[J]. Curr Stem Cell Res Ther, 2016,11(5):434-439.
[14] Wang W, He S, Ji J, et al. The prognostic significance of FOXQ1 oncogene overexpression in human hepatocellular carcinoma[J]. Pathol Res Pract, 2013,209(6):353-358.
[15] Kaneda H, Arao T, Tanaka K, et al. FOXQ1 is overexpressed in colorectal cancer and enhances tumorigenicity and tumor growth[J]. Cancer Res, 2010,70(5):2053-2063.
[16] Zhu Z, Zhu Z, Pang Z, et al. Short hairpin RNA targeting FOXQ1 inhibits invasion and metastasis via the reversal of epithelial-mesenchymal transition in bladder cancer[J]. Int J Oncol, 2013,42(4):1271-1278.

