红叶石楠叶绿素的提取与纯化及抗氧化活性研究
霍湘芸,蒋耀瑛,王岁楼
(中国药科大学工学院,江苏南京 211198)
0 引言
叶绿素在自然界中普遍存在,有许多生物活性和生物功能,能降低胆固醇、抗衰老、排毒消炎,具有抗癌抗突变、抗贫血、保肝等功能[1]。红叶石楠作为一种观赏植物,常用于园林绿化,目前尚无其他用途。据介绍,石楠叶中含有多种活性物质,目前已从中提取出了熊果酸、齐墩果酸[2-3]、黄酮类化合物、绿色素类,但对于其品种之一的红叶石楠,还没有提取叶绿素等功能性色素的报道。对红叶石楠叶绿素的提取工艺进行优化,并对其体外抗氧化活性进行了初步研究,旨在为其开发利用提供参考。
1 材料与方法
1.1 材料与仪器
石楠叶:新鲜红叶石楠叶片,2017年5月采摘于中国药科大学江宁校区食堂门口。选择颜色鲜亮、形状完整的叶片,洗净、沥干水分,于40℃烘箱中烘干,恒质量后真空干燥1 h,取出粉碎后过100目筛,避光保存。
主要试剂:丙酮、石油醚、无水乙醇、氧化铝、焦性没食子酸、七水合硫酸亚铁、水杨酸、30%过氧化氢、硅藻土等,均为分析纯试剂;柱层析硅胶,100~200目。
主要仪器:DZF-6050型真空干燥箱、DFY-500型高速中药粉碎机、TU-1810型紫外-可见分光光度计、TGL-16G型高速台式离心机、KH-100B型超声仪、HH-8型数显恒温水浴锅、RE-4205型旋转蒸发器等,均为国产仪器;DV215CD型电子天平、OHAUS CORPORATION,美国产品。
1.2 叶绿素的提取
准确称取1 g鲜绿石楠叶子粉末,以一定料液比加入提取溶剂,在一定温度下提取一定时间,抽滤得滤液即为粗提液。
(1)料液比的影响。丙酮为溶剂,分别称取粉末1.0 g于试管中,提取温度45℃,提取时间2 h,在料液比1∶6,1∶8,1∶10,1∶12条件下暗处密封提取。于波长645,663 nm处测定吸光度。
(2) 提取溶剂的影响。选用95%乙醇、丙酮及石油醚,80%丙酮∶石油醚(1∶1),丙酮∶乙醇∶水(4.5∶4.5∶1),乙醇∶丙酮(1∶1),95%乙醇∶80%丙酮(1∶1),80%丙酮为溶剂,分别称取粉末1.0 g于试管中,料液比1∶10,温度45℃,暗处密封放置2 h提取。于波长645,663 nm处测定吸光度。
(3)提取温度的影响。丙酮为溶剂,分别称取粉末1.0 g于试管中,料液比1∶10,提取时间2 h,分别在温度30,40,45,50,55℃下暗处密封提取。于波长645,663 nm处测定吸光度。
(4)提取时间的影响。丙酮为溶剂,分别称取粉末1.0 g于试管中,料液比1∶10,提取温度50℃,暗处密封放置1.0,1.5,2.0,2.5,3.0 h提取。于波长645,663 nm处测定吸光度。
1.3 叶绿素的分离纯化
选用一定吸附剂和洗脱剂湿法装柱,加入1 mL叶绿素粗提液,用一定洗脱剂进行洗脱,收集色素液,测定吸光度。
(1) 最佳吸附剂的选择。分别称取15 g硅胶、硅藻土、氧化铝、硅胶∶硅藻土=1∶1、硅胶∶硅藻土=2∶1、硅藻土∶硅胶=2∶1吸附剂,湿法装柱,加入1 mL叶绿素粗提液,用洗脱剂(石油醚∶丙酮=2∶1)进行洗脱,收集色素液,于波长645,663 nm处测定吸光度。
(2) 最佳洗脱剂的选择。称取5份15 g硅藻土,分别用石油醚∶丙酮=4∶1,10∶3,7∶3,2∶1,5∶3湿法装柱,加入1 mL叶绿素粗提液,用洗脱剂进行洗脱,收集色素液,于波长645,663 nm处测定吸光度。
(3) 最佳吸附剂质量的选择。分别称取10.0,15.0,17.5,20.0,25.0 g不同质量的硅藻土,用洗脱剂(石油醚∶丙酮=2∶1) 湿法装柱,用洗脱剂进行洗脱,收集色素液,于波长645,663 nm处测定吸光度。
(4)分离纯化的正交试验。红叶石楠叶绿色素分离的正交试验采用三因素三水平L9(34)的设计方法。
分离纯化正交试验的因素及水平见表1。

表1 分离纯化正交试验的因素及水平
1.4 叶绿素含量的测定
于波长645,663 nm处测定粗提液或纯化液的吸光度。根据Arnon公式计算叶绿素a和叶绿素b的质量浓度(mg/L),乘以相应体积数,计算每1 mL样品叶绿素质量(μg/mL)。

式中:V——定容后样品体积,mL;
n——稀释倍数;
W——红叶石楠叶片粉末质量,g。
1.5 体外抗氧化活性考查
(1) 清除·OH的能力。配制反应体系溶液(9mmol/L硫酸亚铁1 mL,9 mmol/L乙醇-水杨酸1 mL,0.003%H2O21 mL),加入上述方法纯化后的叶绿素提取液,蒸馏水作参比,以空白试剂为对照,于波长510 nm处测定吸光度。
(2) 清除O2-·的能力。将3 mmol/L邻苯三酚溶液与50 mmol/L Tris-HCl缓冲液和上述纯化后的叶绿素提取液混合,以蒸馏水为参比溶液,10 mmol/L的HCl溶液作对照,于波长325 nm处每隔30 s测定吸光度。按以下公式计算O2-·清除率。

式中:ΔA1/Δt——邻苯三酚自氧化反应速率;
ΔA2/Δt——加入色素样液后邻苯三酚自氧化反应速率。
2 结果与分析
2.1 红叶石楠叶绿素的提取效果
料液比对红叶石楠叶绿素提取效果的影响见图1,提取溶剂对红叶石楠叶绿素提取效果的影响见图2,提取温度对红叶石楠叶绿素提取效果的影响见图3,提取时间对红叶石楠叶绿素提取效果的影响见图4。
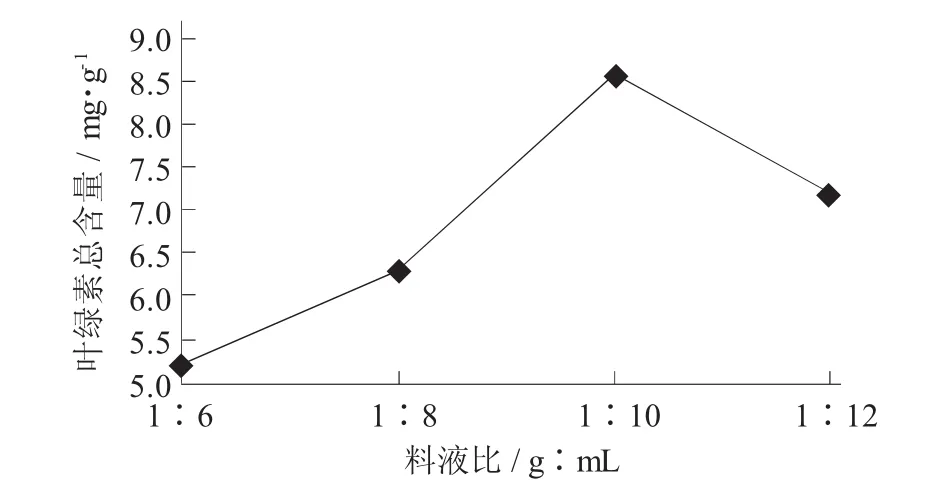
图1 料液比对红叶石楠叶绿素提取效果的影响

图2 提取溶剂对红叶石楠叶绿素提取效果的影响

图3 提取温度对红叶石楠叶绿素提取效果的影响

图4 提取时间对红叶石楠叶绿素提取效果的影响
从图1可知,在料液比1∶10时,叶绿素总含量最高,叶绿素提取效果最好;从图2可知,最佳提取溶剂为丙酮,此时叶绿素含量达到最大值,叶绿素提取效果最佳;从图3可知,随着提取温度升高,叶绿素含量逐渐增加,但提取温度高于45℃时,叶绿素含量逐渐减少;从图4可知,随着提取时间增加,叶绿素含量逐渐提高,但提取时间超过2 h,叶绿素含量逐渐减少。
按以上单因素试验选定的最优提取工艺条件(丙酮为提取溶剂,料液比1∶10,提取温度45℃,提取时间2 h)进行3批验证试验,结果表明粗提液叶绿素含量平均值可达16.42μg/mL,换算成原料石楠叶提取率约为10.26 mg/g。
2.2 红叶石楠叶绿素的分离纯化
吸附剂种类对叶绿素总含量的影响见图5,洗脱剂种类对叶绿素总含量的影响见图6,吸附剂质量对叶绿素总含量的影响见图7。

图5 吸附剂种类对叶绿素总含量的影响

图6 洗脱剂种类对叶绿素总含量的影响

图7 吸附剂质量对叶绿素总含量的影响
从图5可知,最佳吸附剂为硅藻土,此时叶绿素总含量达到最大值,叶绿素分离纯化效果最佳;从图6可知,洗脱剂为石油醚∶丙酮=2∶1的分离纯化效果最好;从图7可知,吸附剂硅藻土质量为15 g时,分离纯化效果最好。
L9(34)分离纯化正交试验结果见表2。
由表2可知,比较极差R大小,可知各因素影响次序依次为吸附剂质量、洗脱剂比例、吸附剂种类;比较同一因素不同水平的结果,可知最优条件组合是A1B3C3,此理论组合正好与正交试验中3号试验的条件组合一致,因此可以确定最佳分离纯化方案为叶绿素提取液1 mL,硅藻土17.5 g,石油醚∶丙酮为4∶1。

表2 L9(34)分离纯化正交试验结果
此时纯化倍数=99.44/16.42=6.06
式中:99.44——纯化前样品中叶绿素总含量,μg/mL;
16.42 ——纯化后样品中叶绿素总含量,μg/mL。
2.3 体外抗氧化试验结果
叶绿素清除·OH的速率见图8,不同质量浓度叶绿素清除O2-·的能力见图9。
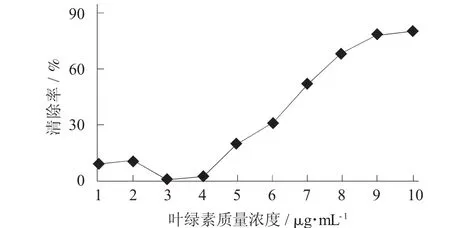
图8 叶绿素清除·OH的速率
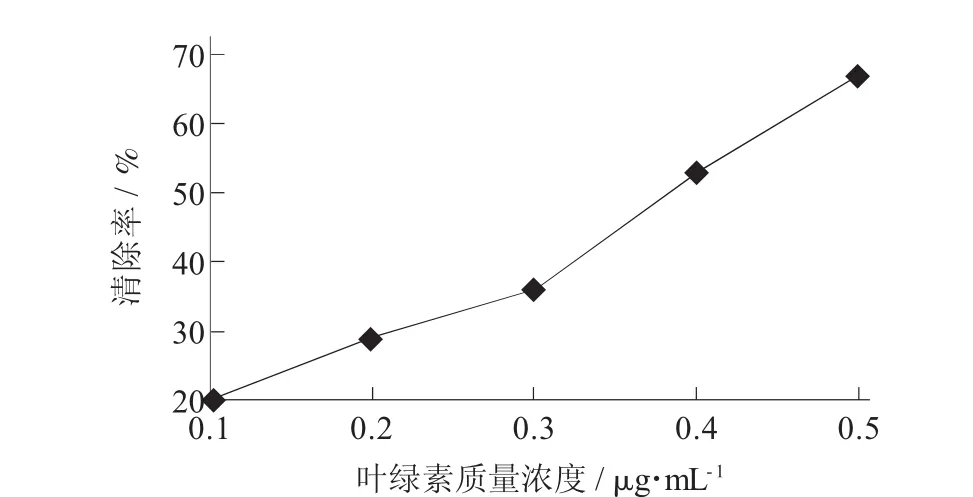
图9 不同质量浓度叶绿素清除O 2-·的能力
从图8可知,在一定体积内,随着叶绿素浓度的增加,其清除·OH能力先减弱后增强,当叶绿素达到一定浓度后,其清除·OH能力才会逐步增强;从图9可知,随着叶绿素质量浓度的增加,对O2-·的清除能力也在逐渐增强。
3 结论
(1)石楠叶绿素提取的最佳工艺条件为叶片粉碎度100目,以丙酮为提取溶剂,料液比1∶10,提取温度45℃,提取时间2 h,此时叶绿素提取率平均值达10.26 mg/g。
(2)石楠叶绿素粗提液分离纯化的最佳工艺条件为硅藻土17.5 g,加1 mL提取液,用石油醚∶丙酮为4∶1进行洗脱,此时纯化倍数可达6.06。
(3) 对·OH,O2-·的体外清除能力表明,红叶石楠叶绿素具有抗氧化活性。
从红叶石楠提取叶绿素具有一定的可行性和应用前景,其提取工艺条件及其抗氧化活性值得进一步研究探索。
参考文献:
[1]关锦毅,郝再彬,张达,等.叶绿素提取与检测及生物学功效的研究进展 [J].东北农业大学学报,2009,40(12):130-134.
[2]田丽婷,马龙,堵年生.齐墩果酸的药理作用研究概况 [J].中国中药杂志,2002(12):9-11,26.
[3]王鹏,张忠义,吴忠.熊果酸在药用植物中的分布及药理作用 [J].中药材,2000(11):717-722.◇

