口服H1抗组胺药治疗变应性鼻炎2018广州共识
李华斌 王向东 王洪田 谭国林 陈建军 徐睿 孟娟 张维天 杨钦泰 邱前辉0 唐隽 叶菁 王德辉
中国鼻病研究协作组
1 变应性鼻炎概述
变应性鼻炎(allergic rhinitis, AR)又称过敏性鼻炎,是一种常见的慢性鼻部炎症。全世界范围内AR的平均患病率约为20%,我国11个中心城市自报AR患病率为8%~20%[1-3]。AR的发生是环境因素和遗传背景交互作用的结果,其流行情况与社会经济水平成正相关。一般而言城市患病率高于农村,发达国家患病率高于欠发达国家。AR的主要临床表现为鼻痒、喷嚏、鼻塞和流涕,儿童患者常伴有鼻出血、咳嗽及睡眠打鼾。AR可不同程度影响患者的生活质量和精神情绪,并可诱发支气管哮喘、鼻窦炎、鼻息肉及分泌性中耳炎等并发症,给患者带来高昂的经济支出和严重的社会负担[4]。
AR是机体暴露于变应原后,主要由免疫球蛋白E(immunoglobulin E,IgE)介导的、多种炎性细胞(如T细胞、B细胞、嗜酸性粒细胞和肥大细胞等)参与的鼻黏膜非感染性慢性炎症性疾病。引发AR的变应原包括常年性变应原(如尘螨、霉菌等)或季节性变应原(如草花粉和树花粉)。相应地,AR可以按致敏的变应原分为常年性AR和季节性AR。AR的发病过程包括致敏和激发2个阶段。在致敏阶段,变应原首次暴露于机体后诱导机体发生免疫应答并产生特异性IgE。在激发阶段,变应原再次暴露于机体后与特异性IgE结合诱发一系列炎性介质(如组胺、白三烯、血小板活化因子、白细胞介素4和白细胞介素5等)的合成和(或)释放,导致产生鼻痒、喷嚏等一系列临床症状(图1)。

图1. AR的发病机制 TSLP:胸腺基质淋巴生成素;IL:白细胞介素;Th:辅助T细胞;ILC2:2型固有淋巴样细胞;CCL:趋化因子
AR的治疗包括环境控制(含健康教育)、药物治疗、免疫治疗和外科手术4个环节,其中药物治疗能够快速、有效、安全地控制AR的临床症状,是目前治疗AR的主要手段。临床上常用的治疗药物包括鼻用和口服糖皮质激素(以下简称激素)、鼻用和口服抗组胺药、口服抗白三烯药物、鼻用减充血剂和抗胆碱能药物[5]。口服抗组胺药在AR的治疗过程中占有重要的地位,被国内外多种指南推荐作为治疗AR的一线用药。为了进一步明确口服抗组胺药治疗AR的机制、地位、作用和注意事项,指导医师进行合理的临床用药,提高AR治疗的疗效和安全性,减少药物不良反应和患者的经济负担,中国鼻病研究协作组召集了国内鼻科学界的一线青年专家(图2),结合国内外最新的循证医学依据,制订了本共识。

图2. 参与制订共识的主要青年专家(2018,广州)
2 组胺的发现和H1抗组胺药的研发历程
组胺是广泛存在于人体组织中的一种具有促炎作用的神经递质。组胺在体内由组氨酸脱羧基而生成,通过H1、H2、H3和H4 4种类型的受体参与免疫调节和炎性反应。组胺的发现和H1抗组胺药的研发已分别历经100余年和70余年[6]。1907年,英国Barger和Dale首先合成了一种能够刺激豚鼠回肠平滑肌收缩的物质,即组胺。1929年,Dale等的研究证实组胺能够参与过敏反应的发病过程。例如,在AR的发病过程中,组胺可刺激鼻黏膜神经末梢引起鼻痒和喷嚏,增加鼻黏膜血管通透性引起流涕,刺激炎性细胞因子和黏附分子的分泌,增加嗜酸性粒细胞的聚集和介质释放导致鼻塞和流涕,是引起AR临床症状的核心炎性介质[7]。
在AR等变应性疾病的发病过程中,组胺主要通过H1受体发挥致炎效应。H1抗组胺药是临床最为常用的抗过敏药物之一,可用于治疗AR、结膜炎及荨麻疹等疾病[8]。1937年,意大利的Bouvet合成了第1个用于实验动物的H1抗组胺药;1942年,法国巴斯德研究所的Halpern等成功研制了可用于人体的H1抗组胺药苯苄乙二胺。由于在组胺的生物活性研究和H1抗组胺药研发中的重大发现,Dale和Bouvet分别于1936年和1957年获得诺贝尔医学和生理学奖。之后,第2代H1抗组胺药(包括第2代新型抗组胺药)陆续被研发出来并广泛应用于临床(图3)。
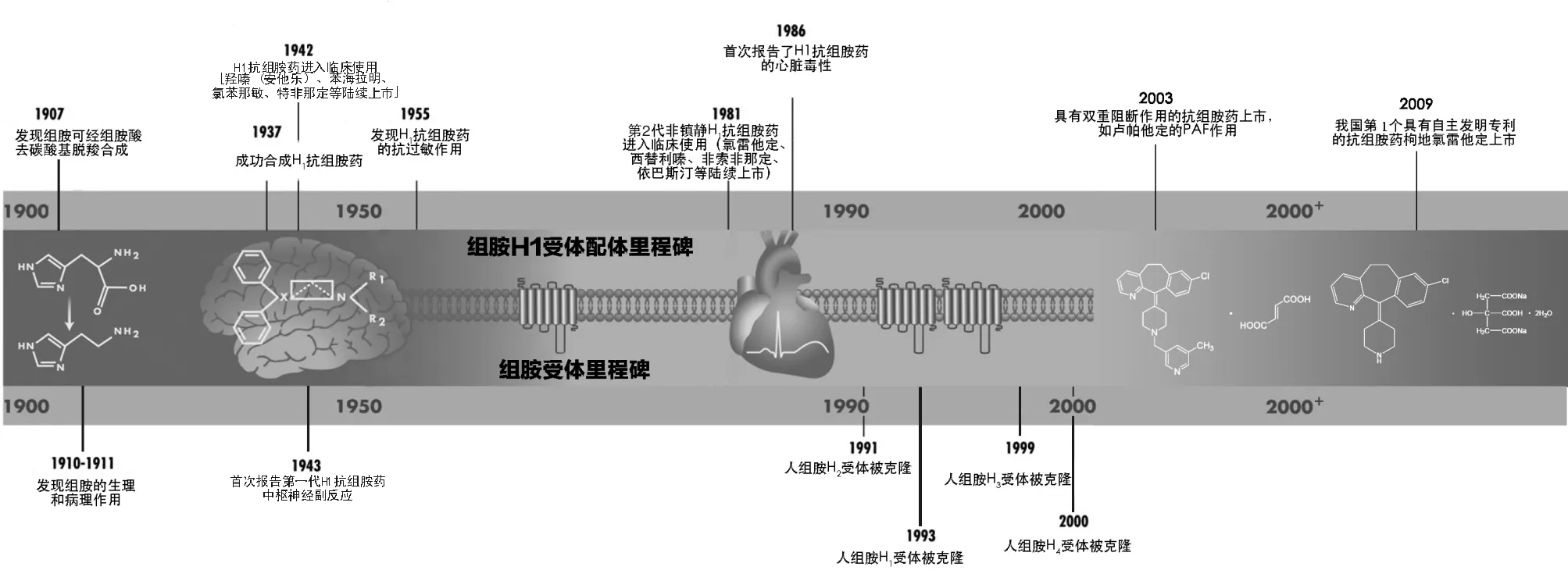
图3. 组胺的发现和H1抗组胺药的研发历程
3 H1抗组胺药的作用原理
H1抗组胺药对AR患者鼻痒、喷嚏、鼻塞、清涕等临床症状具有显著的抑制作用。根据化学成分,一般将H1抗组胺药分为6大类:烷基胺类、乙醇胺类、乙二胺类、酚噻嗪类、哌嗪类和哌啶类。各类药物在抗组胺、抗胆碱、镇静等方面的作用强度略有差异[7]。按照结构和功能特点,H1抗组胺药可分为第1代和第2代,其中第2代中又有第2代新型之说[8-10]。
H1抗组胺药主要作用于广泛分布于气道内的组胺H1受体而发挥药理效应,并由此而得名(图4)。经典的药理学研究证实,H1抗组胺药是通过与组胺之间竞争性结合组胺H1受体,或通过反激动剂样作用使组胺H1受体处于非活化状态,从而发挥拮抗组胺的作用。除经典的竞争H1受体机制外,许多第2代H1抗组胺药尤其是第2代新型H1抗组胺药还具有不同途径和不同程度的抗炎作用(包括H1受体依赖性和非依赖性2种途径)。H1受体依赖性途径即H1抗组胺药通过与H1受体结合后,通过胞内系列G蛋白偶联反应抑制核因子κB(NF-κB)活性,减少细胞内炎症因子的产生;H1受体非依赖性途径则是通过药物抑制跨膜Ca2+外流和环磷腺苷酸(cAMP)产生,稳定肥大细胞和嗜碱性粒细胞膜,从而减少细胞内炎症介质的释放[11-12]。此外,一些第2代新型H1抗组胺药还具有相对独特的药物和药理特征,如枸地氯雷他定,通过在地氯雷他定母环羟基位上偶联枸橼酸盐,可大大增加药物在肠道内的稳定性和水溶性,并使活性药物成分地氯雷他定得以更好地转运吸收;而富马酸卢帕他定通过吡啶环取代地氯雷他定氨基上的氢,并偶联富马酸盐,在增加药物稳定性和水溶性的同时,还具有抑制血小板活化因子的独特功能,从而在AR等变应性疾病的治疗过程中产生更优的治疗效果[13-14]。
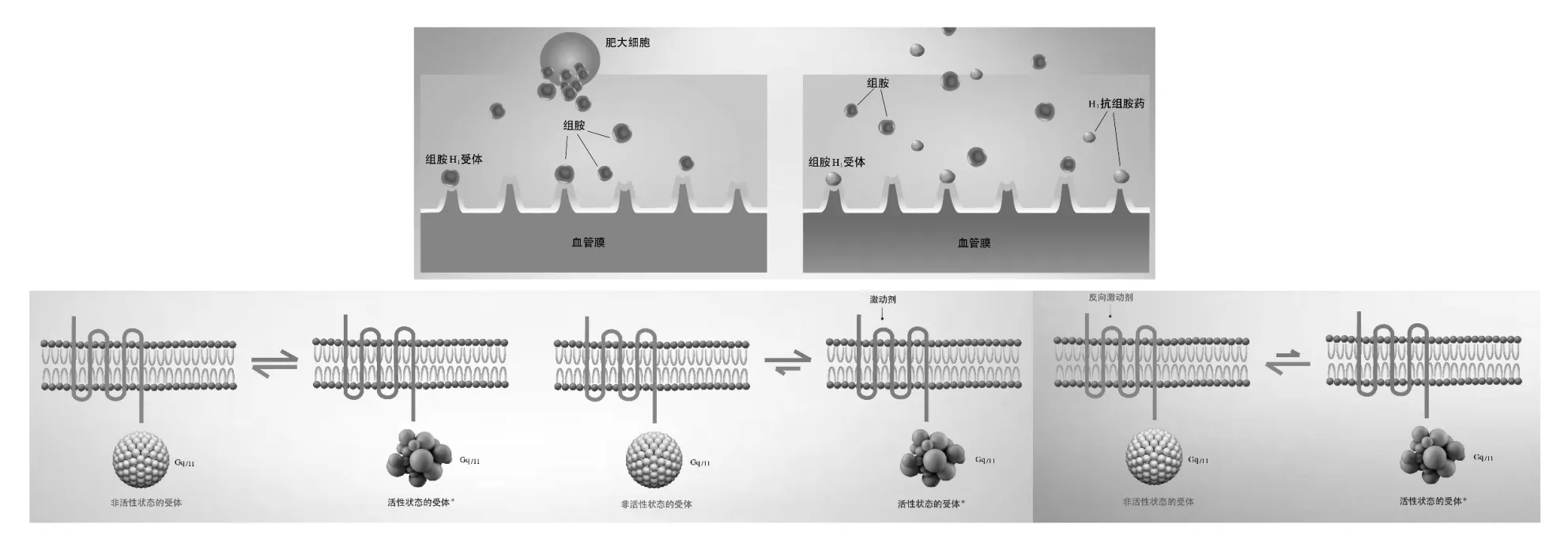
图4. H1抗组胺药的作用原理
4 H1抗组胺药在AR治疗中的临床应用
4.1 各类H1抗组胺药的临床药理特点 第1代H1抗组胺药是亲脂性药物,根据分子结构可分为多种类别,如烷基胺类[溴苯那敏、氯苯那敏(扑尔敏)、右氯苯那敏等]、乙醇胺类(氯马斯汀、茶苯海明、盐酸苯海拉明、多西拉敏等)、哌啶类(酮替芬、赛庚啶等)[15-16]。由于第1代H1抗组胺药分子结构具有很好的亲脂性,可以透过血-脑屏障与大脑中的H1受体结合;同时这些药物不是血-脑屏障内皮细胞P糖蛋白(发挥清除泵的作用)的底物,因而能够在中枢神经系统长时间存留导致镇静等作用[16]。
第2代H1抗组胺药可以被血-脑屏障内皮细胞的P糖蛋白清除,因而其中枢镇静作用较第1代H1抗组胺药显著减轻,且一般无抗胆碱能的副作用。其代表性药物有西替利嗪(哌嗪类)和氯雷他定、氮卓斯汀、依巴斯汀、奥洛他定以及卢帕他定(哌啶类)等。多数第2代抗组胺药需经肝脏代谢成活性成分而发挥药理作用。参与药物肝脏代谢的酶主要是细胞色素P450(cytochrome P450, CYP)同工酶CYP3A4。因此,当患者同时使用某些需要经肝脏CYP代谢的药物,例如大环内酯类抗生素、抗真菌药物和Ca2+拮抗剂时,会升高H1抗组胺药的血药浓度而增加其潜在的副作用。
第2代新型H1抗组胺药为第2代H1抗组胺药的衍生物或代谢产物,其代表性药物为左西替利嗪、地氯雷他定、枸地氯雷他定、非索非那丁等。这类H1抗组胺药一般不是CYP酶的底物,因此与红霉素和酮康唑等CYP抑制剂同时使用时,不会导致其血药浓度增高[17]。第2代新型H1抗组胺药如枸地氯雷他定除了具有较强的抗组胺作用外,还可能通过抑制转录因子NF-κB下调白细胞介素1β等很多促炎因子的表达而发挥抗炎作用,因此对鼻塞症状也有一定程度的缓解作用,是较西替利嗪、氯雷他定等更安全、更有效的H1抗组胺药[18-19]。
4.2 口服H1抗组胺药在治疗AR中的临床地位 AR是一种组胺相关的鼻黏膜慢性炎症,组胺主要参与AR激发阶段的速发相反应,是引发AR患者鼻痒、喷嚏、流涕和鼻塞等临床症状的关键炎性介质。口服H1抗组胺药作为治疗AR的重要药物,在临床应用已经有70多年的历史。由于第1代口服H1抗组胺药(如氯苯那敏等)具有较强的中枢抑制和抗胆碱能作用,在有条件使用第2代H1抗组胺药的情况下,出于安全和临床疗效的考虑,不推荐使用第1代H1抗组胺药。
国内外专家制订的多项AR诊疗指南均将口服H1抗组胺药定位为治疗AR的首选用药或一线用药。例如,由世界卫生组织鼻科和过敏反应专家制定的《变应性鼻炎及其对哮喘的影响》(AllergicRhinitisanditsImpactonAsthma,ARIA)指南中(2008版和2010版)[20],依据鼻部症状发生的时间及程度将AR分为间歇性(<4 d/周或<4周/年)和持续性(≥4 d/周或≥4周/年),并依据对生活质量的影响分为轻度和中-重度。该指南推荐将口服H1抗组胺药定位为治疗AR的一线用药,适用于所有类型的AR患者。ARIA指南认为在治疗AR时,口服第2代非镇静类H1抗组胺药,推荐在临床上持续治疗2~4周后再根据临床症状的改善情况进行调整。
由美国鼻科专家制定的AR诊疗指南(2015年)中按发病时间将AR分为季节性(如花粉致敏的)、常年性(如尘螨致敏的)和偶发性(平时不发病,只接触日常环境接触不到的变应原时才发病)[21]。对所有类型的AR患者,该指南都强烈推荐口服第2代H1抗组胺药(优选低中枢镇静作用者),特别适用于轻度及中度并以喷嚏和鼻痒为主诉的患者,原因在于口服第2代H1抗组胺药可良好地控制该类患者鼻部症状且具有费用低、患者依从性好等优点。
由中国鼻科专家制定的AR诊疗指南(2015年)中将AR按变应原种类分为季节性和常年性;同时按症状发作时间将AR分为间歇性和持续性,症状与严重程度的划分与ARIA指南基本一致[22]。在中国AR指南中,强调口服第2代H1抗组胺药可有效控制轻度和大部分中-重度AR患者的临床症状,临床使用过程中推荐每天1次,疗程≥2周。该指南将口服第2代H1抗组胺药推荐为上述所有类型AR患者的一线用药,同时对季节性AR,推荐在花粉播散期前口服第2代H1抗组胺药进行预防性治疗。
由日本鼻科专家制定的AR诊疗指南(2017年)将AR分为常年性和季节性2大类,并按主要症状类型分为鼻塞型、喷嚏-流涕型和混合型,同时按症状严重程度划分为轻、中、重度[23]。该指南强调应依据患者的主要症状类型进行个性化用药。所有类型轻度AR,以及中、重度、喷嚏-流涕型AR中,日本指南推荐口服第2代H1抗组胺药作为一线用药,并建议临床持续用药2~4周后再根据鼻部症状情况进行相应调整。
综合这些国内外指南的意见和建议,结合自身的临床经验,本共识推荐口服第2代H1抗组胺药作为治疗所有AR患者的一线用药,临床上可根据患者的症状特征和临床反应性单独使用或与其他类型的抗过敏药物(如鼻用或口服激素、口服抗白三烯药物等)联合使用。同样,对于各种类型AR的治疗,在有条件使用第2代H1抗组胺药的情况下,出于安全和临床疗效考虑,本共识不推荐使用第1代H1抗组胺药;而在有条件使用第2代新型H1抗组胺药的情况下,出于临床疗效的考虑,本共识更推荐使用第2代新型H1抗组胺药。
5 口服H1抗组胺药与其他主流抗过敏治疗的联合应用
5.1 口服H1抗组胺药与激素的联合应用 激素具有强大的抗炎作用,鼻用激素可以在鼻腔局部形成较高的药物浓度,利用率高,能够显著改善AR患者的鼻痒、喷嚏、流涕、鼻塞以及眼部和下呼吸道相关症状,是治疗AR的一线药物。鼻用激素的抗炎作用强度优于抗组胺药,但相比口服H1抗组胺药,其起效及显效时间出现得较晚。在中-重度AR,口服H1抗组胺药和鼻用激素联合用药能取得更好效果。
相比较于鼻用激素,口服激素对患者鼻部、眼部及下呼吸道症状的改善更加有效,但因其存在全身副作用的风险而不建议常规使用。对于鼻塞症状严重、下鼻甲显著肿胀或肥大的AR患者,口服H1抗组胺药和口服激素短期联用能有效改善AR患者的临床症状[24-25]。
5.2 口服H1抗组胺药与抗白三烯药物的联合应用 抗白三烯药物如孟鲁司特通过拮抗白三烯受体发挥临床效应,特别适合于合并哮喘的AR患者。口服H1抗组胺药和抗白三烯药物联用较之单独使用疗效更佳,且两药联用的副作用较之单独用药无明显差异。对于激素治疗不敏感且单用口服H1抗组胺药症状控制不佳的AR患者,可选择口服H1抗组胺药和抗白三烯药联用。
5.3 口服H1抗组胺药与减充血剂的联合应用 口服H1抗组胺药通常对AR患者的鼻痒、喷嚏、流涕等症状的改善效果显著,而对鼻塞症状的改善作用欠佳。口服H1抗组胺药与减充血剂联合使用能够很好地缓解AR患者的鼻部症状,特别是对鼻塞症状的改善效果良好。大多数情况下,单独服用H1抗组胺药可以有效控制AR患者的鼻部相关症状,少数患者在不能完全控制鼻塞症状的情况下,可合用减充血剂。鼻用减充血剂起效迅速,对于缓解AR患者鼻塞症状效果显著,但使用频率过高或是疗程过长,可使鼻黏膜损伤导致药物性鼻炎;因此,对于长期以鼻塞为主要症状的患者,鼻用减充血剂并非适宜选择。口服减充血剂不能用于4岁以下儿童,与H1抗组胺药联用可能出现失眠、头痛、口干、精神紧张等不良反应,合并心血管及泌尿系统疾病的患者更要严格把握适应证[26]。
5.4 口服H1抗组胺药与特异性免疫治疗的联合应用 变应原特异性免疫治疗是一种对因治疗,可以调节AR患者的免疫系统使其恢复正常。对于临床诊断明确、有免疫治疗意向的AR患者,只要没有相关的禁忌证,都可以在各类药物控制鼻部症状的同时启动特异性免疫治疗。进行变应原特异性免疫治疗的同时联用口服H1抗组胺药不仅有助于控制AR患者鼻部各项症状、改善患者的生活质量,还能提升患者的治疗依从性,避免持续大量用药可能带来的副作用。另外,对于特异性免疫治疗过程中出现的不良反应,亦可使用口服H1抗组胺药进行对症性干预[27]。
6 口服H1抗组胺药在特殊人群中的应用
6.1 口服H1抗组胺药在儿童AR患者的应用 儿童因其生长发育的特点,药物代谢有别于成人。首先儿童的神经系统正在发育过程中,而组胺和组胺H1受体对儿童正常的觉醒功能和认知功能特别重要;其次儿童肝脏对于药物的解毒能力差,血-脑屏障发育未成熟且通透性高,肾功能不完善导致药物排泄慢。鉴于此,口服H1抗组胺药种类的选择在儿童AR患者中的应用更应受到关注。
无论在成人或儿童患者,ARIA指南均推荐口服第2代H1抗组胺药作为治疗AR的一线药物。在间歇性AR及持续性AR中,其推荐等级均为A。儿童AR患者口服H1抗组胺药已被证明是安全、有效的。多数第2代H1抗组胺药的药品说明书提示其使用年龄下限为2岁。美国AR诊疗指南中推荐口服H1抗组胺药可用于年幼的儿童,并列出了美国6个月以上婴儿可使用的口服H1抗组胺药。尽管H1抗组胺药的安全性及有效性已被广泛证实,但ARIA指出对于低龄儿童仍需评估其有效性及不良反应。
第1代H1抗组胺药如苯海拉明、异丙嗪、氯苯那敏等,因其可跨越血-脑屏障,与中枢神经系统存在交互作用,有明显的中枢镇静作用。儿童使用可能导致学习能力下降(包括认知和运用知识的能力),并可能出现镇静、昏睡、口干、心动过速、易激惹、面部潮红、腹泻、散瞳、吐字不清、共济失调、癫痫发作等不良反应。第1代口服H1抗组胺药由于存在明显的中枢抑制和抗胆碱能作用,以及对认知功能的潜在影响,国内外多个AR诊疗指南都明确指出不推荐将其用于儿童患者。而第2代H1抗组胺药具有良好的安全性,对血-脑屏障的穿透性低,减少了对中枢神经系统的抑制作用,镇静和嗜睡不良反应较少见。随机对照试验也证实,第2代H1抗组胺药如氯雷他定、西替利嗪和第2代新型H1抗组胺药如左西替利嗪在12~36个月幼儿中长期用药的安全性和安慰剂相似。目前,第2代和第2代新型H1抗组胺药越来越普遍用于治疗儿童AR患者,其中许多药物已通过美国食品与药品管理局(FDA)批准用于儿童患者(表1)。由于第2代H1抗组胺药副作用少、作用时间长,大多可每日服用1次,儿童服药的耐受性好,家长和医师满意度高。而第2代新型H1抗组胺药较第2代H1抗组胺药具有口服吸收更快、起效更快、作用更持久、代谢率更低、不良反应更少等优势,因此对于儿童AR患者,特别是较低龄儿童,其临床应用具有明显优势。但是,在低于6月龄的儿童还缺少用药资料[28-29]。
6.2 口服H1抗组胺药在老年AR患者的应用 口服H1抗组胺药可常规用于老年AR患者。但是,第1代H1抗组胺药受体选择性较差,在拮抗组胺致炎效应的同时,也会产生抗胆碱能、抗5-羟色胺、抗多巴胺等副作用,由此可能造成尿潴留、心律失常、体位性低血压、心动过缓、散瞳等症状,使这些疾病在老年人群中提前发病或加重。其次,第1代H1抗组胺药可以通过血-脑屏障,从而更易引起镇静、嗜睡、焦虑和共济失调等神经、精神系统的副反应,而且第1代H1抗组胺药更容易和其他药物产生相互作用。因此,对老年AR患者一般慎用第1代H1抗组胺药。相比之下,第2代H1抗组胺药具有更好的受体选择性,且不易穿透血-脑屏障。研究显示,在老年人中第2代口服H1抗组胺药相比于第1代口服H1抗组胺药的中枢神经系统不良反应更少,与其他药物的相互作用也相对较少。因此,在老年AR患者更推荐使用第2代口服H1抗组胺药,尤其是第2代新型口服H1抗组胺药。
另外需要注意的是,大部分第2代口服H1抗组胺药是经由肝内CYP酶代谢且经由肾脏排泄。因此,对于肝功能或肾功能不全的老年AR患者,口服H1抗组胺药应酌情减量。除了特非那定,其他第2代口服抗组胺药多不具有心脏毒性,但如果在使用第2代口服H1抗组胺药的同时应用抑制肝微粒酶(如酮康唑、大环内酯类抗生素、喹诺酮类抗生素、西咪替丁等)的药物,可能会诱发心律失常。值得注意的是,老年人随着年龄增长,代谢、清除药物的能力均有所下降,对于年龄较大的AR患者,用药应谨慎且需要严密观察药物反应[30]。常用口服H1抗组胺药的药物相互作用及老年人用药注意事项见表2。
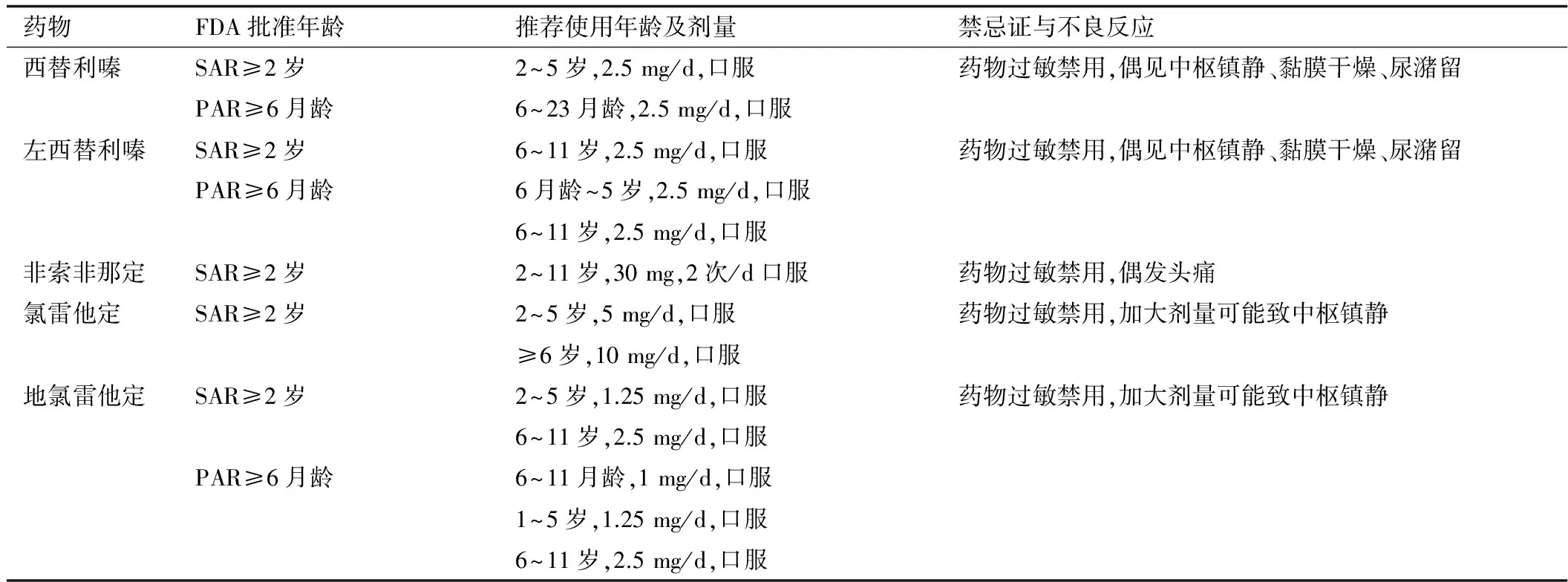
表1 第2代口服H1抗组胺药在儿童AR患者的推荐用药剂量
注:SAR为季节性AR; PAR为常年性AR

表2 常用口服H1抗组胺药的药物相互作用及老年人用药注意事项
6.3 口服H1抗组胺药在孕期、哺乳期、备孕期女性AR患者的应用 孕期、哺乳期、备孕期女性AR患者应权衡风险与收益(利与弊)来决定是否应用H1抗组胺药。按照国际惯例,临床医师仅仅提供建议。美国FDA根据药物对胚胎、胎儿的致畸情况,将药物分为A、B、C、D、X共 5个级别(A~X级致畸系数递增),并要求药品说明书上必须标明等级。某些药物可有2个等级,1个是常用剂量的等级,另1个是超常剂量等级[31]。5个级别的具体内容见表3。

表3 美国FDA关于孕期药物的致畸分级标准及代表性H1抗组胺药
妊娠期应用H1抗组胺药的原则:
1) 有明确的用药指征和适应证,可以在权衡得失的情况下酌情使用,既不能滥用,也不能有病不用;可用可不用的药物应尽量不用或少用。
2) 用药必须注意孕周,严格掌握剂量、用药时间。坚持合理用药,病情控制后及时停药;孕早期(头3个月)慎用H1抗组胺药,孕中后期可酌情应用B级抗组胺药如氯雷他定、西替利嗪及第1代H1抗组胺药(如氯苯那敏、苯海拉明等)。
3) 能单独用药就避免联合用药,能用结论比较肯定的药物就不用比较新的药物;当2种以上的药物有相同或相似的疗效时,选用对胎儿危害较小的药物;已肯定的致畸药物禁止使用。
由于大部分第1、2代H1抗组胺药如氯苯那敏、苯海拉明、氯雷他定、地氯雷他定、西替利嗪、左西替利嗪、特非那定、非索非那定、阿司咪唑、依巴斯汀、阿伐斯汀、曲普利啶、氯马斯汀、去氯羟嗪、咪唑斯汀、美喹他嗪可从乳汁分泌, 还可抑制泌乳及影响婴儿,因此哺乳期不推荐服用任何H1抗组胺药。
备孕期男性和女性AR患者可根据药物半衰期来推算药物洗脱期。超过药物的半衰期越长,药物的影响就会越小。H1抗组胺药中半衰期最长的是氮卓斯汀,为42 h。经过1个半衰期42 h后10 mg氮卓斯汀衰减到5 mg, 6个半衰期152 h(10.5 d)衰减到0.156 25 mg,12个半衰期(21 d)衰减到2.441 406 25 μg,13个半衰期(约23 d)衰减到1.220 703 125 μg。所以,1个月后体内药物浓度几乎可以忽略不计[32]。
7 口服H1抗组胺药的不良反应及注意事项
口服H1抗组胺药的不良反应包括中枢抑制效应、抗胆碱能效应等[33]。
1)中枢抑制效应如嗜睡等。第1代H1抗组胺药的基本结构为一个乙胺基母核, 辅以各种取代基,其H1受体选择性不强。由于分子较小,较易通过血-脑屏障, 与中枢神经系统内的H1 受体结合, 对中枢神经系统产生抑制和激动作用, 表现为幻觉、嗜睡、警觉性下降或者烦躁不安、紧张、失眠等,故而又称为镇静类H1抗组胺药[31]。第2代H1抗组胺药的结构与第1代完全不同, 分子一般较大并通常伴有长链, 脂溶性低, 不易透过血-脑屏障, 且H1受体选择性高。常规剂量口服,大多数患者都不会产生镇静、困倦和口干等副作用, 因而也称为非镇静类H1抗组胺药。但也有少数患者口服西替利嗪、阿伐斯汀等可能产生较轻的中枢抑制作用[34]。
2)抗胆碱能效应如口干等。H1抗组胺药与胆碱能受体结合,可导致口干、眼干、便秘等。
3)体重增加。部分H1抗组胺药在抑制皮肤、黏膜内H1受体的同时,亦可抑制幽门部的H1受体,导致胃排空时间缩短,致使食量增多而体重增加。代表性的药物如阿斯咪唑、氯雷他定、特非那丁和西替利嗪等。这种作用在不同的个体之间有较大的差异。
4)头昏、体位性低血压。部分H1抗组胺药抑制肾上腺素受体可以产生头昏、体位性低血压等。
5)心脏毒性。H1抗组胺药有可能对心脏的K+通道产生阻碍作用,影响心肌的复极化过程,故有潜在的心脏毒性风险,部分患者口服后可出现Q-T间期延长、窦性心动过缓、室性心动过速、室上性心动过速、心房纤颤等类型的心律失常。第2代口服H1抗组胺药中的特非那定和阿司咪唑因被发现在少数患者诱发Q-T间期延长及尖端扭转型室性心动过速,目前在许多国家已被停用。
6)其他。部分H1抗组胺药偶还可导致血管性水肿、支气管痉挛、光敏感、瘙痒、荨麻疹等过敏反应,且有个别惊厥、感觉异常、肌痛、关节痛、水肿、情绪紊乱、失眠、做噩梦、转氨酶升高和肝炎的报道。
使用口服H1抗组胺药的注意事项:
1) 高空作业者、驾驶员、机械操作人员禁用或慎用。尽可能避免与复方感冒制剂同时使用,因为许多复方感冒制剂中含有氯苯那敏等抗组胺药。
2) 避免与对中枢神经系统有抑制作用的饮料(如酒)、镇静催眠抗惊厥药[如地西泮(安定)]、抗精神失常药(如氯丙嗪)同用,否则有可能引起头昏、全身乏力、运动失调、视力模糊、复视等中枢神经过度抑制症状。儿童、老年人、体弱者更易发生。
3) 避免与抗胆碱类(如阿托品)、三环类抗抑郁药(如阿米替林)同用,否则可出现口渴、便秘、排尿困难、心动过缓、青光眼症状加重、记忆功能障碍等副作用。
4) 青光眼患者禁用苯海拉明、氯苯那敏等。前列腺肥大、幽门梗阻患者慎用赛庚啶、苯海拉明等。
参考文献
[1] Zheng M, Wang X, Bo M, et al. Prevalence of allergic rhinitis among adults in urban and rural areas of china: a population-based cross-sectional survey[J]. Allergy Asthma Immunol Res, 2015, 7(2):148-157.
[2] Wang XD, Zheng M, Lou HF, et al. An increased prevalence of self-reported allergic rhinitis in major Chinese cities from 2005 to 2011[J]. Allergy, 2016, 71(8):1170-1180.
[3] Zhang L, Han D, Huang D, et al. Prevalence of self-reported allergic rhinitis in eleven major cities in China[J]. Int Arch Allergy Immunol, 2009, 149(1):47-57.
[4] Fokkens W, Lund V, Mullol J, et al. European position paper on rhinosinusitis nasal polyps 2007[J]. Rhinol Suppl, 2007(20):1-136.
[5] 冯韶燕,邓春涛,李磊,等. 鼻用抗组胺药物治疗变应性鼻炎的Meta分析[J]. 中华耳鼻咽喉头颈外科杂志, 2014,49(10) : 832-838.
[6] Simons FE, Simons KJ. Histamine and H1-antihistamines: celebrating a century of progress [J]. J Allergy Clin Immunol, 2011, 128(6):1139-1150.
[7] 李华斌. 变应性鼻炎的发病机制及诊治进展[J]. 中华耳鼻咽喉头颈外科杂志, 2014, 49 (4) :347-352.
[8] O′Mahony L, Akdis M, Akdis CA. Regulation of the immune response and inflammation by histamine and histamine receptors [J]. J Allergy Clin Immunol, 2011, 128(6):1153-1162.
[9] Leurs R, Church MK, Taglialatela M. H1-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects [J]. Clin Exp Allergy, 2002, 32(4):489-498.
[10] Simons FE, Simons KJ. The pharmacology and use of H1-receptor-antagonist drugs [J].N Engl J Med, 1994, 330(23):1663-1670.
[11] Dávila I, del Cuvillo A, Mullol J, et al. Use of second generation H1 antihistamines in special situations[J]. J Investig Allergol Clin Immunol, 2013, 23 (Suppl 1): 1-16.
[12] Jutel M, Blaser K, Akdis CA. Histamine in allergic inflammation and immune modulation [J]. Int Arch Allergy Immunol, 2005, 137(1):82-92.
[13] Simons FE, Simons KJ. H1 antihistamines: current status and future directions [J]. World Allergy Organ J, 2008, 1(9):145-155.
[14] Schroeder JT, Schleimer RP, Lichtenstein LM, et al. Inhibition of cytokine generation and mediator release by human basophils treated with basophils[J]. Clin Exp Allergy, 2001, 31(9):1369-1377.
[15] 王成硕. 抗组胺药物的临床应用[J]. 中国医学文摘:耳鼻咽喉科学, 2011, 26(5):253-254.
[16] del Cuvillo A, Mullol J, Bartra J, et al. Comparative pharmacology of the H1 antihistamines[J]. J Investig Allergol Clin Immunol, 2006, 16 (Suppl 1):3-12.
[17] Mullol J, Roca-Ferrer J, Alobid I, et al. Effect of desloratadine on epithelial cell granulocyte-macrophage colony-stimulating factor secretion and eosinophil survival [J]. Clin Exp Allergy, 2006, 36(1): 52-58.
[18] Simons FE. Advances in H1-antihistamines [J]. N Engl J Med, 2004, 351(21):2203-2217.
[19] Gu QJ, He G, Fan J, et al. Randomized controlled study of desloratadine citrate and loratadine in the treatment of allergic rhinitis[J]. Int J Clin Exp Med, 2016, 9(2):4388-4395
[20] Brozek JL, Bousquet J, Baena-Cagnani CE, et al. Allergic rhinitis and its impact on asthma(ARIA)guidelines:2010 revision[J].J Allergy Clin Immunol, 2010,126(3):466-476.
[21] 沙骥超, 董震, 孟粹达, 等. 美国变应性鼻炎诊疗指南(2015)解读[J]. 中华耳鼻咽喉头颈外科杂志, 2015,50(8):699-703.
[22] 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组, 中华医学会耳鼻咽喉头颈外科分会鼻科学组.变应性鼻炎诊断和治疗指南(2015年, 天津)[J]. 中华耳鼻咽喉头颈外科杂志, 2016,51 (1):6-24.
[23] Okubo K, Kurono Y, Ichimura K, et a1.Japanese guidelines for allergic rhinitis 2017[J]. Allergol Int,2017, 66 (2): 205-219.
[24] Wilson AM, O'Byrne PM, Parameswaran K. Leukotriene receptor antagonists for allergic rhinitis:a systematic review and meta-analysis [J]. Am J Med, 2004, 116(5):338-344.
[25] Rasp G. Is there a role for leukotriene antagonists in the prevention of recurrent nasal polyps[J].Curr Opin Allergy Clin Immunol, 2010, 10(3):200-205.
[26] Scadding GK, Durham SR, Mirakian R, et al. BSACI guidelines for the management of allergic and non-allergic rhinitis [J]. Clin Exp Allergy, 2008, 38(1):19-42.
[27] Greiner AN, Hellings PW, Rotiroti G, et al. Allergic rhinitis [J]. Lancet,2011,378(9809): 2112-2122.
[28] Simons FE. H1-antihistamines in children [J]. Clin Allergy Immunol, 2002, 17:437-464.
[29] Ten Eick AP, Blumer JL, Reed MD. Safety of antihistamines in children [J]. Drug Saf, 2001, 24(2): 119-147.
[30] Simons FE, Prenner BM, Finn A Jr. Efficacy and safety of desloratadine in the treatment of perennial allergic rhinitis [J]. J Allergy Clin Immunol, 2003, 111(3):617-622.
[31] Piette V, Daures JP, Demoly P. Treating allergic rhinitis in pregnancy [J]. Curr Allergy Asthma Rep, 2006, 6(3):232-238.
[32] Keleʂ N. Treatment of allergic rhinitis during pregnancy [J]. Am J Rhinol, 2004, 18(1):23-28.
[33] Bartra J, Valero AL, del Cuvillo A, et al. Interactions of the H1 antihistamines [J]. J Investig Allergol Clin Immunol, 2006, 16(Suppl 1): 29-36.
[34] Church MK, Maurer M, Simons FE, et al. Risk of first-generation H1-antihistamines: a GA2LEN position paper[J]. Allergy, 2010, 65(4):459-466.

