反复发作的缺血性卒中
徐曼曼,徐 运
南京大学医学院附属鼓楼医院神经内科, 南京 210008
患者,女性,63岁,因“突发右下肢乏力2 d”于 2017年12 月 10日收住南京大学医学院附属鼓楼医院神经内科。患者有高血压病史5年余,服药后血压控制在130/80 mm Hg左右(具体药物不详),2年内曾发生2次小卒中,此次为第3次。每次卒中发生后采用双重抗血小板药物治疗(阿司匹林100 mg/d+氯吡格雷75 mg/d)3个月,随后改为单一抗血小板药物治疗(阿司匹林100 mg/d)长期服用。
入院查体:体温36.5 ℃,心率81次/min,呼吸18次/min,血压150/77 mm Hg,随机血糖5.8 mmol/L,心、肺、腹部查体均未见异常。神志清醒,精神可,言语清晰,脑神经检查正常。右下肢肌力4级,肌张力正常,余未发现异常体征。颈软无抵抗,克氏征、布氏征均阴性。美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS )评分1分。
辅助检查:头部磁共振成像及磁共振血管成像示左侧胼胝体体部及膝部急性脑梗死,左侧大脑前动脉粗细不均(图1)。血常规、血生化、凝血功能检查等未见异常。
入院主要诊断:(1)缺血性脑梗死(左侧颈内动脉系统);(2)高血压病;(3)陈旧性脑梗死。
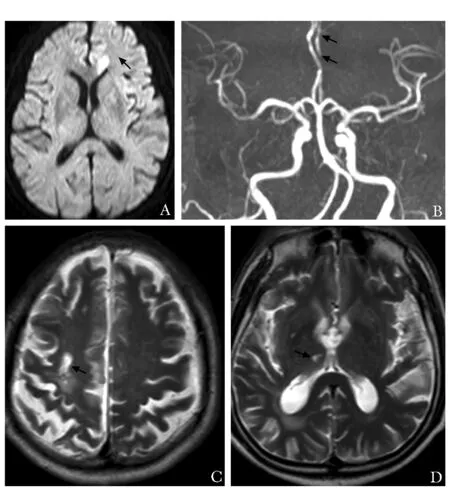
图 1 患者头部磁共振成像及磁共振血管成像(箭头) A.左侧胼胝体体部及膝部高信号,提示急性脑梗死;B.左侧大脑前动脉粗细不均;C.第一次右侧半卵圆中心陈旧性脑梗死;D.第二次右侧丘脑陈旧性脑梗死
患者2年内反复发作缺血性卒中,应分析原因,规范缺血性卒中二级预防干预措施。首先控制血管高危因素,如高血压、糖尿病、房颤、高脂血症、不稳定斑块等;其次,应用抗血小板药物,其在缺血性卒中二级预防中发挥至关重要的作用[1];最后,改进吸烟、肥胖等不良生活方式[2]。结合上述思路,逐因素分析。在血管高危因素中,曾有皮质下小卒中二级预防(Secondary Prevention of Small Subcor-tical Strokes, SPS3)研究,比较了严格降压与标准降压管理(收缩压130 mm Hg与130~149 mm Hg)对卒中复发结局的作用,显示较低血压组复发倾向低[3]。但本例患者血压控制较好,维持在130/80 mm Hg左右,故不考虑高血压/低血压/血压波动问题。此外,代谢综合症可通过激活炎症反应、影响血管舒缩和凝血功能、刺激肾素-血管紧张素系统,从而导致卒中复发[4]。不稳定斑块在缺血性卒中复发中扮演重要角色[5]。该患者血脂正常,颅内外血管未见明显斑块,故排除高血脂症和不稳定斑块因素。患者亦无不良生活方式。但因患者在一直规范服用强化抗血小板药物的情况下(阿司匹林100 mg/d+氯吡格雷75 mg/d)仍反复发作卒中,故不除外患者对这两种抗血小板药物存在低反应性,可能需要换用其他的抗血小板药物,如西洛他唑等,但仍需寻找证据。
患者接受血小板聚集试验(光学比浊法)检查:花生四烯酸(arachidonic acid,AA)诱导血小板聚集率7%(正常值:56%~82%,AA浓度5 mg/ml);二磷酸腺苷(adenosine diphosphate,ADP)诱导血小板聚集率91%(正常值:50%~80%,ADP浓度20 μm)。结果提示该患者阿司匹林有效,氯吡格雷疗效欠佳。
影响抗血小板药物反应性的原因很多,体内血小板聚集的不同途径及药物影响,如阿司匹林抑制TXA2途径,氯吡格雷抑制ADP途径,西洛他唑抑制腺苷通路;不同个体血小板聚集途径有差异药物的基因多态性、药物的生物利用度低、药物的相互作用及患者用药的依从性等均为影响因素[6- 7]。因此临床选择药物应根据患者个体情况,尽管存在一定局限,血小板功能检测仍可为临床药物选择提供参考。
血小板功能检测判断患者对阿司匹林和氯吡格雷的反应性的常用方法包括比浊法、阻抗法、循环血小板聚集体、自发性血小板聚集、Verify Now法[8]。在患者外周血中加用不同的血小板诱导剂,如阿司匹林采用AA、氯吡格雷采用ADP诱导血小板聚集。通常,抗血小板药物治疗前后7 d左右, 药物使用后的血小板聚集率较治疗前降低10%~20%提示抗血小板有效。该患者采用最方便最经典的比浊法检测血小板聚集率。结果提示阿司匹林有效(AA:7%),氯吡格雷无效(ADP:91%)。由于比浊法的检测结果影响因素多、检测结果不稳定,目前缺乏统一的质量控制标准,使用本方法时需注意以下问题:(1)血液采集、分离时间;(2)诱导剂应用的种类、浓度;(3)正常值的选定及抵抗的界定。故该结果需通过其他方法进一步验证。
采用血小板功能分析仪分析患者血小板功能,结果显示肾上腺素(epinephrine, EPI):136 s (正常值>193 s); ADP:109 s (正常值>82 s); P2Y受体:108 s(正常值>141 s),提示阿司匹林和氯吡格雷反应性均较低。
血小板功能分析为血小板功能检测常用手段之一,用于定量检测全血的血小板功能,其原理是全血通过反应盒内包被着胶原/ADP或胶原/EPI的硝酸纤维膜上的微孔,血小板黏附、聚集,形成血小板栓子,通过测定将微孔完全阻塞的时间(即闭孔时间),评估血小板功能。有研究显示[9],用此方法测量的阿司匹林低反应性与心血管事件相关。
为进一步证明阿司匹林是否有效,为患者进行了血栓弹力图仪(thromboela-stography, TEG)检测,结果显示,血小板功能MA值67.2 mm(正常值范围:50~70 mm),AA诱导的血小板抑制率为16%(正常范围>50%),提示该患者对阿司匹林反应性低。
TEG为目前最常用的新型血小板功能检测方法,反映血液凝固动态变化(包括纤维蛋白的形成速度、溶解状态和凝状的坚固性、弹力度)的指标。可检测凝血因子和凝血酶生成、血块形成、血块收缩、纤溶及血小板聚集程度[10]。整个检测过程中在血粘弹性力作用下瞬间被记录,软件处理后形成可视化曲线,通过分析曲线及计算相关参数评估血小板功能,如MA值代表血小板的聚集功能。Fu[11]等用TEG评估861例冠状动脉介入术后患者的血小板抑制率,发现血小板高活性与支架再狭窄密切相关(P=0.001)。
进一步检测患者体内代谢酶CYP2C19: 基因型为*2/*3(慢代谢型),再次提示氯吡格雷对该患者效果不佳。
氯吡格雷是一种前体药物,在肝脏中代谢后才有作用。体内代谢酶尤其CYP2C19影响较大,氯吡格雷在体内肝脏内P- 450酶(CYP3A4、CYP2C19)作用下,产生有效活性成分,作用于血小板表面ADP,抑制ADP诱导的血小板聚集途径。对随机入组的263例缺血性卒中患者检测CYP2C19基因多态性,氯吡格雷治疗3个月;同时对263例(191例枚椎动脉支架)服用氯吡格雷1年以上,随访最长7年的患者进行了回顾性研究,发现中国人群CYP2C19 *2/*3 基因型影响氯吡格雷疗效[7,12]。其他大样本研究亦有相同结果[13- 14]。2010年5月,美国食品药品监督管理局已宣布在氯吡格雷的用药过程中需考虑个体差异,检测CYP2C19基因型也可协助临床医生选择氯吡格雷药物及调整剂量[15]。
生化检测、结合血小板聚集试验、血小板功能检测、TEG及药物基因组学检测均证明了阿司匹林和氯吡格雷的低反应性。
基于以上检测结果,该患者停止服用阿司匹林和氯吡格雷,改用西洛他唑100 mg×2次/d,随访一年余,未再有卒中事件发生。目前仍在随访中。
目前对个体化抗血小板药物治疗尚无指南,短时间内多次复发卒中应分析其原因,血小板药物反应性是重要原因之一,需结合血小板聚集试验、血小板功能试验、药物基因组学及药物代谢产物等,综合判断患者对抗血小板药物的反应性,确定是否需要增加药物剂量或更换抗血小板药物,实现个体化治疗,降低卒中的复发率和致残率。
参 考 文 献
[1] Esenwa C, Gutierrez J. Secondary stroke prevention: challenges and solutions [J]. Vasc Health Risk Manag, 2015, 11:437- 450.
[2] Lee PN, Thornton AJ, Forey BA, et al. Environmental Tobacco Smoke Exposure and Risk of Stroke in Never Smokers: An Updated Review with Meta-Analysis [J]. J Stroke Cerebrovascular Dis,2017, 26:204- 216.
[3] SPSS3 Study Group, Benavente OR, Coffey CS, et al. Blood-pressure targets in patients with recent lacunar stroke: the SPS3 randomised trial [J]. Lancet,2013, 382:507- 515.
[4] Lin MP, Ovbiagele B, Markovic D, et al. Association of Secondhand Smoke with Stroke Outcomes[J]. Stroke,2016, 47:2828- 2835.
[5] Fu J, Tang J, Yang J, et al. Adding computed tomography and transcranial Doppler findings to the ABCD2 score to predict long-term risk of stroke after transient ischaemic attack or minor stroke [J]. Eur J Neurol, 2015, 22:520- 526.
[6] Chadha DS, Sumana B, Karthikeyan G, et al. Prevalence of aspirin resistance in Asian-Indian patients with stable coronary artery disease [J]. Catheter Cardiovasc Interv,2016, 88:E126-E131.
[7] Jia DM, Chen ZB, Zhang MJ, et al. CYP2C19 polymor-phisms and antiplatelet effects of clopidogrel in acute ischemic stroke in China [J]. Stroke,2013, 44:1717- 1719.
[8] Cattaneo M, Cerletti C, Harrison P, et al. Recommendations for the Standardization of Light Transmission Aggregometry: A Consensus of the Working Party from the Platelet Physiology Subcommittee of SSC/ISTH [J]. J Thromb Haemost, 2013,11:1183- 1189.
[9] Chen HY, Chou P. PFA- 100-measured aspirin resistance is the predominant risk factor for hospitalized cardiovascular events in aspirin-treated patients: A 5-year cohort study [J]. J Clin Pharm Ther, 2018,43:249- 255.
[10] Quarterman C, Shaw M, Johnson I, et al. Intra- and inter-centre standardisation of thromboelastography (TEG®) [J]. Anaesthesia,2014, 69:883- 890.
[11] Fu Z, Dong W, Shen M,et al. Relationship between hyporesponsiveness to clopidogrel measured by thrombelastography and in stent restenosis in patients undergoing percutaneous coronary intervention [J]. Clin Biochem, 2014, 47:197- 202.
[12] Lin YJ, Li JW, Zhang MJ, et al. The association between CYP2C19 genotype and of in-stent restenosis among patients with vertebral artery stent treatment [J]. CNS Neurosci Ther, 2014, 20:125- 130.
[13] Pan Y, Chen W, Xu Y, et al. Genetic Polymorphisms and Clopidogrel Efficacy for Acute Ischemic Stroke or Transient Ischemic Attack: A Systematic Review and Meta-Analysis[J]. Circulation, 2017, 135:21- 33.
[14] Wang Y, Zhao X, Lin J, et al. Association Between CYP2C19 Loss-of-Function Allele Status and Efficacy of Clopidogrel for Risk Reduction Among Patients With Minor Stroke or Transient Ischemic Attack [J]. JAMA, 2016, 316:70- 78.
[15] Anderson CD, Biffi A, Greenberg SM, et al. Personalized approaches to clopidogrel therapy: are we there yet? [J].Stroke,2010, 41:2997- 3002.

