非酒精性脂肪性肝病与冠状动脉侧枝循环形成的相关性研究
吴慧婷,李秀琪
冠状动脉侧枝循环(CCC)是不同冠状动脉或同一冠状动脉不同节段之间相互连接而形成的吻合通道,在生理状态下基本处于关闭状态。当冠状动脉严重狭窄或闭塞后,这些侧支血管可逐渐开放并转变为有功能的CCC,以保障缺血心肌的血液供应[1]。近年来研究表明,良好的CCC有助于改善心肌缺血症状、缩小心肌梗死范围、降低室壁瘤风险并改善患者的远期预后[2]。鉴于CCC的重要作用,研究其形成的相关因素已成为心血管疾病领域的热点问题。非脂肪性酒精性肝病(NAFLD)是一类非酒精因素所致的以肝细胞内脂肪过度沉积为特征的临床综合征,常伴随明显的全身炎症反应和胰岛素抵抗,而后两者均可影响CCC的形成[3,4]。因此,NAFLD可能与冠心病患者CCC的形成之间存在联系。本研究回顾性分析182例冠状动脉严重狭窄患者的临床资料,旨在探讨NAFLD对CCC形成的影响。
1 资料与方法
1.1 研究对象 连续选取长江航运总医院心内科病房于2015年6月~2017年9月收治的冠心病患者182例为研究对象,其中男性129例,女性53例,平均年龄(62.4±10.7)岁。纳入标准:冠状动脉造影提示三支主要冠状动脉(前降支、回旋支、右冠状动脉)中至少一支狭窄程度≥95%。排除标准:①急性冠脉综合征患者;②冠状动脉畸形或合并心肌桥;③先天性心脏病或心脏瓣膜病者;④既往冠状动脉旁路移植或经皮冠状动脉介入术史;⑤严重心、肝、肾功能不全者;⑥合并感染、肿瘤、全身免疫性疾病;⑦未行腹部或肝脏超声检查者。
1.2 临床资料
1.2.1 一般资料 收集患者的年龄、性别、2型糖尿病史、高血压病史、吸烟史、饮酒史以及常见心血管药物使用情况,包括阿司匹林、他汀类、β受体阻滞剂和ACEI/ARB类。测量患者入院后的身高、体重,并计算体质指数。记录患者NAFLD的患病情况,其诊断参照2010年中华医学会肝病学分会脂肪肝和酒精性肝病学组所制定的NAFLD诊疗指南[5]。
1.2.2 实验室检查 患者入院后第2 d清晨空腹采集静脉血,采用Beckman AU5800全自动生化分析仪检测三酰甘油、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、血肌酐、高敏C反应蛋白(hs-CRP)和空腹血糖。应用PHILIPS IE33超声心动仪对所有患者行心脏超声检查,并记录左室射血分数(LVEF)。
1.2.3 冠状动脉造影评价 所有患者均接受择期冠状动脉造影,并由两位经验丰富的介入医师对其结果进行评价,具体内容包括病变血管程度及部位。根据Gensini评分系统[6]计算患者的Gensini评分,从而对冠状动脉病变狭窄程度进行定量评价。另外采用Rentrop标准对CCC的形成情况进行分级:0级,无侧枝循环;Ⅰ级,有侧支循环,但仅有病变血管远端分支显影;Ⅱ级,有侧支循环,病变血管主干部分显影;Ⅲ级,有侧支循环,病变血管主干完全显影。Rentrop 0级和Ⅰ级视作CCC形成不良,而Rentrop Ⅱ级和Ⅲ级视作CCC形成良好。
1.3 统计分析 应用SPSS 20.0软件进行数据分析,计量资料以(均数±标准差)表示,组间比较采用独立样本t检验;计数资料以率表示,组间比较采χ2检验。采用多因素Logistic回归分析影响CCC形成的独立因素。以P<0.05为差异有统计学意义。

表1 一般资料及实验室检查结果
2 结果
2.1 基本临床资料比较 在纳入的182例患者中,CCC形成不良组有85例,而CCC形成良好组有97例。CCC形成不良组患者的hs-CRP[(5.16±1.63)mg/Lvs. (3.86±1.17)mg/L]和空腹血糖水平[(5.79±1.66)mmol/Lvs.(5.33±41)mmol/L)]明显高于CCC形成良好组,而他汀类药物应用比例(23.5%vs. 37.1%)和舒张压[(78.1±12.6)mmHgvs.(81.6±10.1)mmHg](1 mmHg=0.133kPa)明显低于CCC形成良好组,差异有统计学意义(P<0.05),两组患者的年龄、性别和其他资料差异无统计学意义,见表1。
2.2 冠状动脉造影结果比较 CCC形成不良组的Gensini评分和右冠状动脉严重狭窄比例均低于CCC形成良好组,差异有统计学意义(P<0.05),两组患者的其他造影结果差异无统计学意义,见表2。
2.3 NAFLD和CCC的关系 随着Rentrop分级的增加,NAFLD患者比例逐渐降低。其中,RentropⅡ级(26.2%)和Ⅲ级(21.9%)患者的NAFLD比例显著低于Rentrop 0级(55.9%)和Ⅰ级(41.2%)患者,而后两者的NAFLD患病比例无显著差异(图1)。总体来看,CCC形成不良组的NAFLD患者比例为47.1%(40/85),而CCC形成良好组为24.7%(24/97),差异具有统计学意义(χ2=9.90,P<0.01),见图1。
2.4 多因素Logistic回归分析 将上述P值<0.1的变量代入多因素Logistic回归模型进行分析,其中因变量为CCC的形成情况。结果表明,NAFLD(OR=2.13,95%CI:1.20~3.77;P=0.01)、hs-CRP(OR=1.61,95%CI:1.02~2.54;P=0.04)、Gensini评分(OR=0.83,95%CI:0.72~0.95;P=0.01)和右冠状动脉严重狭窄(OR=0.70,95%CI:0.50~0.98;P=0.04)是CCC形成不良的独立影响因素,见表3。
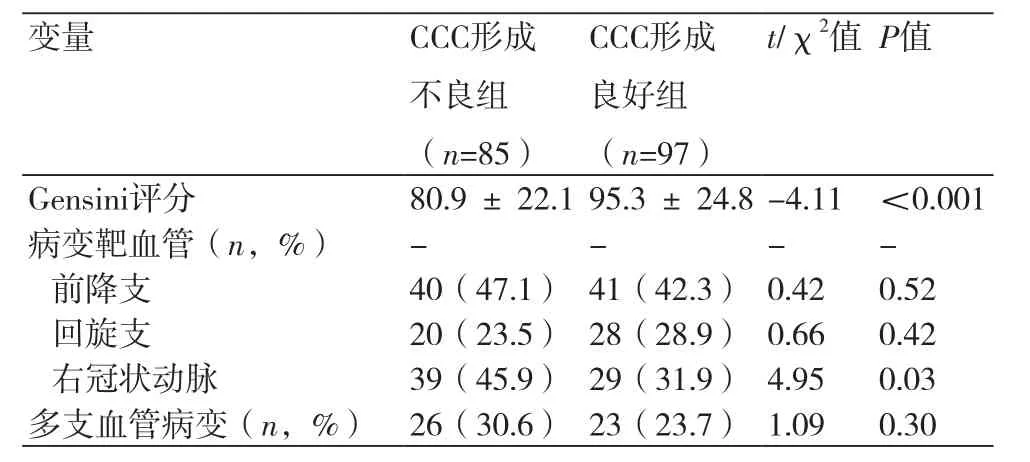
表2 冠状动脉造影结果
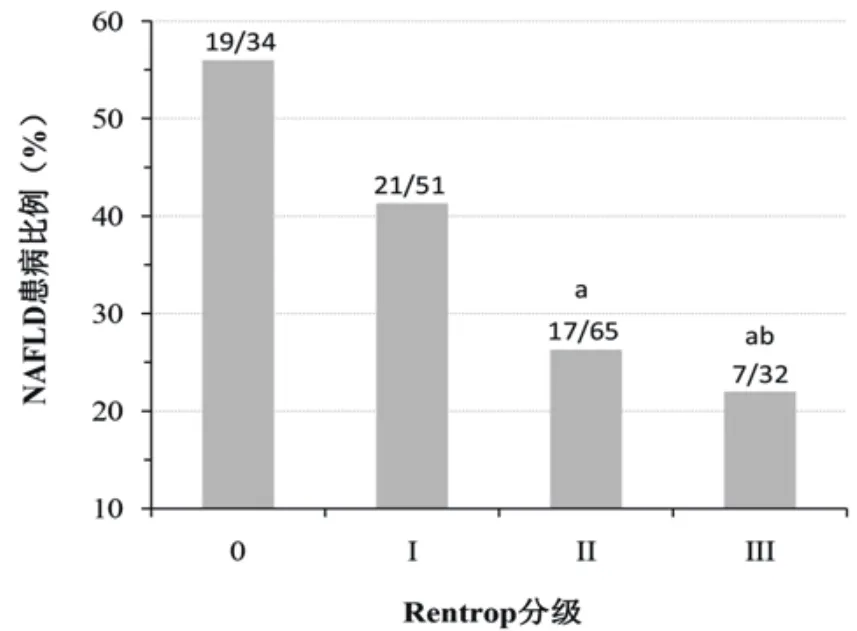
图1 不同Rentrop分级组NAFLD的患病情况。
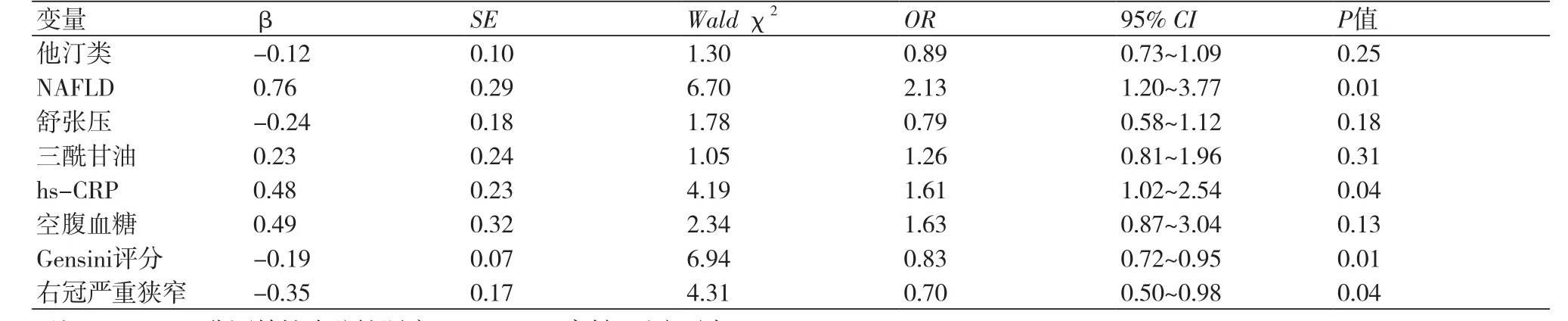
表3 多因素Logistic回归分析
3 讨论
NAFLD是临床上常见的慢性病,在普通人群中的发病率约为25.2%[7]。随着人们生活水平的提高和饮食结构的改变,NAFLD的发病率正逐年上升。除了造成肝脏损害外,NAFLD还与心房颤动、冠心病等心血管病的发病密切相关[8],并可预测冠状动脉介入术后支架内再狭窄的发生[9]。然而,目前尚不确定NAFLD是否与CCC的生成相关。本研究选取182例行冠状动脉造影患者的进行分析,发现NAFLD的患病率随CCC的Rentrop分级增加而降低。同时,多因素Logistic回归分析提示NAFLD是患者CCC形成不良的独立危险因素。
关于NAFLD影响CCC生成的具体机制尚不明确,可能与其引起的微血管功能紊乱有关。NAFLD的一个重要病理特征是胰岛素抵抗。胰岛素抵抗引起外周脂肪分解导致肝细胞脂肪变,使得血中游离脂肪酸增多;后者可干扰胰岛素信号途径,从而进一步加重胰岛素抵抗[10]。有研究报道,胰岛素抵抗可降低血液中NO合酶活性、减少NO含量并抑制胰岛素诱导的血管舒张反应,最终导致血管内皮功能障碍[11]。张顺杰等研究也表明,NAFLD患者的血流介导的内皮依赖性舒张功能和内皮素水平均明显降低,两者均与胰岛素抵抗指数呈负相关[12]。另一方面,炎症因素在NAFLD的发生发展中也起到重要作用。NAFLD常伴肠源性内毒血症,可激活NF-κB信号途径引起IL-6、CRP、TNF-α等炎症因子释放并促进血管炎症反应,同时加剧胰岛素抵抗[13]。血管炎症反应已被证实与CCC的形成有关[14],而本研究也发现hs-CRP可影响CCC的形成。此外,有学者指出NAFLD患者的血管内皮生长因子水平低于健康人群[15],这也可能是导致CCC生成不良的因素。
除了NAFLD和hs-CRP外,本研究中Gensini积分和右冠状动脉病变也是CCC形成的影响因素,这些结果与既往报道一致[16,17]。Gensini积分能准确评价冠状动脉的狭窄程度,后者是影响CCC生成的公认因素[17]。右冠状动脉严重狭窄后其CCC通常起源于前降支或回旋支。心脏收缩时右冠状动脉驱动压较高而右室壁张力较低,与这两支冠状动脉间更易产生压力阶差促进CCC生成[18]。在关注以上这些CCC影响因素的同时,也需考虑到本研究的以下缺点:①研究采用横断面设计,不能明确NAFLD与CCC之间的因果关系;②采用Rentrop分级标准只能定性评价CCC,不能反映其功能;③因所有资料均为回顾性分析,未能检测患者的胰岛素抵抗指数,无法探究该指标与CCC生成的相关性。
综上所述,NAFLD与冠状动脉严重狭窄患者CCC形成不良密切相关,且是影响CCC的一个重要因素。因此,早期积极识别并干预NAFLD可能是改善患者CCC的有效方法,但该推论尚需更多临床研究来进一步证实。
参 考 文 献
[1]Zimarino M,D'Andreamatteo M,Waksman R,et al. The dynamics of the coronary collateral circulation[J]. Nat Rev Cardiol,2014,11(4):191-7.
[2]Seiler C,Stoller M,Pitt B,et al. The human coronary collateral circulation: development and clinical importance[J]. Eur Heart J,2013,34(34):2674-82.
[3]Kurtul A,Duran M. The correlation between lymphocyte/monocyte ratio and coronary collateral circulation in stable coronary artery disease patients[J]. Biomark Med,2017,11(1):43-52.
[4]常学伟,邱春光,张守彦,等. 葡萄糖耐量受损患者胰岛素抵抗与冠状动脉侧支循环的相关性研究[J]. 中国循环杂志,2016,31(9):854-7.
[5]中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010年修订版)[J]. 中华肝脏病杂志,2010,18(3):163-6.
[6]Gensini GG. A more meaningful scoring system for determining the severity of coronary heart disease[J]. Am J Cardiol,1983,51(3):606.
[7]Younossi ZM,Koenig AB,Abdelatif D,et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology,2016,64(1):73-84.
[8]Ballestri S,Lonardo A,Bonapace S,et al. Risk of cardiovascular,cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease [J]. World J Gastroenterol,2014,20(7):1724-45.
[9]胡晟,潘庆华,瞿兵,等. 非酒精性脂肪性肝病与PCI术后支架内再狭窄的相关性研究[J]. 中国循证心血管医学杂志,2017,9(7):828-30.
[10]Berk PD,Verna EC. Nonalcoholic fatty liver disease: lipids and insulin resistance[J]. Clin Liver Dis,2016,20(2):245-62.
[11]Persico M,Masarone M,Damato A,et al. Non alcoholic fatty liver disease and eNOS dysfunction in humans[J]. BMC Gastroenterol,2017,17(1):35.
[12]张顺杰,苏敏,蒙钊,等. 非酒精性脂肪性肝病患者炎症因子及内皮功能变化及意义[J]. 中华实用诊断与治疗杂志,2015,29(1):245-62.
[13]Kirpich IA,Marsano LS,McClain CJ. Gut-liver axis, nutrition,and non-alcoholic fatty liver disease[J]. Clin Biochem,2015,48(13-14):923-30.
[14]Imhof BA,Aurrand-Lions M. Angiogenesis and inflammation face off[J]. Nat Med,2006,12:171-2.
[15]Papageorgiou MV,Hadziyannis E,Tiniakos D,et al. Serum levels of vascular endothelial growth factor in non-alcoholic fatty liver disease[J]. Ann Gastroenterol,2017,30(2):209-16.
[16]Sogut E,Kadi H,Karayakali M,et al. The association of plasma vitamin A and E levels with coronary collateral circulation[J]. Atherosclerosis,2015,239(2):547-51.
[17]Meier P,Schirmer SH,Lansky AJ,et al. The collateral circulation of the heart[J]. BMC Med,2013,11:143.
[18]张洪,杨旭明,周华顶. 影响冠状动脉侧支循环形成的因素分析[J]. 心血管康复医学杂,2016,25(4):364-7.

