冠心病合并糖尿病患者PCI术后TLR3、TLR4、IL-10、TNF-α的表达变化及意义
吴军,文亚红,唐永江
冠状动脉粥样硬化性心脏病(冠心病,CAD)是由于冠状动脉血管发生粥状硬化引起心肌缺血或坏死的一类心脏疾病,其中先天性炎症反应在冠心病发展中发挥着重要作用[1]。经皮冠状动脉介入治疗(PCI)是目前临床治疗冠心病主要策略之一[2]。临床发现糖尿病能增加PCI术不良并发症的发生率,诱发心肌梗死[3],其机制尚不清楚。Toll样受体(TLRs)是最常见的先天性免疫受体,其介导的信号传导可诱导免疫细胞活化,产生分泌多种炎症相关因子,如白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)等,参与冠心病、糖尿病等多种疾病发生发展过程[4]。本研究通过检测TLR3、TLR4、IL-10、TNF-α在糖尿病、非糖尿病冠心病患者PCI后表达水平,探讨它们与冠心病合并糖尿病患者术后不良事件发生率的相关性,试图揭示冠心病合并糖尿病患者发生不良心脏事件的原因。
1 资料与方法
1.1 研究对象 选取2014年3月~2017年1月于攀枝花市中心医院心内科收治的稳定型冠心病患者90例根据是否合并2型糖尿病(T2DM)分为糖尿病组(T2DM组)39例、非糖尿病组(非T2DM组)51例。所有患者均经冠状动脉造影确定冠状动脉狭窄并成功行PCI术。T2DM组男性22例,女性17例;平均年龄(60.5±3.1)岁;平均病程(1.6±1.1)年。非T2DM组男性29例,女性22例,平均年龄(61.9±2.7)岁;平均病程(1.8±0.9)年。两组患者的性别、年龄及病程等一般资料差异无统计学意义(P>0.05)。
纳入标准:①稳定型心绞痛:以发作性胸骨后疼痛为特点,发作特征1~3月内无改变,每日及每周发作次数大致相同,诱导发作的情绪和劳累程度无差别,每次发作时疼痛性质及发作部位无改变。②T2DM:参照2013年中华医学会糖尿病学分会修订的中国2型糖尿病防治指南[5],空腹血糖(FPG)≥7.0 mmol/L及(或)75 g 口服葡萄糖耐量试验(OGTT)后2 h血糖值≥11.1 mmol/L并排除1型糖尿病,即诊断为T2DM。③支架植入术指征:参照2014年SCAI/ACC/AHA修订[6]的PCI治疗标准:冠状动脉直径狭窄≥90%;狭窄<90%,有相应缺血证据,或血流储备分数(FFR)≤0.8,排除支架植入禁忌症者。排除标准:合并其他心脏病;不稳定型心绞痛;既往有PCI术史;肾、肝功能异常;合并出血性疾病,不耐受长期抗血小板治疗;合并免疫系统、血液系统、肿瘤、感染等疾病。本研究经医院道德伦理委员会批准通过,且临床标本采集符合《世界医学协会赫尔辛基宣言》。
1.2 标本采集及保存 分别在PCI术前、术后24 h、术后7 d、术后30 d采集各组患者肘静脉血(5 ml/人),置于EDTA抗凝管中,采用Ficoll密度梯度离心法分离外周血,收集单个核细胞(PBMC)和血清,于-70℃保存,冷藏保存。
1.3 方法
1.3.1 qRT-PCR检测TLR3、TLR4 mRNA表达情况 Trizol法提取PBMC总RNA,反转录合成cDNA。以cDNA为模板在Bio-Rad定量PCR仪中进行扩增反应。引物序列见表1。qRT-PCR反应总体系10 μl,具体如下:正反向引物(10 μmol/L)各0.3 μl,SYBR® Green Master Mix 5 μl,cDNA(100 ng/μl)0.5 μl,RNase-free H2O 3.9 μl。反应条件:95℃,60s;95℃,15s;60℃,30s;72℃,15s;40个循环。采用2-△△CT法对扩增结果进行分析。每个样品进行三次生物学重复。

表1 qRT-PCR引物序列
1.3.2 Western blot检测TLR3、TLR4蛋白表达 采用BCA试剂盒测定血清中蛋白总量。以β-actin作为内参,严格按照Western blot操作说明,检测患者血清中TLR3、TLR4蛋白表达水平。采用Tanon软件采集图像并对蛋白表达水平进行半定量分析。
1.3.3 ELISA检测血清中IL-10、TNF-α含量 采用ELISA试剂盒严格按照操作说明检测患者血清中IL-10、TNF-α含量。
1.3.4 临床随访 所有患者均成功行PCI,术后依据病情给予他汀类等药物治疗。术后1年内接受复检随访,记录主要心脏不良事件,包括死亡、心绞痛、心肌梗死。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析,计数数据采用百分比表示,组间比较采用卡方检验,计量数据采用均数±标准差表示,组间比较采用t检验。影响PCI后心脏不良事件的因素采用多因素logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者PCI前、后一般情况 T2DM组术前吸烟率、高血脂率、高血压率、左室射血分数(LVEF)及冠心病预防药物使用率与非T2DM组比较,差异无统计学意义;术后30 d,两组患者低密度脂蛋白[(3.55±0.73)mmol/Lvs.(3.07±0.96)mmol/L]及血糖值[(9.16±2.65)mmol/Lvs.(7.23±2.25)mmol/L)]比较差异有统计学意义(P=0.011、0.000),见表2。
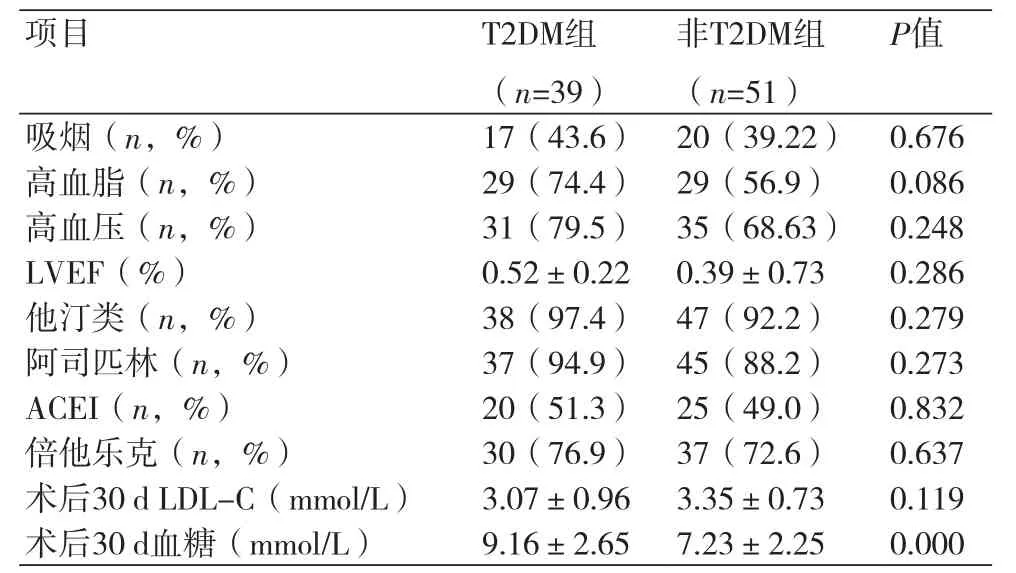
表2 两组患者PCI术前一般情况比较
2.2 两组患者冠状动脉病变情况比较 与非T2DM组相比,T2DM组患者3支病变率较高(25.6%vs.9.8%),差异有统计学意义(P=0.046)。两组患者1支、2支病变率及病变发生部位方面比较,差异无统计学意义(P>0.05),见表3。
2.3 两组患者外周血中TLR3、TLR4 mRNA相对表达比较 PCI前、后24 h、7 d、30 d比较,T2DM组患者TLR3mRNA相对表达水平均低于非T2DM组,差异有统计学意义[(1.13±0.64vs. 1.37±0.29)、(1.69±0.67vs. 1.89±0.21)、(1.96±0.16vs. 2.07±0.13)、(2.39±0.53vs. 3.15±0.76),P<0.05],TLR4mRNA水平明显高于非T2DM组,差异有统计学意义(1.41±0.56vs. 1.17±0.72)、(1.21±0.27vs. 0.89±0.25)、(0.87±0.75vs. 0.61±0.39)、(0.61±0.15vs. 0.47±0.26),P<0.05);行PCI术后,两组患者TLR3mRNA相对表达水平均随着术后时间的延长呈增高趋势,差异有统计学意义(P<0.05)、TLR4mRNA相对表达水平均呈降低趋势,差异有统计学意义(P<0.05),见表4。
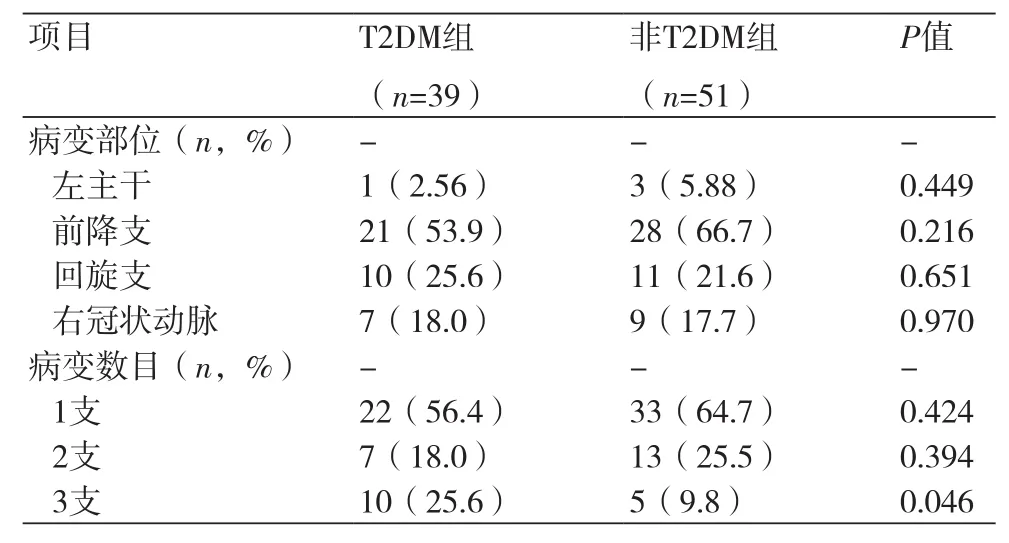
表3 两组患者冠状动脉病变情况比较
2.4 两组患者外周血中TLR3、TLR4蛋白表达比较 PCI前、后24 h、7 d、30 d比较,T2DM组患者TLR3蛋白表达水平低于非T2DM组,差异有统计学意义[(0.97±0.17vs. 1.15±0.29)、(1.38±0.15vs. 1.74±0.32)、(1.82±0.16vs.2.07±0.19)、(2.19±0.41vs. 2.65±0.78),P<0.05],TLR4蛋白表达水平高于非T2DM组,差异有统计学意义[(1.51±0.25vs. 1.27±0.39)(1.38±0.27vs. 1.06±0.15)、(0.98±0.46vs.0.69±0.39)、(0.72±0.15vs. 0.48±0.31),P<0.05];行PCI术后,两组患者TLR3蛋白表达水平均随着术后时间的延长呈增高趋势(P<0.05)、TLR4蛋白表达水平均呈降低的趋势(P<0.05),见表5。
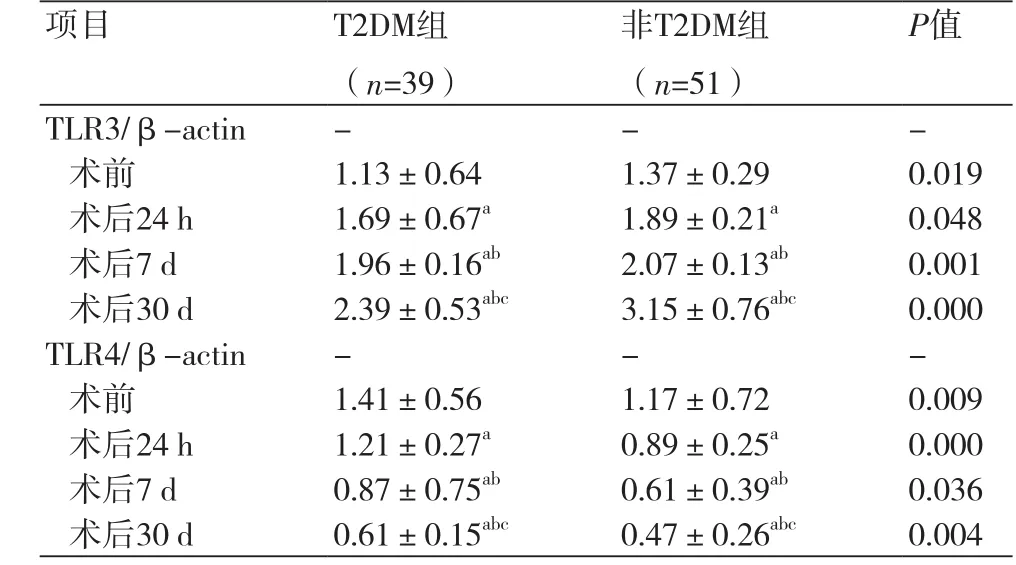
表4 两组患者PCI术前、术后TLR3、TLR4 mRNA水平比较
2.5 两组患者外周血IL-10、TNF-α含量比较PCI前、后24 h、7 d、30 d比较,T2DM组患者外周血中IL-10水平低于非T2DM组,差异有统计学意义[(70.59±13.18vs. 80.64±14.15)pg/ml、(90.92±10.95vs. 98.76±9.87)pg/ml、(127.68±14.09vs. 136.94±13.16)pg/ml、(210.53±11.10vs. 231.48±13.21)pg/ml,P<0.05],TNF-α水平高于非T2DM组,差异有统计学意义[(41.23±5.94vs. 38.67±5.92)pg/ml、(32.19±4.97vs. 29.51±5.31)pg/ml、(19.65±3.59vs.17.19±3.58)pg/ml、(12.21±2.54vs. 10.48±3.11)pg/ml,P<0.05];行PCI后,两组患者外周血IL-10水平均随着术后时间的延长呈增高趋势(P<0.05)、TNF-α水平均呈降低的趋势(P<0.05),见表6。
2.6 两组患者术后主要不良心脏事件比较 两组患者术后1年随访结果显示,与非T2DM组比较,T2DM组患者Q波心肌梗死、非Q波心肌梗死、心绞痛、死亡等不良心脏事件的发生概率高,但差异无统计学意义(P>0.05)。T2DM组不良心脏事件总发生率28.21%高于非T2DM组9.80%,差异有统计学意义(P=0.024),见表7。
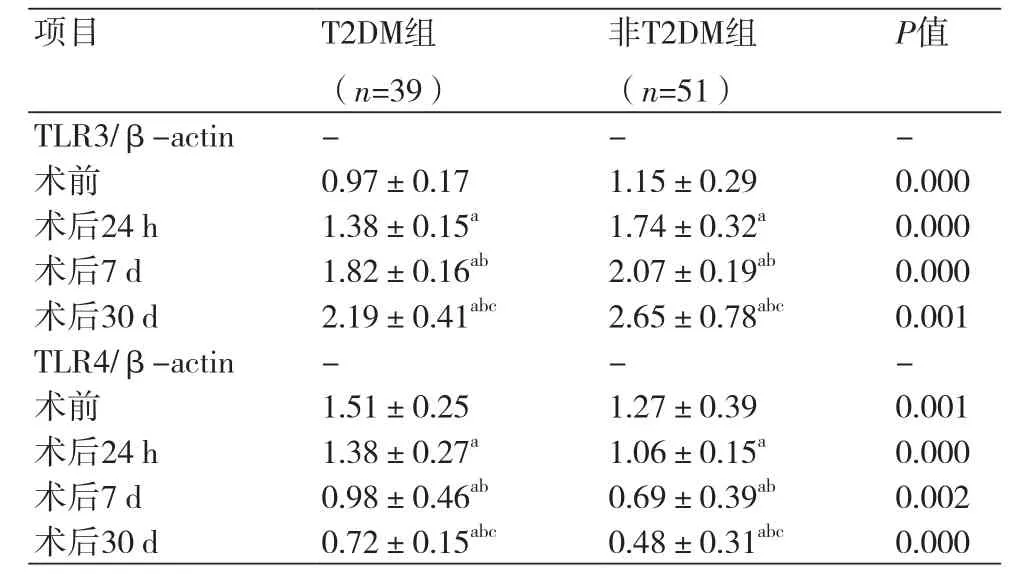
表5 两组患者PCI术前、术后TLR3、TLR4 mRNA水平比较
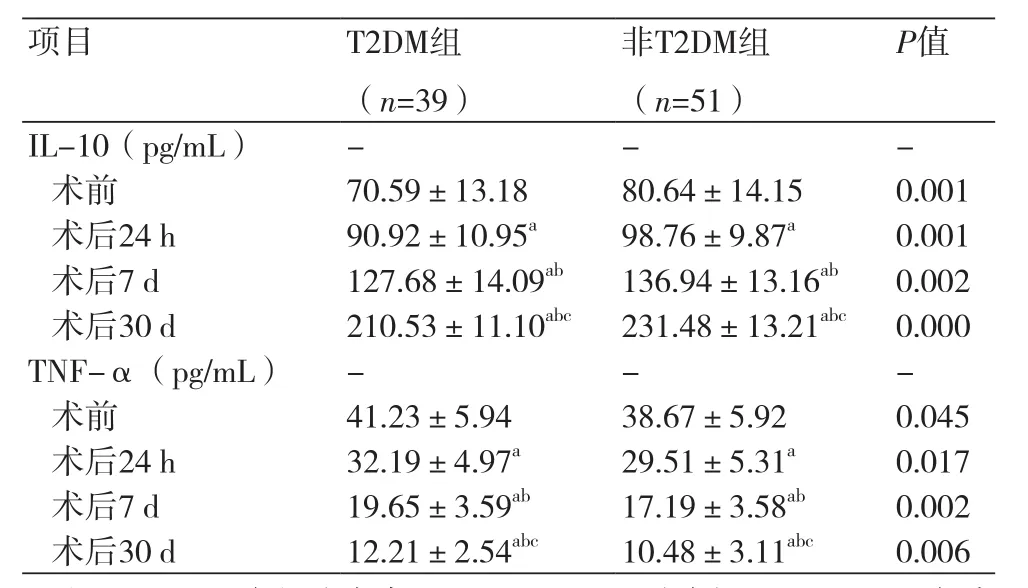
表6 两组患者PCI术前、术后外周血中IL-10、TNF-α水平比较
2.7 影响PCI术后主要不良心脏事件的因素分析 将PCI术后不良心脏事件(有=1,无=0)作为因变量,将血糖值,病变程度、病变数目,血脂及外周血IL-10、TNF-α、TLR3、TLR4蛋白水平作为自变量进行多因素Logistics回归分析显示,血糖(OR=2.645,95%CI:1.726~3.694;P=0.035)、病变数目(OR=3.421,95%CI:1.358~4.489;P=0.016)及IL-10(OR=2.854,95%CI:1.863~3.967;P=0.017)、TLR3(OR=3.682,95%CI:2.362~6.951;P=0.031)、TLR4(OR=4.157,95%CI:2.638~10.417;P=0.001)是影响PCI术后不良心脏事件的独立危险因素。
3 讨论
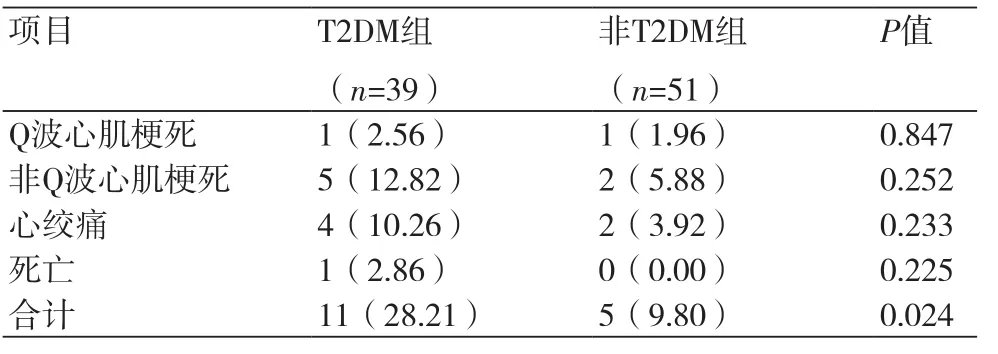
表7 两组患者术后主要不良心脏事件比较(n,%)
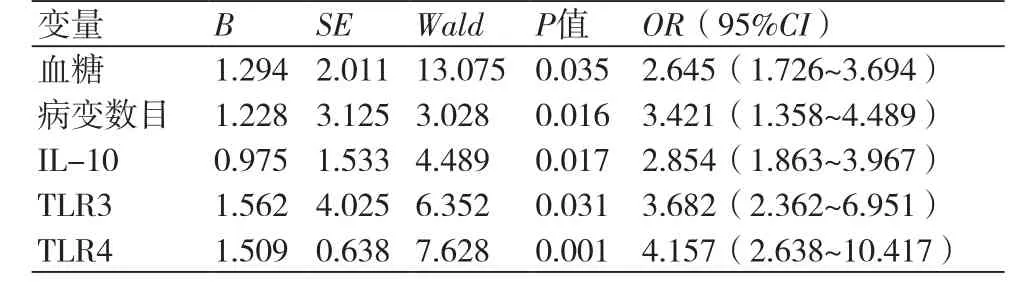
表8 影响PCI术后不良心脏事件的因素分析
近年来,我国心脑血管疾病发病率快速增加,冠心病因其高致残率、高死亡率、高复发率严重影响我国公民的身体健康和生命安全,给家庭和社会造成沉重的精神和经济负担[7]。糖尿病能促进心血管发生炎症反应,是冠心病的危重症[8]。研究发现炎症反应可能是导致冠心病患者PCI后发生不良心脏事件的重要原因[9]。本研究通过检测冠心病合并糖尿病患者PCI术后TLR3、TLR4、IL-10、TNF-α的水平及变化,同时探讨它们与PCI后不良心脏事件发生的相关性。
Toll样受体在树突状细胞、白细胞、T淋巴细胞、B淋巴细胞等细胞表面表达,作为先天免疫受体和模式识别受体识别[10]。一些TLR,如TLR4与炎症反应密切相关,参与冠心病、糖尿病等多种炎症疾病的发生、发展[11,12]。大量研究证明TLR4可作为CAD的治疗靶点[13,14]。Jialal等[15]发现,T1DM和T2DM患者中TLR2、TLR4表达水平明显上调,其下游炎症因子TNF-α,IL-1β,IL-6,单核细胞趋化蛋白-1和1型干扰素活性也明显上调,推测TLR2、TLR4能通过促进血管中炎症反应促进糖尿病并发症的发生。Cole等[16]发现,TLR3的基因缺失加速高胆固醇ApoE(-/-)小鼠动脉粥样硬化的发生,推测TLR3具有保护血管作用。Shao等[17]发现,冠状动脉粥样硬化患者外周血中TLR3表达水平显著下调,TLR4表达水平明显上调,推测TLR3作为抗炎症因子,TLR4作为促炎症因子共同参与CAD发生、发展过程。本研究发现PCI前、后同一时间点,T2DM组患者TLR3表达水平低于非T2DM组患者,TLR4表达水平高于非T2DM组患者。行PCI后,两组患者TLR3表达水平呈增高趋势,TLR4表达水平呈降低趋势,提示TLR3和TLR4在动脉疾病发生过程中发挥着相反的作用,合并糖尿病能影响患者PCI术后外周血中TLR3、TLR4表达水平。
白细胞介素是一种细胞因子,参与调节免疫细胞的活化、增殖、分化,参与炎症反应[18]。肿瘤坏死因子是一种能够直接杀死肿瘤细胞,具有较强免疫活性的细胞因子[19]。IL、TNF作为TLR3、TLR4信号途径的下游因子,参与调节血管中炎症反应,调节冠心病、糖尿病等炎症疾病的发生[20]。研究发现[21-23]IL-1、IL-6、IL-10和TNF-α的基因多样性与T2DM的发生密切相关。Dopheide等[24]发现,IL-10/ TNF-α比值较低的CAD患者左心室射血分数较低,十年内不良心脏事件发生率较高,推测IL-10、TNFα不平衡可能与动脉粥样硬化和心力衰竭等病理过程相关。Shao等[25]发现,PCI后冠心病患者TLR3及其下游炎症因子IL-10、INF-β、IRF-3表达水平显著下调,TLR4及其下游炎症因子MyD88、TNF-α表达水平明显上调,推测TLR3、TLR4诱导的IL-10、TNF-α等炎症因子失调是影响PCI术预后的因素之一。本研究发现PCI术前、术后,T2DM组患者IL-10水平低于非T2DM组,TNF-α水平高于非T2DM组。提示合并糖尿病可能导致冠心病患者外周血中IL-10含量降低,TNF-α含量增加。两组患者术后1年随访结果显示,T2DM组不良心脏事件总发生率高于非T2DM组。提示合并糖尿病可能影响冠心病患者PCI预后情况。多因素logistic回归分析显示,影响PCI术后不良心脏事件的因素有血糖、病变数目及IL-10、TLR3、TLR4,表明糖尿病,TLR3、IL-10、TLR4是影响冠心病合并糖尿病患者PCI术预后的因素。
综上所述,TLR4、TNF-α在冠心病合并糖尿病患者外周血中高表达,TLR3、IL-10低表达,T2DM组不良心脏事件总发生率高于非T2DM组,TLR3、IL-10、TLR4、TNF-α可能影响冠心病合并糖尿病患者PCI术预后,但是由于本研究为回顾性分析,纳入样本量较少,随访时间较短,影响冠心病合并糖尿PCI术预后的具体机制较多,因此还需要大样本、前瞻性、多方面的深入研究。
参 考 文 献
[1]Galkina E,Ley K. Immune and inflammatory mechanisms of atherosclerosis[J]. Annual Review of Immunology,2014,27(1):165-97.
[2]中华医学会心血管病学分会介入心脏病学组. 中国经皮冠状动脉介入治疗指南(2016)[J]. 中华心血管病杂志,2016,44(5):382-400.
[3]Ross S,Gerstein HC,Eikelboom J,et al. Mendelian randomization analysis supports the causal role of dysglycaemia and diabetes in the risk of coronary artery disease[J]. European Heart Journal,2015,36(23):1454-62.
[4]高东,王晓冬,靳广毅,等. Toll样受体与配体复合物结构的研究进展[J]. 细胞与分子免疫学杂志,2015,31(4):553-6.
[5]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华内分泌代谢杂志,2014,30(10):26-89.
[6]Dehmer GJ,Blankenship JC,Cilingiroglu M,et al. SCAI/ACC/AHA Expert Consensus Document: 2014 Update on Percutaneous Coronary Intervention Without On-Site Surgical Backup[J]. Catheter Cardiovas cInterv,2014,63(23):2624-41.
[7]何晓全,刘梅林. 中国冠心病防治策略[J]. 中国全科医学,2015,18(2):239-40.
[8]肖彬,郭静芸,朱翔,等. 联合运动负荷心电图及12导联动态心电图对糖尿病合并冠心病的诊断价值[J]. 中华急诊医学杂志,2013,22(11):1290-3.
[9]陈娟,陈刚,周逸,等. 稳定性心绞痛患者冠状动脉支架术中的炎症反应及意义[J]. 临床心血管病杂志,2012,28(6):416-8.
[10]Di GM,Zanoni I. Toll-like receptor co-receptors as master regulators of the immune response[J]. Molecular Immunology,2015,63(2):143-52.
[11]Katoh S,Honda S,Watanabe T,et al. Atrial endothelial impairment through Toll-like receptor 4 signaling causes atrial thrombogenesis[J].Heart & Vessels,2014,29(2):263-72.
[12]Jiang ZS,Wang SX,Jia HX,et al. Association of toll-like receptor 4 polymorphisms with type 2 diabetes mellitus[J]. Inflammation,2013,36(1):251-7.
[13]张源,黎玲伊,陈洁,等. 急性冠状动脉综合征患者外周血单个核细胞TLR4和TNF-α的变化及其临床意义[J]. 中国动脉硬化杂志,2017,25(5):480-4.
[14]Jia SJ,Niu PP,Cong JZ,et al. TLR4 signaling: a potential therapeutic target in ischemic coronary artery disease[J]. International Immunopharmacology, 2014, 23(1):54-9.
[15]Jialal I, Kaur H. The Role of Toll-Like Receptors in Diabetes-Induced Inflammation: Implications for Vascular Complications[J].CurrDiab Rep, 2012, 12(2):172-9.
[16]Cole JE,Navin TJ,Cross AJ,et al. Unexpected protective role for Toll-like receptor 3 in the arterial wall[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(6):2372-7.
[17]Shao L,Zhang P,Zhang Y,et al. TLR3 and TLR4 as potential clinically biomarkers of cardiovascular risk in coronary artery disease (CAD)patients[J]. Heart & Vessels,2014,29(5):690-8.
[18]彭笑,顾嘉杰,顾贤波,等. 白细胞介素36及其在炎症性疾病中的作用[J]. 中国药理学与毒理学杂志,2015,29(2):317-22.
[19]李影,陈镜宇,张玲玲,等. 肿瘤坏死因子受体相关因子参与炎症免疫调节的研究进展[J]. 中国药理学通报,2015,31(9):1206-11.
[20]Herder C,Carstensen M,Ouwens DM. Anti-inflammatory cytokines and risk of type 2 diabetes[J]. Diabetes ObesMetab,2013,15(s3):39-50.
[21]Saxena M,Srivastava N,Banerjee M. Association of IL-6, TNF-α and IL-10 gene polymorphisms with type 2 diabetes mellitus[J].Molecular Biology Reports,2013,40(11):6271-9.
[22]Bai H,Jing D,Guo A,et al. Association between interleukin 10 gene polymorphisms and risk of type 2 diabetes mellitus in a Chinese population[J]. Journal of International Medical Research,2014,42(3):326-31.
[23]Banerjee M,Saxena M. Interleukin-1 (IL-1) family of cytokines:Role in Type 2 Diabetes[J]. Clinicachimicaacta,2012,413(15-16):1163-70.
[24]Dopheide JF,Knopf P,Zeller GC,et al. Low IL-10/TNF-α Ratio in Patients with Coronary Artery Disease and Reduced Left Ventricular Ejection Fraction with a Poor Prognosis After 10 Years[J].Inflammation, 2015, 38(2):911-22.
[25]Shao L,Zhang P,Zhang Y,et al. Inflammatory unbalance of TLR3 and TLR4 in PCI patients with or without type 2 diabetes mellitus.[J].Immunology Letters,2014,161(1):81-8.

