大目金枪鱼皮明胶的理化性质及结构分析
韩 霜,马 良,杨 晖,黄丹丹,张宇昊,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 国家食品科学与工程实验教学中心,重庆 400715)
明胶来源于动物皮、筋、骨骼中的胶原蛋白质,是胶原蛋白质部分水解的产物。由于其具有诸多优良的物理化学性质,如可形成可逆性凝胶、流变性、表面活性等常被作为胶凝剂、稳定剂、乳化剂和澄清剂,广泛应用于食品工业中[1]。目前,大部分明胶来源于牛皮、猪皮与牛骨等,水产明胶作为明胶来源之一,仅在小规模生产与应用[2]。但随着疯牛病、口蹄疫等疾病的爆发,及一些宗教的限制,鱼明胶作为哺乳明胶的潜在替代品,受到了越来越多的关注,且需求量逐渐增加[3]。
渔场等水产养殖业中的废弃物主要有鱼皮、鱼骨、鱼鳞、鱼鳍等,这些副产物都可以作为原料经过一定条件的预处理后加工制备成水产明胶。已有许多关于水产明胶的报道,所涉及的品种非常广泛,包括阿拉斯加鳕鱼[4]、太平洋鳕鱼[5]、绿青鳕[6]、三文鱼[7]等冷水鱼,及罗非鱼[8]、草鱼[9]、鱿鱼[10]、金枪鱼[11]等温水鱼。总体来说,同哺乳动物明胶相比,水产明胶的凝胶特性较差[12]。尤其是冷水鱼明胶很难完全替代哺乳动物明胶使用,原因在于其亚氨基酸质量分数(约17%)远低于哺乳动物明胶。而温水鱼明胶中亚氨基酸质量分数(22%~25%)与哺乳动物明胶亚氨基酸(30%左右)相近,明胶凝胶特性也更为接近,因此温水鱼明胶更适合作为哺乳动物明胶的替代品被深入开发。
金枪鱼又名鲔鱼、吞拿鱼,广泛分布于太平洋、大西洋、印度洋的热带、亚热带和温带广阔水域,属于大洋暖水性洄游鱼类。金枪鱼肉脂肪低、热量低,含有丰富的氨基酸,同时还含有大量的二十二碳六烯酸和二十碳五烯酸,因而备受推崇。作为加工副产物,金枪鱼皮富含胶原蛋白,是制备明胶的良好原材料。目前,对于黄鳍金枪鱼皮明胶的制备及性质方面已经有一些报道。Cho等[11]最先以黄鳍金枪鱼皮为原料提取明胶,优化提取工艺,并研究所得明胶的凝胶强度、胶凝温度与熔化温度和动态黏弹性等。Han Yuna等[13]通过研究黄鳍金枪鱼皮明胶酶水解产物的生物活性发现,黄鳍金枪鱼皮明胶及其水解产物具有较强的抗氧化性,可以用作具有强效抗氧化、抗癌和抗高血压的功能性食品或药物成分。除黄鳍金枪鱼外,大目金枪鱼也是金枪鱼常见品种之一,资源十分丰富。仅2013年,整个太平洋海域的大目金枪鱼产量就达到26.0×104t,占当年三大洋总捕捞量的59.8%[14],且其产量仍然呈上升趋势。但目前对于大目金枪鱼皮明胶方面的研究鲜见报道。
因此本实验以大目金枪鱼皮为原料提取明胶,分析所制备明胶的理化性质和结构特性,包括凝胶强度、氨基酸组成、紫外和红外光谱特征、分子质量分布等,并与猪皮明胶进行对比,旨在为合理利用大目金枪鱼皮资源及寻找更好的哺乳动物明胶替代品提供理论依据。
1 材料与方法
1.1 材料与试剂
大目金枪鱼皮 山东中鲁远洋(烟台)食品有限公司(捕捞海域:太平洋FAO 77海域);猪皮明胶(货号V900863,胶凝强度300 g) 美国Sigma公司;羟脯氨酸 上海楷洋生物技术有限公司;硫酸、盐酸、氢氧化钠、三水·N-对甲苯磺酰胺钠盐(氯胺T)、高氯酸、异丙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 成都市科龙化工试剂厂;对二甲氨基苯甲醛天津市科密欧化学试剂有限公司;Tris、过硫酸铵、β-巯基乙醇、四甲基乙二胺、R-250考马斯亮蓝、甘氨酸(Gly)、溴酚蓝(bromophenol blue,BPB) 生工生物工程(上海)股份有限公司;丙烯酰胺(质量分数为30%) 北京索莱宝科技有限公司;标准蛋白(分子质量10~200 kDa) 加拿大Fermentas公司;Tris、R-250考马斯亮蓝、30%丙烯酰胺为优级纯,其他试剂均为分析纯。
1.2 仪器与设备
JA3003B型电子天平 上海精天电子仪器有限公司;PHS-25型数显酸度计 杭州雷磁分析仪器厂;8002型温控水浴锅 北京永光明医疗仪器厂;101-4-S型电热恒温鼓风干燥箱 上海跃进医疗器械厂;HX-1005型恒温循环器 郑州长城科工贸有限公司;CT3型质构仪美国博勒飞公司;752型紫外-可见光分光光度计 上海菁华科技仪器有限公司;DHR-1型流变仪 美国TA公司;Power PacTM基础电泳仪 美国Bio-Rad公司;G:BOX EF凝胶成像系统 英国Syngene公司;Spectrun100型红外光谱仪 美国PerkinElmer公司。
1.3 方法
1.3.1 金枪鱼皮明胶的制备
明胶的制备参照Karayannakidis等[4]的方法并略作调整。鱼皮经去鳞、去骨洗净后,剪碎、漂洗沥干,以SDS超声脱脂2 h,水洗后,以0.8%氢氧化钠溶液处理1 h,每30 min换一次液,水洗,以2.2%乙酸溶液处理2 h。水洗至pH值至4.5左右,在55 ℃条件下提胶6 h,滤除皮渣后,抽滤,60 ℃烘干24 h,得到明胶成品。
1.3.2 明胶凝胶强度的测定
参照GB 6783—2013《食品添加剂 明胶》中凝胶强度的测定方法,配制质量分数为6.67%的明胶溶液,并在(10±0.1)℃恒温循环器中放置16~18 h,采用CT-3质构仪测定凝胶强度。选用TA5圆柱型探头,下压速率1 mm/s,下压距离4 mm,测定明胶多个不同位置的凝胶强度,得出凝胶强度数值,计算平均值,结果取整数。
1.3.3 明胶的胶凝温度和熔化温度的测定
采用DHR-1流变仪测定质量分数为6.67%明胶溶液的胶凝温度和熔化温度。设定温度变化速率为1 ℃/min,应变1%,测试夹具40 mm Al平板,Peltier温度控制系统,板间距为0.5 mm,温度扫描由40 ℃冷却到5 ℃,在5 ℃保持10 min,然后由5 ℃加热到40 ℃,记录储能模量G’和损耗模量G”随温度扫描的变化曲线。
1.3.4 明胶的氨基酸组成分析
参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量的测定》中的方法测定羟脯氨酸含量,用全自动氨基酸分析仪测定其他氨基酸组成及含量,具体分析方法:称取20 mg样品于18 mm×180 mm试管中,加入5 mL 6 mol/L盐酸,振荡混匀。用酒精喷灯把该试管口下1/3处拉细到4~6 mm,抽真空后封管。处理过的试管置(110±1)℃恒温烘箱中沙浴水解22 h,拿出冷却至室温,摇匀过滤,取1 mL滤液于50 mL烧杯中,60 ℃恒温水浴蒸干滤液,加入0.02 mol/L盐酸稀释3 倍,用0.22 μm滤膜过滤上机。一个样品分析周期53 min。分析仪采用2 个泵和2 根柱。即洗脱液经泵1流过分离柱,泵压12.260 MPa,流速0.45 mL/min,柱温70 ℃;茚三酮经泵2流过反应柱,泵压0.780 MPa,流速0.35 mL/min,反应柱(4.6 mm×60 mm)柱温135 ℃。
1.3.5 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
采用SDS-PAGE分析明胶的亚基组成和分子质量分布。SDS-PAGE条件:质量分数6%的分离胶,质量分数5%的浓缩胶;10×Tris-Gly缓冲液(含0.25 mol/L Tris、1.92 mol/L Gly、10 g/L SDS,稀释10 倍作内槽电泳液);5×样品缓冲液(含250 mmol/L Tris-HCl(pH 6.8)、0.1 g/mL SDS、5 mg/mL BPB、体积分数50%甘油、体积分数5% β-巯基乙醇);考马斯亮蓝R-250染色液(含1 g/L考马斯亮蓝R-250、体积分数25%异丙醇、体积分数1%冰乙酸);考马斯亮蓝脱色液(含体积分数1%冰乙酸、体积分数0.05%乙醇)。配制1 mg/mL的明胶溶液,按体积比4∶1添加5×样品缓冲液,沸水浴5 min,冷却后上样,上样量为15 μL(Marker上样量为10 μL)。15 mA恒流电泳,待溴酚蓝跑到分离胶中后,电流调至25 mA,电泳时间约1.5 h。考马斯亮蓝染色2 h后用脱色液脱色,多次更换脱色液直至背景脱净,然后用凝胶成像系统拍摄电泳图谱,用Gene Tools(Syngene,Cambridge,UK)软件分析图谱。
1.3.6 紫外光谱扫描
配制质量浓度为1.0 mg/mL的明胶溶液,在190~400 nm波长范围内用紫外分光光度计进行紫外吸收光谱扫描,以去离子水为空白对照。
1.3.7 红外光谱扫描
1 mg干明胶加100 mg KBr混合均匀,研成粉末,烘干后压片,用红外光谱仪扫描400~4 000 cm-1的吸收光谱,扫描次数32 次,分辨率4 cm-1。
1.4 数据处理
采用Microsoft Excel 2010和SPSS 17.0进行数据处理,并用Origin 8.6软件作图。
2 结果与分析
2.1 凝胶强度
本实验制备的金枪鱼皮明胶凝胶强度为403 g,稍低于猪皮明胶(426 g)。影响明胶凝胶强度的因素有明胶的氨基酸组成和分子质量分布。明胶中亚氨基酸含量越高,亚基组分含量越高,明胶的凝胶强度越高。通常情况下,水产明胶的亚氨基酸含量低于哺乳动物明胶,故凝胶强度与之相比也稍低[16-17]。本实验制备的金枪鱼皮明胶与猪皮明胶的凝胶强度相近,高于一些报道的水产明胶[18](如尼罗罗非鱼皮明胶凝胶强度为328 g[19],三文鱼皮明胶凝胶强度为108 g,鳕鱼皮明胶凝胶强度为71 g[20]),可能是由于属于温水鱼的金枪鱼皮明胶中亚氨基酸含量与哺乳动物明胶较为接近,因而其凝胶强度与哺乳动物明胶相差不大。
2.2 胶凝温度和熔化温度
使用DHR-1流变仪测定金枪鱼皮明胶和猪皮明胶的胶凝温度和熔化温度,温度扫描分为3 个阶段:降温、恒温和升温过程。明胶具有一定的黏弹性,储能模量(G’)和损耗模量(G”)分别代表它的弹性部分和黏性部分,通常情况下,用降温和升温过程中储能模量和损耗模量的交点代表明胶的胶凝温度和熔化温度。
由图1可知,本实验制备的金枪鱼皮明胶的胶凝温度和熔化温度分别为21.5 ℃和28.8 ℃,低于猪皮明胶的胶凝温度和熔化温度(25.3 ℃和33.4 ℃)。与凝胶强度类似,明胶的胶凝温度和熔化温度同样与明胶亚氨基酸含量与分子质量有关[10],故大目金枪鱼皮明胶胶凝温度和熔化温度也较低。与凝胶强度相同,但与熔点更高的猪皮明胶相比,此类明胶更适合在甜品制作中使用,因为其既不会因为熔化温度过低而在储运过程中熔化,也可在食用时更有助于释放水果软糖中水果的香气[11]。
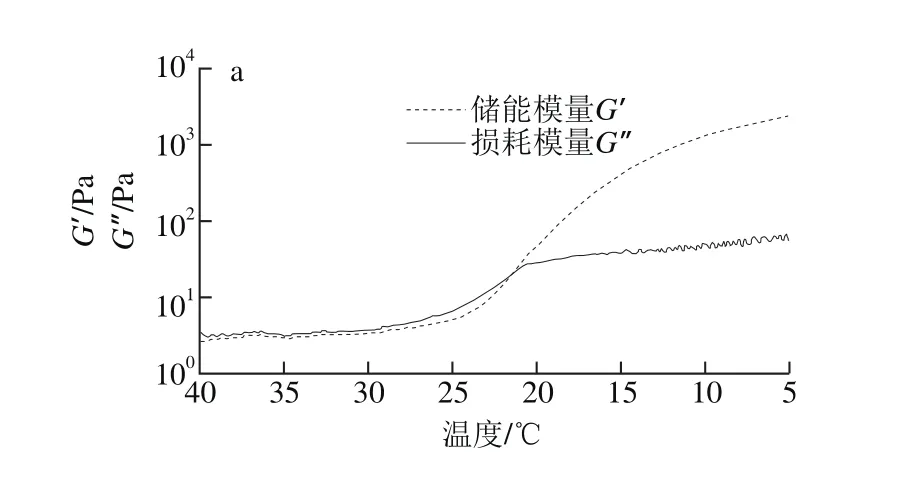

图1 金枪鱼皮明胶与猪皮明胶的胶凝温度和熔化温度Fig. 1 Gelling points and melting points of tuna skin gelatin and pork skin gelatin
2.3 氨基酸组成分析
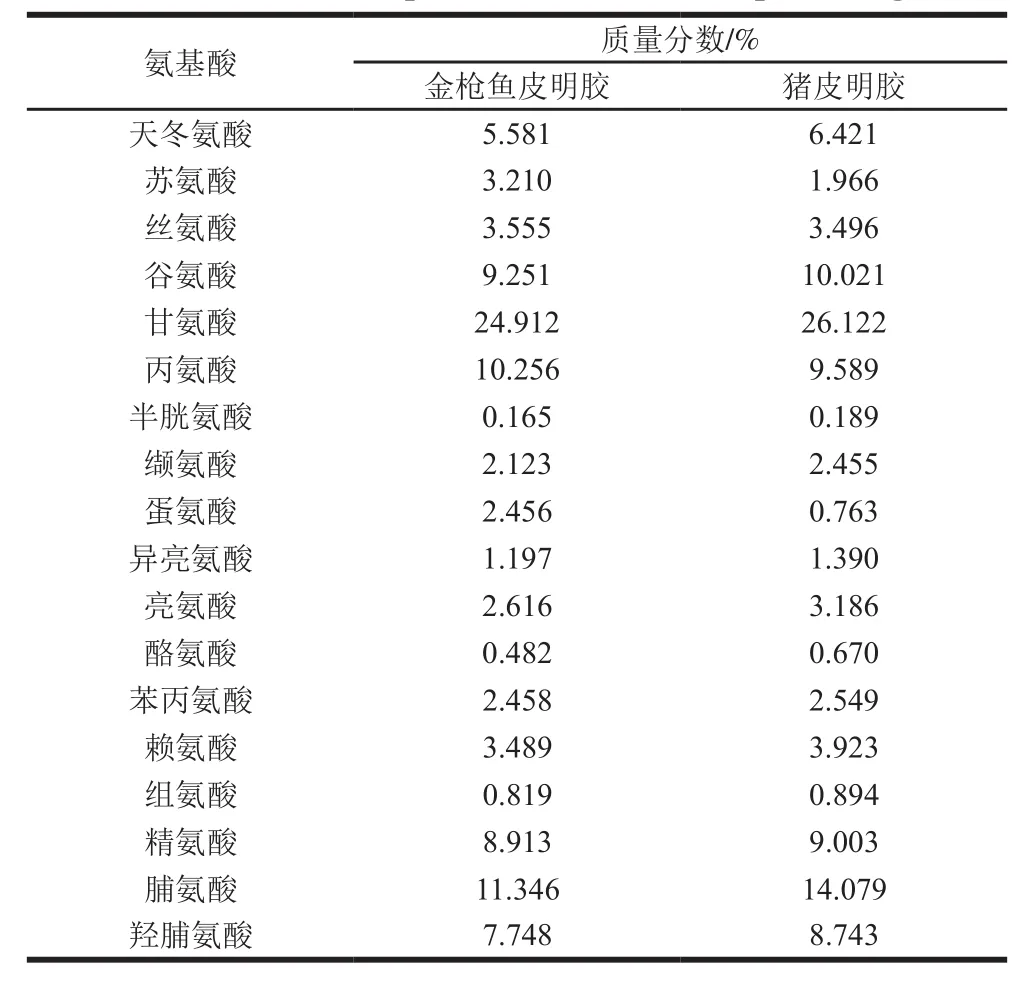
表1 金枪鱼皮明胶与猪皮明胶的氨基酸组成Table 1 Amino acid compositions of tuna skin and pork skin gelatins
由表1可知,本实验制备的金枪鱼皮明胶与猪皮明胶有着相似的氨基酸组成。金枪鱼皮明胶中,亚氨基酸(脯氨酸和羟脯氨酸)质量分数为19.09%,低于猪皮明胶中的亚氨基酸质量分数(22.82%)。与猪皮明胶相比,金枪鱼皮明胶中,丝氨酸、苏氨酸、丙氨酸和蛋氨酸含量明显偏高,而组氨酸含量偏低,与一些水产明胶氨基酸组成方面研究[23-24]一致。
明胶中亚氨基酸的含量越高,明胶的凝胶特性和流变学性能越好,这也是大目金枪鱼皮凝胶特性和流变学特性低于猪皮明胶的主要原因。研究表明冷水鱼类明胶中亚氨基酸质量分数在17%左右[12],由此可见大目金枪鱼皮明胶的凝胶特性和流变学性能可能优于已报道的大部分冷水鱼皮明胶。
2.4 SDS-PAGE分析结果
明胶是胶原蛋白经酸、碱或酶处理后热提取形成的高聚物,热提取过程中,维系胶原蛋白分子间的共价交联以及肽键会产生随机性断裂,故水解过后的明胶分子中,除α、β、γ等亚基组分外,还存在一些小分子组分。小分子组分含量越高,明胶凝胶特性就越差[25-27]。

图2 金枪鱼皮明胶与猪皮明胶SDS-PADE图谱Fig. 2 SDS-PADE profiles of tuna skin and pork skin gelatins
由图2可以看出,2 种明胶的分子质量分布都非常相似,都主要由100~120 kDa的α1和α2带、大于200 kDa的β带、及更高分子质量的γ带组成。经Gene Tools软件分析可以得到猪皮明胶样品中分子质量低于100 kDa的小分子组分质量分数为7.4%,而金枪鱼皮明胶中小分子组分质量分数更低,为6.67%,这可能也是属于水产明胶的金枪鱼皮明胶凝胶强度与猪皮明胶凝胶强度接近的原因之一。
2.5 紫外光谱分析结果
蛋白质中存在色氨酸、酪氨酸和苯丙氨酸等芳香族氨基酸,这些氨基酸由于共轭双键的存在,在紫外波长范围为280 nm左右有明显的吸收峰。但明胶中的芳香族氨基酸含量较少,使其在280 nm波长处的吸收峰不明显[28]。明胶中由于存在C=O、CONH2、—COOH等发色基团,紫外特征吸收峰通常出现在220 nm波长左右[29]。由图3可知,金枪鱼皮明胶、猪皮明胶的吸收峰分别出现在206 nm和208 nm波长处,与陈小雷[30]的结果相一致。2 种明胶在280 nm波长处都无明显的吸收峰,说明2 种明胶中的芳香族氨基酸含量都很少。这与氨基酸组分分析相一致。

图3 金枪鱼皮明胶与猪皮明胶的紫外吸收光谱Fig. 3 UV absorption spectra of tuna skin and pork skin gelatins
2.6 红外光谱分析结果

图4 金枪鱼皮明胶(a)与猪皮明胶(b)的红外光谱Fig. 4 Infrared spectra of tuna skin (a) and pork skin gelatins (b)
从图4可以看出,金枪鱼皮明胶与猪皮明胶各峰形一致,均具有胶原蛋白的特征振动模式。金枪鱼皮明胶和猪皮明胶的酰胺A带分别出现在3 434.65 cm-1和3 406.68 cm-1,是N—H伸缩振动或O—H伸缩振动的吸收峰。当肽键中的N—H基团参与氢键的形成时,酰胺A带常向低波数移动[21],说明在金枪鱼皮明胶中与N—H相关的氢键含量略低于猪皮明胶。金枪鱼皮明胶和猪皮明胶的酰胺I带分别出现在1 648.02 cm-1和1 659.28 cm-1,代表了C=O的伸缩振动,与猪皮明胶相比,金枪鱼皮明胶的酰胺I带发生了红移,说明在金枪鱼皮明胶中与羰基有关的氢键含量与猪皮明胶相比略高。酰胺II带分别出现在1 547.47 cm-1和1 540.36 cm-1处,表示C—N伸缩或N—H弯曲振动。酰胺III带是C—H振动的吸收峰,这部分结构与蛋白质的三级螺旋结构有关。胶原蛋白水解成明胶的过程即是胶原三螺旋结构解旋并逐渐水解的过程,金枪鱼皮明胶和猪皮明胶分别在1 243.57 cm-1和1 240.77 cm-1处出现酰胺III带的吸收峰,说明在制备明胶时,三螺旋结构遭到部分破坏但仍有保留。从峰面积看,猪皮明胶三螺旋破坏更彻底[27],可能制备猪皮明胶的条件更剧烈,因而产生的小分子也较多,这与电泳结果相一致。此外,金枪鱼皮明胶中还有一部分其他的吸收峰,如2 924.79 cm-1的C—H伸缩振动的吸收峰,1 453.83 cm-1的—CH—、—CH3的弯曲振动的吸收峰,1 384 cm-1的—CH2—摇摆振动吸收峰,1168.42 cm-1的C—N—C振动或C—O伸缩振动的吸收峰,这些吸收峰的存在说明明胶分子属于顺式构型。多肽键大部分肽链中的肽单位都是反式构型,只有脯氨酸和羟脯氨酸的残基肽单位是顺式构型[31],金枪鱼皮明胶中的脯氨酸和羟脯氨酸总质量分数高达19%,这进一步说明实验所制得的产物为高纯度明胶。
3 结 论
本实验先用碱再用酸处理鱼皮,随后热水提取制备金枪鱼皮明胶,研究所得明胶的一些理化性质,并与猪皮明胶进行了比较。结果表明,所得鱼皮明胶的凝胶强度(403 g)、胶凝温度(21.5 ℃)和熔化温度(28.8 ℃)均低于猪皮明胶。与哺乳动物明胶相比,水产明胶中亚氨基酸(脯氨酸和羟脯氨酸)含量较低,故胶凝温度和熔化温度较低。氨基酸组成分析刚好说明了这一点,金枪鱼皮明胶亚氨基酸质量分数为19.09%,低于猪皮明胶(22.82%)。SDS-PAGE电泳结果显示,金枪鱼皮明胶中的亚基组分保存较完整,高分子质量组分含量与猪皮明胶含量相当。金枪鱼皮明胶的紫外吸收光谱与红外吸收图谱与猪皮明胶相似,都具有胶原蛋白的特征振动模式,且紫外吸收光谱显示2 种明胶的芳香族含量较少,红外图谱中显示2 种明胶中亚氨基酸的存在,与氨基酸组分分析相对应。以上结果说明本实验制备的金枪鱼皮明胶与猪皮明胶的性质相当,且优于大部分水产明胶,又可避免疾病与宗教因素的限制,可以考虑将其作为哺乳动物明胶替代品使用,为合理利用金枪鱼副产物及寻找更好的明胶替代品提供了理论依据。
参考文献:
[1]胡国华. 功能性食品胶[M]. 北京: 化学工业出版社, 2014: 123-127.
[2]SEE S F, GHASSEM M, MAMOT S, et al. Effect of different pretreatments on functional properties of African catfish (Clarias gariepinus) skin gelatin[J]. Journal of Food Science and Technology,2015, 52(2): 753-762. DOI:10.1007/s13197-013-1043-6.
[3]KAEWRUANG P, BENJAKUL S, PRODPRAN T, et al.Physicochemical and functional properties of gelatin from the skin of unicorn leatherjacket (Aluterus monoceros) as affected by extraction conditions[J]. Food Bioscience, 2013, 2: 1-9. DOI:10.1016/j.fbio.2013.03.002.
[4]ZHOU P, MULVANEY S J, REGENSTEIN J M. Properties of Alaska pollock skin gelatin: a comparison with tilapia and pork skin gelatins[J]. Journal of Food Science, 2006, 71(6): 313-321.DOI:10.1111/j.1750-3841.2006.00065.
[5]王珊珊, 卢玉坤, 杨霞, 等. 提取温度与提取时间对真鳕鱼骨明胶理化性质的影响[J]. 食品工业科技, 2013, 34(13): 53-57.DOI:10.13386/j.issn1002-0306.2013.13.030.
[6]HOU P Z, REGENSTEIN J M. Optimization of extraction conditions for pollock skin gelatin[J]. Journal of Food Science, 2004, 69(5): 393-398. DOI:10.1111/j.1750-3841.2006.00065.
[7]闵新宇, 刘小敏, 黄雅钦. 三文鱼皮明胶的制备及其性能的研究[J]. 明胶科学与技术, 2013(1): 15-22. DOI:10.3969/j.issn.1004-9657.2013.01.003.
[8]曾少葵, 刘坤, 吴艺堂, 等. 脱钙罗非鱼鱼鳞明胶提取工艺优化及其理化性质[J]. 南方水产科学, 2013, 9(2): 38-44. DOI:10.3969/j.issn.2095-0780.2013.02.007.
[9]KASANKALA L M, 闫雪, 钱和. 草鱼鱼皮中明胶提取工艺优化[J]. 渔业科学进展, 2006, 27(4): 82-89. DOI:10.3969/j.issn.1000-7075.2006.04.015.
[10]ABDELMALEK B E, GÓMEZ-ESTACA J, SILA A, et al.Characteristics and functional properties of gelatin extracted from squid (Loligo vulgaris) skin[J]. LWT-Food Science and Technology,2016, 65: 924-931. DOI:10.1016/j.lwt.2015.09.024.
[11]CHO S M, GU Y S, KIM S B. Extracting optimization and physical properties of yellowfin tuna (Thunnus albacares) skin gelatin compared to mammalian gelatins[J]. Food Hydrocolloids, 2005, 19(2):221-229. DOI:10.1016/j.foodhyd.2004.05.005.
[12]KARIM A A, BHAT R. Gelatin alternatives for the food industry:recent developments, challenges and prospects[J]. Trends in Food Science & Technology, 2008, 19(12): 644-656. DOI:10.1016/j.tifs.2008.08.001.
[13]HAN Y, BYUN S H, PARK J H, et al. Bioactive properties of enzymatic hydrolysates from abdominal skin gelatin of yellowfin tuna (Thunnus albacares)[J]. International Journal of Food Science &Technology, 2015, 50(9): 1996-2003. DOI:10.1111/ijfs.12890.
[14]翟天晨. 南太平洋雌性大眼金枪鱼繁殖生物学研究[D]. 上海: 上海海洋大学, 2015.
[15]KARAYANNAKIDIS P D, CHATZIANTONIOU S E, ZOTOS A.Effects of selected process parameters on physical and sensorial properties of yellowfin tuna (Thunnus albacares) skin gelatin[J].Journal of Food Process Engineering, 2014, 37(5): 461-473.DOI:10.1111/jfpe.12103.
[16]SHI J, CHEN L, WANG Y, et al. A study of the gel strength change of photogelatin in dependence on their content of a components[J]. The Science & Technology of Gelatin, 2002, 22(1): 7-11.
[17]GÓMEZ-ESTACA J, MONTERO P, FERNÁNDEZ-MARTÍN F, et al.Physical and chemical properties of tuna-skin and bovine-hide gelatin films with added aqueous oregano and rosemary extracts[J].Food Hydrocolloids, 2009, 23(5): 1334-1341. DOI:10.1016/j.foodhyd.2008.09.013.
[18]KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009,23(3): 563-576. DOI:10.1016/j.foodhyd.2008.07.002.
[19]SONGCHOTIKUNPAN P, TATTIYAKUL J, SUPAPHOL P. Extraction and electrospinning of gelatin from fish skin[J]. International Journal of Biological Macromolecules, 2008, 42(3): 247-255. DOI:10.1016/j.ijbiomac.2007.11.005.
[20]ARNESEN J A, GILDBERG A. Extraction and characterisation of gelatine from Atlantic salmon (Salmo salar) skin[J]. Bioresource Technology, 2007, 98(1): 53-57. DOI:10.1016/j.biortech.2005.11.021.
[21]KARAMAN S, CENGIZ E, KAYACIER A, et al. Exposure to air accelerates the gelation of gelatin: steady and dynamic shear rheological characterization to see the effect of air on the strength of gelatin gel[J]. International Journal of Food Properties, 2016, 19(4):721-730. DOI:10.1080/10942912.2015.1012726.
[22]赵明明. 巴沙鱼皮明胶性质及应用研究[D]. 青岛: 中国海洋大学,2012.
[23]王忠稳, 汪海波, 梁艳萍, 等. 乌鳢和草鱼鱼皮胶原蛋白的提取与理化性能分析[J]. 食品科学, 2013, 34(17): 24-27. DOI:10.7506/spkx1002-6630-201317006.
[24]MUYONGA J H, COLE C G B, DUODU K G. Extraction and physico-chemical characterisation of Nile perch (Lates niloticus)skin and bone gelatin[J]. Food Hydrocolloids, 2004, 18(4): 581-592.DOI:10.1016/j.foodhyd.2003.08.009.
[25]黄惠君, 程晋生. 胶原与明胶分子的化学基础和明胶的凝胶化[J]. 明胶科学与技术, 2005, 25(2): 82-86. DOI:10.3969/j.issn.1004-9657.2005.02.006.
[26]LEDWARD D A. Gelation of gelatin[J]. Functional Properties of Food Macromolecules, 1986: 171-201.
[27]NAGARAJAN M, BENJAKUL S, PRODPRAN T, et al.Characteristics and functional properties of gelatin from splendid squid(Loligo formosana) skin as affected by extraction temperatures[J].Food Hydrocolloids, 2012, 29(2): 389-397. DOI:10.1016/j.foodhyd.2012.04.001.
[28]汲聪玲, 陆剑锋, 吕顺, 等. 不同提取温度对白鲢鱼皮明胶理化性质的影响[J]. 食品科学, 2016, 37(9): 117-122. DOI:10.7506/spkx1002-6630-201609022.
[29]CHANDRA M V, SHAMASUNDAR B A. Rheological properties of gelatin prepared from the swim bladders of freshwater fish Catla catla[J]. Food Hydrocolloids, 2015, 48: 47-54. DOI:10.1016/j.foodhyd.2015.01.022.
[30]陈小雷. 斑点叉尾鮰鱼皮明胶的制备, 性质与应用研究[D]. 合肥: 合肥工业大学, 2013.
[31]吴林生. 猪皮明胶的提取、分离机纯化工艺研究[D]. 合肥: 合肥工业大学, 2011.

