二氢噻唑类化合物的合成及其抑菌活性研究
郑绍军, 杨丹丹,朱 瑞,谭芳芳,张继文*
(1.江苏科技大学 环境与化学工程学院, 镇江 212003) (2.江苏科技大学 海洋装备研究院, 镇江 212003) (3.西北农林科技大学 化学与药学院, 杨凌 712100)
近年来植物细菌性病害已经成为我国农业生产的主要病害之一,严重地影响了农产品产量和质量,造成了巨大的经济损失.使用抗生素可以有效地保护农作物,但是抗生素的肆意使用已经导致耐药性病菌甚至超级细菌的产生[1],因此研究绿色天然高效的抑菌剂已是迫在眉睫.
创制新农药的途径虽然很多,但天然产物模型仍然是最主要的途径之一[2-4].天然产物分子不仅可以作为先导结构,经多次先导优化、衍生合成,最终开发出新农药,而且还为发现新的农药作用靶标提供了基础[5-7].
2012 年,西北农林科技大学农药研究所从微生物放线菌的发酵液中分离得到了一种具有广谱、高效抗菌的二氢噁唑类化合物,并将其命名为杨凌霉素.2014 年,本课题组成功合成了杨凌霉素及其类似物,经活性试验研究发现:化合物A和A′(图 1)对所有的细菌都表现出了良好的抑制活性且比阳性对照(氨苄青霉素钠)的抑菌活性更好,尤其是对枯草芽孢杆菌(Bacillussubtilis)和猕猴桃溃疡病病菌(Pseudomonassyringaepv.actinidiae)的MIC值分别达到了 7.81 μg/mL 和 3.91 μg/mL[9-10].为了进一步探索二氢噻唑类化合物的抑菌活性及构效关系,并期望发现高活性杀菌剂,以化合物A和A′做为先导化合物进一步进行结构优化,设计合成了一系列二氢噻唑类化合物,并评价其抑菌活性.

图1 化合物A 和A′ 的结构Fig.1 Structures of compounds A and A′
1 实验
1.1 仪器及试剂
LCQAdvantage MAX 质谱仪,美国热电公司;Bruker Avance 500 MHz核磁共振仪(TMS 为内标)瑞士布鲁克公司;紫外分析仪,上海医疗仪器厂; GF254薄层层析硅胶和柱层析硅胶(100-200 目,200-300 目),青岛海洋化工厂.试剂:无水甲醇、二氯甲烷、乙酸乙酯、四氢呋喃等其他试剂,如无特别标明,均为市售分析纯试剂.显色剂:紫外灯、硫酸/乙醇、茚三酮显色剂、磷钼酸和碘等常规显色剂.
1.2 化合物的制备
醚类化合物的合成见反应式1.

反应式1 二氢噻唑醚类衍生物的合成Scheme 1 Synthesis of dihydrothiazole ether-derivatives
称取化合物A或A′(1 mmol)和相对应的卤代烷烃(1 mmol)于50 mL的茄型瓶中,溶解于无水四氢呋喃中,加入氢化钠(1 mmol),常温搅拌1 h后TLC(UV 254 nm显色)检测反应完全后,加入少量乙酸溶液淬灭反应,用150 mL乙酸乙酯稀释,再用饱和NaHCO3(2×50 mL),饱和NaCl(2×50 mL)依次洗涤,无水硫酸钠干燥.柱层析分离的到醚类产物1、2、3、1′、2′和3′,收率在79%~85%.

反应式2 二氢噻唑酯类衍生物的合成Scheme 2 Synthesis of dihydrothiazole ester-derivatives
酯类化合物的合成见反应式2.
称取化合物A或A′(1 mmol)和相对应的酸酐(1 mmol)于50 mL的茄型瓶中,溶解于无水甲醇中,依次加入4-甲氨基吡啶(DMAP)(1.5 mmol)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)(1.5 mmol)、N,N-二异丙基乙胺(DIPEA)(1.5 mmol),反应过夜后TLC(UV 254 nm显色)检测反应完全后,加入少量乙酸溶液淬灭反应后,用150 mL乙酸乙酯稀释,再用饱和NaHCO3(2×50 mL),水(2×50 mL),饱和NaCl(2×50 mL)依次洗涤,无水硫酸钠干燥.柱层析分离的酯类产物4、5、6、7、8、9、10、4′、5′、6′、7′、8′、9′ 和 10′,收率在67%~85%.
1.3 生物活性测试
1.3.1 供试细菌
所有的供试菌种均由西北农林科技大学农药研究所提供,其中绿脓杆菌枯草芽孢杆菌(Bacillussubtilis, CGMCC 1.88)、金黄色葡萄球菌(Staphylococcusaureus, CGMCC 1.89)购自中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center, CGMCC),猕猴桃溃疡病病菌(Pseudomonassyringaepv.actinidiae)、烟草青枯病病菌(Pseudomonassolanacearum)和茄科劳尔氏菌(Ralstoniasolanacearum)均由农药研究所研究人员分离得到.
1.3.2 培养基(液)
牛肉膏蛋白胨培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂15-25 g,水1 000 mL,pH 7.4~7.6,120oC高压灭菌2 h.
LB培养液:蛋白胨10 g,酵母提取物5.0 g,氯化钠10.0 g,水1 000 mL,pH 7.4~7.6,120oC高压灭菌2 h.
1.3.3 细菌活性测试
阳性对照:青霉素钠
供试菌种:枯草芽孢杆菌(Bacillussubtilis)、金黄色葡萄球菌(Staphylococcusaureus)、烟草青枯病病菌(Pseudomonassolanacearum)、猕猴桃溃疡病病菌(Pseudomonassyringaepv.actinidiae)、茄科劳尔氏菌(Ralstoniasolanacearum).
实验方法:采用滤纸片法.将接好的细菌用无菌水洗到灭过菌的离心管中,配成细菌悬浮液,然后和融化好的牛肉膏蛋白胨培养基混合均匀.吸取3 mL倒入直径为9 mm的培养皿中制成带菌培养基.然后将药液用丙酮溶解,配置成2 000 μg/mL,吸取5 μL药液涂在直径为6 mm的圆形滤纸片上,晾干成带药滤纸片,以相同浓度的青霉素钠(2 000 μg/mL)为阳性对照,丙酮为空白对照,每个处理设置3次重复,然后将晾干的滤纸片贴在带菌培养基上,每皿贴7~9个滤纸片,并确保滤纸片完全贴敷于培养基上,将培养皿培养在37oC的恒温培养箱中,根据菌的生长情况培养8~10 h,取出培养皿观察化合物对菌的抑制情况.记录抑菌圈的大小及透明度,用十字交叉法测量抑菌圈的直径求平均值(单位:mm).
2 结果与讨论
2.1 化合物的结构鉴定

1:黄色油状液体.1H NMR (500 MHz, CDCl3)=12.61 (s, 1 H), 7.48-7.29 (m, 2 H), 7.00 (d,J=8.5 Hz, 1 H), 6.94-6.81 (m, 1 H), 4.92 (dq,J=4.7, 7.8 Hz, 1 H), 3.76 (dd,J=4.7, 9.5 Hz, 1 H), 3.66-3.51 (m, 3 H), 3.45 (dd,J=8.5, 11.0 Hz, 1 H), 3.34 (dd,J=6.9, 11.0 Hz, 1 H), 1.23 (t,J=7.1 Hz, 3 H).13C NMR (125 MHz, CDCl3)δ=172.6, 159.1, 133.0, 130.6, 118.8, 117.0, 116.3, 75.6, 71.0, 66.9, 33.9, 15.1. ESI-MS m/z: 238.33 [M+H]+.

2:棕色油状液体.1H NMR (500 MHz, CDCl3)δ=12.53 (s, 1 H), 7.43-7.34 (m, 2 H), 7.00 (d,J=8.2 Hz, 1 H), 6.88 (t,J=7.4 Hz, 1 H), 4.98-4.92 (m, 1 H), 4.28-4.23 (m, 2 H), 3.89-3.85 (m, 1 H), 3.71-3.66 (m, 1 H), 3.48-3.44 (m, 1 H),3.35(dd,J=7.4,10.9 Hz,1 H),2.49(t,J=2.2 Hz,1 H).13C NMR (125MHz,CDCl3) δ=172.9,159.1,133.1,130.6,118.8,117.0, 116.2, 79.2, 75.3, 75.0, 70.3, 58.6, 33.8. ESI-MS m/z: 248.32 [M+H]+.

3:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=12.61 (s, 1 H), 7.43-7.34 (m, 2 H), 7.00 (d,J=8.2 Hz, 1 H), 6.90-6.86 (m, 1 H), 4.95-4.90 (m, 1 H), 3.76 (dd,J=4.6, 9.6 Hz, 1 H), 3.56-3.39 (m, 4 H), 3.34 (dd,J=7.3, 11.0 Hz, 1 H), 1.61-1.58 (m, 2 H), 1.35-1.32 (m, 4 H), 0.92-0.90 (m, 3 H).13C NMR (125MHz, CDCl3)δ=172.6, 159.1, 133.0, 130.6, 118.8, 117.0, 116.3, 75.6, 71.7, 71.2, 33.9, 29.3, 28.2, 22.5, 14.0. ESI-MS m/z: 266.38 [M+H]+.
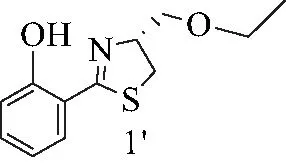
1′:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=12.61 (s, 1 H), 7.43-7.34 (m, 2 H), 7.00 (d,J=8.2 Hz, 1 H), 6.90-6.87 (m, 1 H), 4.95-4.90 (m, 1 H), 3.76 (dd,J=4.7, 9.5 Hz, 1 H), 3.63-3.53 (m, 3 H), 3.45 (dd,J=8.7, 10.9 Hz, 1 H), 3.34 (dd,J=6.9, 11.0 Hz, 1 H), 1.23 (t,J=7.1 Hz, 3 H).13C NMR (125MHz, CDCl3)δ=172.6, 159.1, 133.0, 130.6, 118.8, 117.0, 116.3, 75.6, 71.0, 66.9, 33.9, 15.1. ESI-MS m/z: 238.33 [M+H]+.

2′:棕色油状液体.1H NMR (500 MHz, CDCl3)δ=12.53 (s, 1 H), 7.42-7.34 (m, 2 H), 7.00 (d,J=8.2 Hz, 1 H), 6.88 (t,J=7.6 Hz, 1 H), 4.98-4.91 (m, 1 H), 4.48-4.23 (m, 2 H), 3.89-3.85 (m, 1 H), 3.71-3.66 (m, 1 H), 3.47-3.43 (m, 1 H),3.37-3.31 (m, 1 H),2.49 (t,J=2.4 Hz, 1 H).13C NMR (125MHz, CDCl3)δ=172.9, 159.1, 133.1, 130.6, 118.8, 117.0, 116.2, 79.2, 75.3, 75.0, 70.3, 58.6, 33.8. ESI-MS m/z: 248.32 [M+H]+.

3′:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=12.61 (s, 1 H), 7.43-7.34 (m, 2 H), 7.00 (d,J=8.5 Hz, 1 H), 6.90-6.86 (m, 1 H), 4.95-4.90 (m, 1 H), 3.76 (dd,J=4.6, 9.6 Hz, 1 H), 3.56-3.39 (m, 4 H), 3.33 (dd,J=7.3, 11.0 Hz, 1 H), 1.61-1.58 (m, 2 H), 1.35-1.30 (m, 4 H), 0.92-0.89 (m, 3 H).13C NMR (125MHz, CDCl3)δ=172.6, 159.1, 133.0, 130.6, 118.8, 117.0, 116.3, 75.6, 71.7, 71.2, 33.9, 29.3, 28.2, 22.5, 14.0. ESI-MS m/z: 266.38[M+H]+.
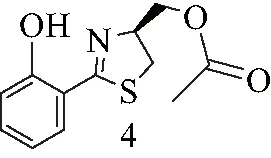
4:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=7.46-7.30 (m, 2 H), 7.01 (d,J=8.2 Hz, 1 H), 6.95-6.81 (m, 1 H), 5.07-4.85 (m, 1 H), 4.39 (dd,J=5.4, 11.3 Hz, 1 H), 4.29 (dd,J=6.5, 11.2 Hz, 1 H), 3.46 (dd,J=8.5, 11.0 Hz, 1 H), 3.22 (dd,J=7.6, 11.0 Hz, 1 H), 2.10 (s, 3 H).13C NMR (125MHz, CDCl3)δ=173.1, 170.7, 159.1, 133.3, 130.6, 118.9, 117.1, 116.1, 74.3, 64.6, 33.5, 20.8. ESI-MS m/z: 252.31 [M+H]+.

5:黄色油状液体.1H NMR (500 MHz, CDCl3) 12.33 (br. s., 1 H), 7.48-7.30 (m, 2 H), 7.01 (d,J=8.2 Hz, 1 H), 6.88 (t,J=7.6 Hz, 1 H), 5.11-4.87 (m, 1 H), 4.40 (dd,J=5.4, 11.3 Hz, 1 H), 4.31 (dd,J=6.3, 11.0 Hz, 1 H), 3.46 (dd,J=8.8, 11.0 Hz, 1 H), 3.22 (dd,J=7.6, 11.0 Hz, 1 H), 2.38 (q,J=7.6 Hz, 2 H), 1.17 (t,J=7.6 Hz, 3 H).13C NMR (125MHz, CDCl3)δ=174.2, 173.2, 159.3, 133.3, 130.7, 118.9, 117.3, 116.2, 74.6, 64.7, 33.6, 27.5, 9.1. ESI-MS m/z: 266.34 [M+H]+.
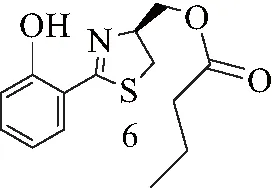
6:黄色油状液体.1H NMR (500 MHz, CDCl3) 12.34 (br. s., 1 H),δ=7.41 (d,J=7.9 Hz, 1 H), 7.39-7.33 (m, 1 H), 7.01 (d,J=8.5 Hz, 1 H), 6.88 (t,J=7.4 Hz, 1 H), 5.09-4.88 (m, 1 H), 4.39 (dd,J=5.4, 11.0 Hz, 1 H), 4.32 (dd,J=6.1, 11.2 Hz, 1 H), 3.46 (dd,J=8.8, 11.0 Hz, 1 H), 3.22 (dd,J=7.6, 11.0 Hz, 1 H), 2.34 (t,J=7.4 Hz, 2 H), 1.74-1.65 (m, 2 H), 0.96 (t,J=7.4 Hz, 3 H).13C NMR (125MHz, CDCl3)δ=173.3, 159.2, 133.2, 130.6, 118.9, 117.2, 116.2, 74.6, 64.6, 36.1, 33.5, 18.4, 13.6. ESI-MS m/z: 280.36 [M+H]+.

7:白色固体.1H NMR (500 MHz, CDCl3)δ=12.24 (s, 1 H), 7.45-7.33 (m, 2 H), 7.26-7.20 (m, 2 H), 7.16-6.92 (m, 2 H), 6.92-6.78 (m, 3 H), 5.03-4.89 (m, 1 H), 4.67 (s, 2 H), 4.56-4.32 (m, 2 H), 3.37 (dd,J=8.8, 11.0 Hz, 1 H), 3.13 (dd,J=7.6, 11.3 Hz, 1 H).13C NMR (125MHz, CDCl3)δ=173.5, 168.8, 159.2, 157.8, 130.7, 129.6×2, 121.9, 118.9, 117.2, 116.1, 114.6×2, 74.3, 65.3, 65.2, 33.3. ESI-MS m/z: 342.43 [M+H]+.
SHT11温湿度传感器是瑞恩公司推出的一款集温湿度检测于一体的传感器I2C器件,具有免调试、 免标定、 测量分辨率可编程调节(8/ 12/ 14 位数据) 和超小封装尺寸等特点;可以进行温度补偿的湿度测量;在测量温湿度的同时可以测量露点,输出为数字信号,很适合与单片机等控制器件结合组成智能温湿度测量系统。SHT11有4个管脚,其中1个接电源,1个接地,1个时钟管脚,一个数据管脚。

8:黄色油状.1H NMR (500 MHz, CDCl3)δ=7.83 (dd,J=1.6, 7.9 Hz, 1 H), 7.51-7.42 (m, 1 H), 7.33-7.27 (m, 1 H), 7.12 (d,J=7.6 Hz, 1 H), 4.96-4.80 (m, 1 H), 4.39-4.26 (m, 2 H), 3.45 (dd,J=9.0, 10.9 Hz, 1 H), 3.20 (dd,J=8.0, 10.9 Hz, 1 H), 2.32 (s, 3 H), 2.10 (s, 3 H).13C NMR (125MHz, CDCl3)δ=173.2, 170.8, 167.0, 159.2, 133.3, 130.7, 118.9, 117.2, 116.1, 74.4, 64.7, 33.5, 20.8×2. ESI-MS m/z: 294.35 [M+H]+.

9:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=7.83 (dd,J=1.3, 7.9 Hz, 1 H), 7.54-7.39 (m, 1 H), 7.34-7.27 (m, 1 H), 7.11 (d,J=7.9 Hz, 1 H), 5.03-4.81 (m, 1 H), 4.38 (dd,J=5.0, 11.0 Hz, 1 H), 4.29 (dd,J=6.3, 11.0 Hz, 1 H), 3.45 (dd,J=8.8, 11.0 Hz, 1 H), 3.20 (dd,J=8.2, 11.0 Hz, 1 H), 2.65 (q,J=7.6 Hz, 2 H), 2.38 (q,J=7.6 Hz, 2 H), 1.26 (t,J=7.6 Hz, 3 H), 1.16 (t,J=7.6 Hz, 3 H).13C NMR (125MHz, CDCl3)δ=174.2, 172.6, 165.4, 148.8, 131.9, 131.1, 126.1, 126.0, 123.7, 76.0, 65.0, 35.1, 27.9, 27.5, 9.1, 8.8. ESI-MS m/z: 322.40 [M+H]+.

10:黄色油状液体.1H NMR (500 MHz,CDCl3)δ=7.84 (dd,J=1.6,7.9 Hz,1 H),7.58-7.37 (m,1 H),7.35-7.27 (m,1 H),7.11 (d,J=7.9 Hz,1 H),4.93-4.79 (m,1 H),4.40 (dd,J=5.0,11.0 Hz,1 H),4.29 (dd,J=6.6,11.3 Hz,1 H),3.45 (dd,J=9.0,10.9 Hz,1 H),3.21 (dd,J=7.9, 11.0 Hz, 1 H), 2.60 (t,J=7.4 Hz, 2 H), 2.36-2.32 (m, 2 H), 1.83-1.76 (m, 2 H), 1.71-1.66 (m, 2 H), 1.06 (t,J=7.4 Hz, 3 H), 0.98-0.95 (m, 3 H).13C NMR (125MHz, CDCl3)δ=173.4, 171.8, 165.4, 148.7, 131.8, 131.0, 126.2, 125.9, 123.7, 75.9, 64.9, 36.4, 36.1, 35.2, 18.4, 18.1, 13.8, 13.7. ESI-MS m/z: 350.45 [M+H]+.

4′:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=7.52-7.30 (m, 2 H), 7.01 (d,J=8.2 Hz, 1 H), 6.95-6.82 (m, 1 H), 5.04-4.91 (m, 1 H), 4.39 (dd,J=5.4, 11.0 Hz, 1 H), 4.29 (dd,J=6.3, 11.3 Hz, 1 H), 3.46 (dd,J=8.8, 11.0 Hz, 1 H), 3.22 (dd,J=7.6, 11.0 Hz, 1 H), 2.11 (s, 3 H).13C NMR (125MHz, CDCl3)δ=173.2, 170.8, 159.2, 133.3, 130.7, 118.9, 117.2, 116.1, 74.4, 64.7, 33.5, 20.8. ESI-MS m/z: 252.31 [M+H]+.

5′:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=12.46-12.28 (m, 1 H), 12.33 (br. s., 1 H), 7.48-7.30 (m, 2 H), 7.01 (d,J=8.2 Hz, 1 H), 6.88 (t,J=7.6 Hz, 1 H), 5.11-4.87 (m, 1 H), 4.40 (dd,J=5.4, 11.3 Hz, 1 H), 4.31 (dd,J=6.3, 11.0 Hz, 1 H), 3.46 (dd,J=8.8, 11.0 Hz, 1 H), 3.22 (dd,J=7.6, 11.0 Hz, 1 H), 2.38 (q,J=7.6 Hz, 2 H), 1.17 (t,J=7.6 Hz, 3 H).13C NMR (125MHz, CDCl3)δ=174.2, 173.2, 159.3, 133.3, 130.7, 118.9, 117.3, 116.2, 74.6, 64.7, 33.6, 27.5, 9.1. ESI-MS m/z: 266.34[M+H]+.
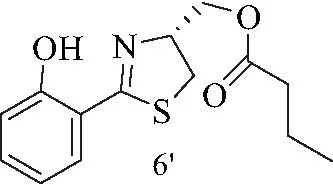
6′:黄色油状液体.1H NMR (500 MHz, CDCl3) 12.16 (br. s., 1 H),δ=7.41 (d,J=7.9 Hz, 1 H), 7.39-7.33 (m, 1 H), 7.01 (d,J=8.5 Hz, 1 H), 6.88 (t,J=7.4 Hz, 1 H), 5.09-4.88 (m, 1 H), 4.39 (dd,J=5.4, 11.0 Hz, 1 H), 4.32 (dd,J=6.1, 11.2 Hz, 1 H), 3.46 (dd,J=8.8, 11.0 Hz, 1 H), 3.22 (dd,J=7.6, 11.0 Hz, 1 H), 2.34 (t,J=7.4 Hz, 3 H), 1.74-1.65 (m, 3 H), 0.96 (t,J=7.4 Hz, 4 H).13C NMR (125MHz, CDCl3)δ=173.3, 159.2, 133.2, 130.6, 118.9, 117.2, 116.2, 74.6, 64.6, 36.1, 33.5, 18.4, 13.6. ESI-MS m/z: 280.36 [M+H]+.
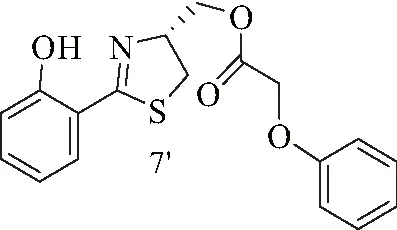
7′:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=12.24 (s,1 H),7.45-7.33 (m,2 H),7.26-7.20 (m,2 H),7.16-6.92 (m,2 H),6.92-6.78 (m, 3 H), 5.03-4.89 (m, 1 H), 4.67 (s, 2 H), 4.56-4.32 (m, 2 H), 3.37 (dd,J=8.8, 11.0 Hz, 1 H), 3.13 (dd,J=7.6, 11.3 Hz, 1 H).13C NMR (125MHz, CDCl3)δ=173.5, 168.8, 159.2, 157.8, 130.7, 129.6×2, 121.9, 118.9, 117.2, 116.1, 114.6×2, 74.3, 65.3, 65.2, 33.3. ESI-MS m/z: 344.41 [M+H]+.


9′:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=7.83 (dd,J=1.3, 7.9 Hz, 1 H), 7.54-7.39 (m, 1 H), 7.34-7.27 (m, 1 H), 7.11 (d,J=7.9 Hz, 1 H), 5.03-4.81 (m, 1 H), 4.38 (dd,J=5.0, 11.0 Hz, 1 H), 4.29 (dd,J=6.3, 11.0 Hz, 1 H), 3.45 (dd,J=8.8, 11.0 Hz, 1 H), 3.20 (dd,J=8.2, 11.0 Hz, 1 H), 2.65 (q,J=7.6 Hz, 2 H), 2.38 (q,J=7.6 Hz, 2 H), 1.26 (t,J=7.6 Hz, 3 H), 1.16 (t,J=7.6 Hz, 3 H).13C NMR (125MHz, CDCl3)δ=174.2, 172.6, 165.4, 148.8, 131.9, 131.1, 126.1, 126.0, 123.7, 76.0, 65.0, 35.1, 27.9, 27.5, 9.1, 8.8. ESI-MS m/z: 322.40 [M+H]+.

10′:黄色油状液体.1H NMR (500 MHz, CDCl3)δ=7.84 (dd,J=1.4, 7.7 Hz, 1 H), 7.58-7.39 (m, 1 H), 7.33-7.27 (m, 1 H), 7.11 (d,J=7.9 Hz, 1 H), 4.94-4.80 (m, 1 H), 4.39 (dd,J=5.0, 11.0 Hz, 1 H), 4.29 (dd,J=6.5, 11.2 Hz, 1 H), 3.45 (dd,J=8.8, 11.0 Hz, 1 H), 3.21 (dd,J=8.2, 11.0 Hz, 1 H), 2.60 (t,J=7.4 Hz, 2 H), 2.34 (t,J=7.4 Hz, 2 H), 1.79 (t,J=7.4 Hz, 2 H), 1.68 (t,J=7.4 Hz, 2 H), 1.05 (t,J=7.4 Hz, 3 H), 0.96 (t,J=7.4 Hz, 3 H).13C NMR (125MHz, CDCl3)δ=173.5, 171.9, 165.4, 148.6, 131.9, 131.0, 126.0, 126.0, 123.6, 75.8, 64.8, 36.3, 36.1, 35.1, 18.4, 18.1, 13.8, 13.7. ESI-MS m/z: 350.45 [M+H]+.
2.2 二氢噻唑类衍生物物理数据
二氢噻唑类衍生物物理数据见表1.

表1 二氢噻唑类衍生物的物理数据Table 1 Experiment date of dihydrothiazole derivatives
2.3 抑菌活性测试结果
将所有化合物配制成2 mg/mL的母液,用移液枪取5 μL药液加到直径为6 mm的干净的圆形滤纸片上,待溶剂挥发干后,将其转移到已经倒好的生测皿中,在冰箱中放置2 h后,将其放入恒温培养箱中进行培养,8~10 h后观察记录数据,如表2.

表2 化合物的抑菌活性Table 2 Antibacterial actitity of dihydrothiazoles derivatives
注:所有化合物经活性初筛后,只有以上化合物显示出了一定的抑菌活性,未显示明显抑菌活性的化合物在该表中未列出.抑菌圈直径为3个重复的平均值,空白对照为丙酮,阳性对照为青霉素钠;“-”表示没有抑菌圈,“+”表示抑菌圈可见,“++”表示抑菌圈较清晰,“+++”表示抑菌圈清晰,“++++”表示抑菌圈非常清晰透亮;载药量为1 μg/mL
抑菌活性研究显示:(1)所有化合物经活性初筛后,只有表2中所列出的化合物显示出了一定的抑菌活性;(2)4、4′、5、5′、6、6′、7、7′、8、8′、9、9′ 和 10′ 均对茄科劳尔氏菌显示出较高的的抑菌活性,且比青霉素钠更高;(3)5、5′、8′ 和 9 对枯草芽孢杆菌显示出较高的的抑菌活性,且比青霉素钠抑菌活性更高;(4)4、4′、5、5′、6、6′、7、7′、8、8′、9、9′、10 和 10′ 对金黄色葡萄球菌和猕猴桃溃疡病病菌均表现出一定的抑菌活性,但比青霉素钠略低;(5)5′、6、7、9 和 9′ 对烟草青枯病病菌表现出一定的抑菌活性,但比青霉素钠略低(6)5、5′、6、6′、7、7′、8、8′、9、9′、10′ 和 10′ 对猕猴桃溃疡病病菌表现出一定的抑菌活性,但比青霉素钠略低.
3 结论
本课题以化合物 A 或 A′ 为初始原料,通过一步反应合成了 17 个二氢噻唑类化合物,并对所有化合物进行抑菌活性研究,发现化合物 5、5′ 和 6 对茄科劳尔氏菌和枯草芽孢杆菌均显示出较高的抑菌活性,且比青霉素钠抑菌活性更高.对活性较好的化合物,进一步的结构优化和构效关系研究目前正在进行中.此项研究结果为进一步研究与开发此类杀菌剂建立了一定的基础.
参考文献(References)
[ 1 ] LI Y X, WANG H X, ALI S, et al. ChemInform abstract: iodine-mediated regioselective C2-amination of indoles and a concise total synthesis of (.+-.)-Folicanthine.[J]. ChemInform, 2012, 43(27): no-no. DOI:10.1002/chin.201227111. [LinkOut]
[ 2 ] 刘长令. 新农药创新方法与应用(1)—中间体衍生化方法[J]. 农药,2011(1):20-22.
LIU Changling. New approach for agrochemical discovery and application(1)-intermediate derivatization method[J]. Agrochemicals, 2011(1):20-22.(in Chinese)
[ 3 ] NEWMAN D J, CRAGG G M. Natural products as sources of new drugs over the last 25 years[J]. J Nat Prod, 2007, 70(3): 461-477. DOI:10.1021/np068054v.
[ 4 ] WRIGHT G. Antibiotics: An irresistible newcomer[J]. Nature, 2015, 517(7535): 442-444. DOI:10.1038/nature14193.
[ 5 ] NEWMAN D J, CRAGG G M. Natural products as sources of new drugs over the 30 years from 1981 to 2010[J]. Journal of Natural Products, 2012, 75(3): 311-335.DOI:10.1021/np200906s.
[ 6 ] FLIGHT H. Drug discovery: structure-led design[J]. Nature, 2013, 502(7471): S50-S52. DOI:10.1038/502S50a.
[ 7 ] 陆鸿飞,张亮泽,唐丛焕,等.微波合成6-氯-2′,3′,5′-三-O-乙酰基鸟苷[J].江苏科技大学学报(自然科学版),2010,24(4):391-394.
LU Hongfei, ZHANG Liangze, TANG Conghuan, et al.Microwave syn the sisof 6-chloro-2′,3′,5′-tri-O-acetylguanosin[J].Journal of Jiangsu Univer sity of Science and Technology(Natural Sciance Edition),2010,24(4):391-394.(in Chinese)
[ 8 ] WU W J, ZHANG J W, ZHANG W J, et al. A new dihydrooxazole antibiotic from the fermentation broth of streptomyces djakartensis[J]. Heterocycles, 2014, 89(7): 1656. DOI:10.3987/com-14-13001.
[ 9 ] DAN W, GENG H, QIAO J, et al. Efficient synthesis and antibacterial evaluation of (±)-yanglingmycin and its analogues[J]. Molecules, 2016, 21(12): 96. DOI:10.3390/molecules21010096.
[10] TAN F, SHI B, LI J, et al. Design and synthesis of new 2-aryl-4,5-dihydro-thiazole Analogues: in vitro antibacterial activities and preliminary mechanism of action[J]. Molecules, 2015, 20(11): 20118-20130. DOI:10.3390/molecules201119680.

