γ 射线终末辐照对同种异体肌腱病毒灭活效果及生物力学性能影响的研究
赵彦涛 刘思扬 尹惠琼 白玉龙 韩丽伟 胡先同 朱加亮 衷鸿宾
肌腱在机体运动过程中传递肌肉和骨骼间的相互作用,常承受着高强度的机械负荷,容易损伤,因此肌腱损伤跟骨折、骨缺损一样,属于较为常见的临床疾病[1]。其中,肌腱损伤中最为常见的是前交叉韧带 (anterior cruciate ligament,ACL) 损伤,据报道美国每年有超过 100 000 例 ACL 损伤的患者接受治疗[2-3],且 ACL 手术在美国最常做的手术中排第六位[4]。
肌腱损伤尤其是 ACL 损伤修复手术中,自体肌腱移植和同种异体肌腱移植应用最为普遍[5-6]。自体肌腱移植因来源受限,且给患者带来二次手术的伤害而限制其发展。同种异体肌腱来源相对丰富且能够满足临床上肌腱损伤修复手术对移植物的要求,被认为是一种理想的肌腱修复材料。但其同样存在发生病毒交叉感染的风险。因此,评价该类生物材料的生物安全性尤为重要。本研究参考我国血液制品病毒灭活规范及动物源性医疗器械审查指导原则相关内容[7-8],验证终末辐照对人工污染在同种异体肌腱上的伪狂犬病毒 (porcine pseudorbies virus,PRV)、水泡性口炎病毒 (vesicular stomatitis virus,VSV)、猪细小病毒 (porcine parvovirus,PPV)、猪脑心肌炎病毒 (encephalomyocarditis virus,EMCV)及人免疫缺陷病毒 (human immunodeficiency virus,HIV-1) 灭活效果,同时观察该病毒灭活工艺对同种异体肌腱生物极限拉伸载荷和组织结构的影响。
材料与方法
一、试验材料
同种异体肌腱:原材料由解放军骨科研究所提供,经北京鑫康辰医学科技发展有限公司进行了前处理和清洗后提供,批号 14001、14002、14003。
辐照源:由军事医学科学院放射与辐射医学研究所提供,辐照剂量 25 kGy。
细胞株:按常规方法培养用于 PRV 和 PPV 培养的猪肾传代细胞 (PK-15)、用于 VSV 培养的绿猴肾细胞 (Vero E6)、用于 EMCV 培养的仓鼠肾细胞(BHK-21)、MT4 细胞。
病毒株:PRV、PPV 可经 PK-15 细胞培养并产生细胞病变,VSV 可经 Vero E6 细胞培养并产生病变,EMCV 可经 BHK-21 细胞培养并产生细胞病变,HIV-1 可经 MT4 细胞培养并产生病变。以上指示病毒滴度均>6.00 Log TCID50 / 0.1 ml,均分装并置于 -70 ℃ 冰箱保存备用。
细胞培养液:DMEM+10% FBS,RPMI 1640+10% FBS,MEM+10% FBS。96 孔板 (Greiner bioone),CO2孵箱 (Thermo-Fisher),MTS-858 Mini BionixII 型材料力学试验机 [ 美斯特工业系统 (中国)有限公司 ]。
二、试验方法
1. 样品制备:取同种异体肌腱样品浸泡于 5 ml 指示病毒液 (PRV、PPV、VSV、EMCV) 中,室温放置60 min。取上一步样品,至于包装袋中,封口备用。按掷硬币方法将样品随机分为两组,一组经 25 kGy辐照灭菌处理,另一组不做辐照处理。将辐照前后样品浸泡于无血清细胞培养液中放置 30 min,取上清液 2 ml,置于离心机中,以 4000 r / min 离心10 min,吸取上清 1 ml,除菌过滤后置于 -70 ℃ 冰箱保存备检。该部分内容于军事医学研究院卫生勤务与血液研究所完成。
取同种异体肌腱样品一块,加入 HIV-1 1 ml,混匀、孵育,作为辐照前取样;同样,取同种异体肌腱一块,加入 HIV-1 1 ml,混匀,辐照后取样。该部分内容于军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室完成。
取正常供体手部肌腱 12 根,直径 4~5 mm 肌腱(由解放军总医院第一附属医院骨科研究所提供),按掷硬币的方法随机分为两组,一组经 25 kGy 辐照处理,另一组不经辐照。室温,生理盐水润湿,将两组肌腱修剪至等长 10 cm。将无菌纱布剪成宽 2 cm 的长条,在肌腱两端 2 cm 处缠绕 4 圈,用2#Ethibond 缝线将每根肌腱和纱布缝合 7 针,针距0.2 cm,固定,用于辐照前后同种异体肌腱力学性能检测。
2. 病毒滴度检测:将载有病毒的样品取样融化后,立即使用细胞培养液进行 10 倍的梯度稀释,然后加入铺好细胞的 96 孔板中,设定病毒对照和细胞对照,根据 Karber 氏法测定病毒滴度变化。每批样品重复测定 3 次,取其平均值。
3. 细胞盲传与检测:对经处理后不出现细胞病变的样品,吸取 96 孔板中最低稀释倍数孔的上清液加入铺好敏感细胞的 96 孔板中,置于 37 ℃、5%CO2培养箱中培养,盲传 3 代,并观察上清液细胞病变。
4. 力学性能检测:室温,生理盐水润湿,将两组肌腱固定于 MTS-858 Mini BionixII 材料试验机夹具 (上下端各 2 cm) 上。调整力学机使肌腱拉直但无张力,测量夹具间肌腱的长度。对肌腱预载,施加0~100 N 拉力,循环 5 次后恢复初长度静置 10 min后,行拉断试验,加载速度 3 mm / min,力学机记录载荷-时间曲线,记录极限载荷。
5. 组织学观察:取辐照前、辐照后肌腱,10%福尔马林固定后进行石蜡包埋切片,HE 染色,观察肌腱纤维结构是否有破坏。
6. 病毒灭活效果评价:根据卫生部《消毒技术规范》(2002 版) 和《血液制品去除 / 灭活病毒技术方法及验证指导原则》(2002 版) 关于病毒灭活 / 去除效果的评价,当病毒降低系数 ≥ 4 Log 值时,表明该病毒灭活工艺有效;如因实际检测方法限制导致病毒降低系数<4 Log 值时,应盲传 3 代,如无病毒检出,则可以认为病毒灭活工艺有效。
三、统计学处理
数据统计分析采用 SPSS 19.0 进行处理,组间比较采用独立样本t检验对同种异体肌腱两组极限载荷数据进行比较,以P<0.05 为差异有统计学意义。
结 果
一、PRV 检测结果
三批同种异体肌腱样品经辐照灭活工艺对病毒进行灭活后,均未检测到病毒,该工艺可使 PRV、VSV、PPV、EMCV、HIV-1 的滴度下降 4 个 Log 以上。对于检测不到病毒滴度的样品,取其最低稀释倍数孔上清液,接种敏感细胞,盲传 3 代,结果均未观察到细胞病变 (表1)。
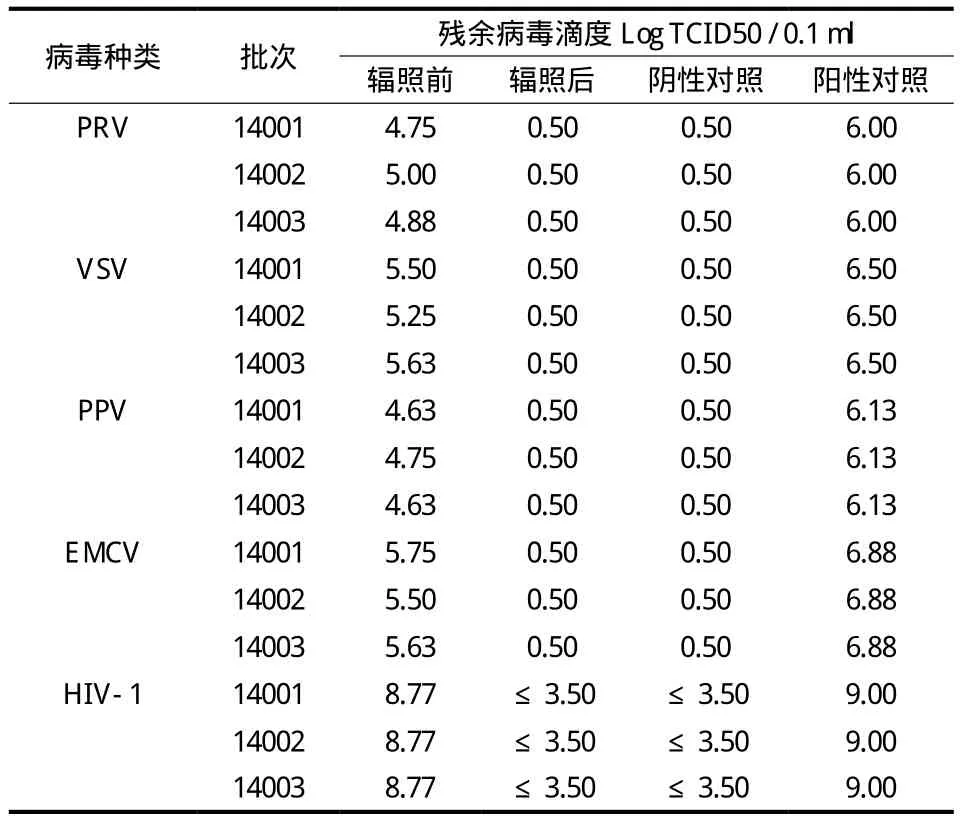
表1 辐照对 5 种病毒的灭活效果Tab.1 Effect of irradiation sterilization on viral inactivation
二、力学性能
γ 射线辐照灭菌 (辐照剂量 25 kGy) 前后,同种异体肌腱移植物在外观上无显著变化,均呈乳白色,质地柔软 (图1)。通过 MTS 力学试验机测试同种异体肌腱移植物辐照前后载荷与时间的关系 (图2~3),辐照前,同种异体肌腱极限载荷为(315.34~402.31) N,均值 363.76 N;辐照后,同种异体肌腱极限载荷为 (301.98~411.32) N,均值344.99 N。两组极限载荷数据比较差异无统计学意义(P>0.05) (表2)。
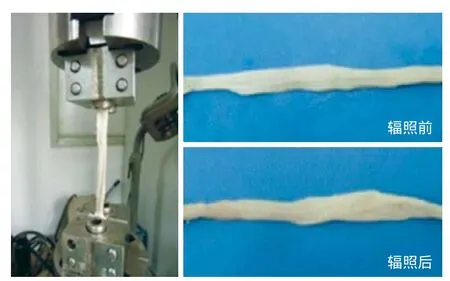
图1 MTS 力学试验机及辐照前后同种异体肌腱Fig.1 MTS testing machine & allogeneic tendon (before and after irradiation)
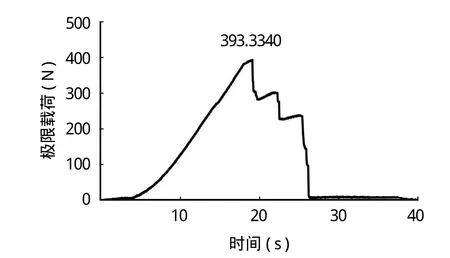
图2 同种异体肌腱辐照前极限载荷Fig.2 The ultimate load of allogeneic tendon before irradiation
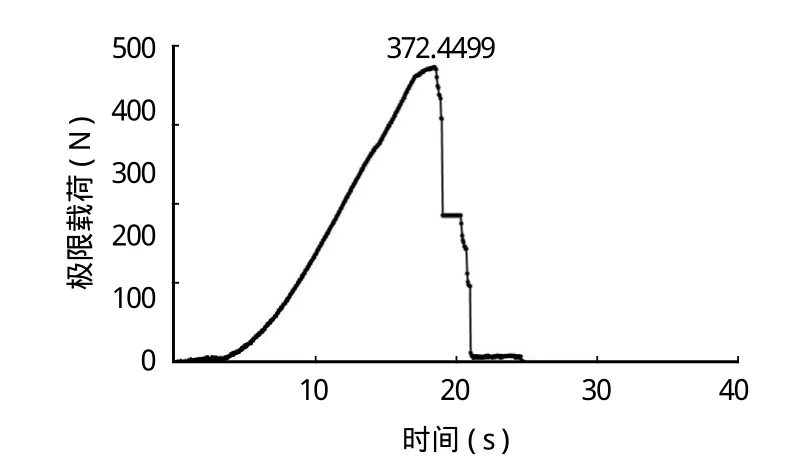
图3 同种异体肌腱辐照后极限载荷Fig.3 The ultimate load of allogeneic tendon after irradiation

表2 辐照前后同种异体肌腱极限载荷比较Tab.2 The ultimate lord of allogeneic tendon before and after irradiation
三、组织学观察
HE 染色显示辐照前后肌腱组织呈粉色波浪纹,胶原纤维稠密,结构无明显破坏 (图4)。
讨 论
同种异体肌腱在严重肌腱 / 韧带损伤修复领域应用历史久远且较为广泛,尤其是在膝关节交叉韧带的修复重建和跟腱断裂的修复上,其临床治疗效果与自体肌腱移植相当[6,9]。具国外文献报道,近来年同种异体肌腱用于 ACL 重建的使用率增长迅速,2002 年为 17.4%,2008 年已增长至 45.6%[10]。尽管同种异体肌腱拥有上述诸多优势,但是,在使用过程中仍存在问题:同种异体肌腱移植存在导致易感病毒传播的风险[11]。捐献的供体在取材之前虽已经过严格筛选和血清学检查,但仍不能完全排除感染病毒的可能 (如处在病毒感染的窗口期)。因此,在同种异体肌腱处理工艺中增加病毒灭活工序是必要的。国家食品药品监督管理总局对动物源性 / 同种异体组织修复材料的要求需要有相应的病毒灭活工序,旨在对处在窗口期的病毒进一步杀灭,排除处理过程中引入新的病毒,保证组织移植材料的生物安全性。
组织修复材料病毒灭活的方法多种多样,包括:(1) 物理法:如巴氏消毒法、干热灭活法、γ 射线辐照灭活法等;(2) 化学法:如乙醇灭活法、过氧乙酸-乙醇灭活法、有机溶剂 / 表面活性剂洗涤法 (S / D 法) 等;(3) 物理法和化学法联合使用。在选择病毒灭活工艺时,一方面需考虑该方法是否能够有效杀灭病毒,另一方面需考虑该方法是否对生物材料的性能产生不利的影响。对于同种异体生物材料而言,干热灭活法温度过高,无论是对硬组织(同种异体骨、软骨) 还是软组织 (同种异体肌腱 /韧带、皮肤、神经等) 均会造成较大的损害,不宜使用。巴氏消毒法 (60 ℃) 广泛用于牛奶、蛋白制品的病毒灭活,也可用于同种异体骨的病毒灭活,该温度对同种异体骨材料的生物性能影响不大,但却不适用于软组织材料的病毒灭活[12]。酒精灭活病毒的能力一般,对于一些较难杀灭的病毒如 PPV,酒精无法起到灭活作用。过氧乙酸-乙醇的病毒灭活效果较好[13],但过氧乙酸具有强氧化性,经过氧乙酸-乙醇处理后组织材料通常会出现颜色发白,组织结构膨胀等现象,且过氧乙酸具有腐蚀性,属于危险品,在生物材料制备过程中使用有较大的风险。另外,使用化学试剂对同种异体组织修复材料进行病毒灭活,通常需要较长时间的浸泡和解吸附,还需要验证有毒溶剂残留对材料的影响,故应尽量避免使用。
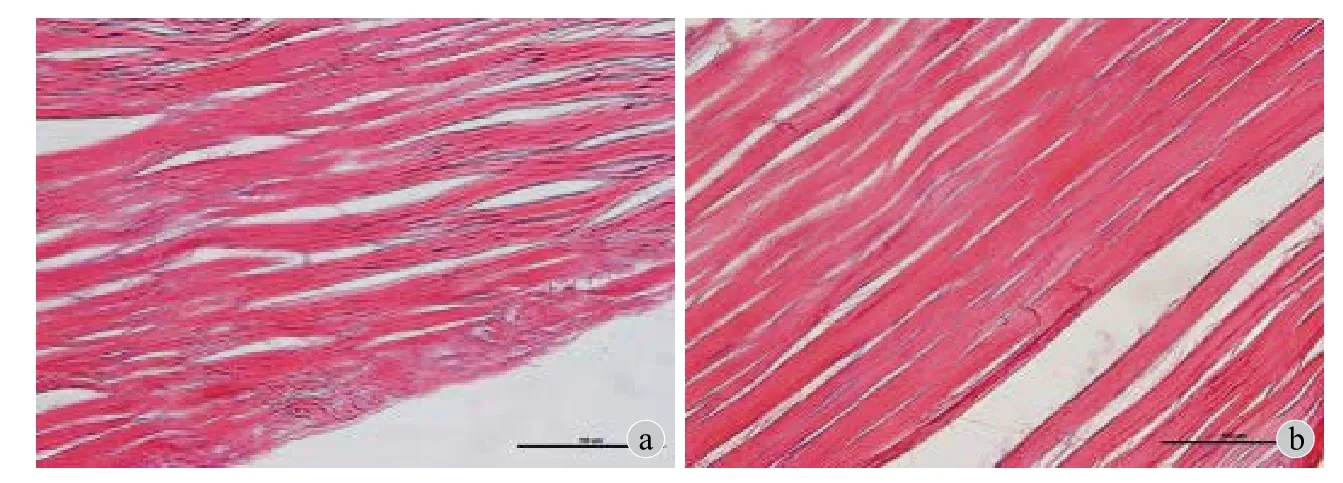
图4 同种异体肌腱辐照前 (a) 辐照后 (b)组织学 HE 染色 (× 40) 观察Fig.4 Histological results of allogeneic tendon before irradiation (a) and after irradiation (b),× 40
γ 射线辐照灭菌是目前生物材料制备过程中使用较为广泛的一种灭菌方式,通常在产品制备结束,装入包装袋后进行,称作终末辐照灭菌。其作用机理为:γ 射线作用于微生物后直接或通过产生游离基,破坏微生物 DNA 等核酸分子结构,导致微生物死亡[14]。另外,γ 射线还可以作用于微生物细胞活动所需的各种酶,导致酶活性降低或者失活,从而使微生物正常的生理过程受阻,直至死亡[15]。终末辐照灭菌的主要作用是杀灭微生物,保证材料无菌,其是否可以作为生物材料病毒灭活的工序存在一些争议。有研究者认为,低剂量 (<50 kGy) 辐照灭菌不能彻底杀灭病毒,尤其是 HIV 病毒[16],但是高剂量同样也意味着材料生物力学性能的损失;也有研究者认为,需要在终末辐照灭菌之前增加其它化学灭活病毒的方法,这样才能保证病毒彻底失活[17],但同样带来了化学试剂残留的风险,多一步化学处理可能对生物材料带来更多的损害或风险。
本研究表明,广泛应用的终末辐照灭菌 (剂量 25 kGy) 能够有效杀灭具有代表性的病毒。例如遗传物质为 DNA 的有囊膜病毒 PRV,无囊膜病毒PPV;遗传物质为 RNA 的有囊膜病毒 VSV,无囊膜病毒 EMCV 以及人免疫缺陷病毒 HIV。上述病毒均为人可能会接触感染的病毒以及经常与人接触的动物易感病毒,其中包含了耐受性极高的 PPV 和中等的 PRV、VSV 和 EMCV 以及耐受性较低的 HIV。辐照灭菌 (25 kGy) 能够使上述病毒滴度下降 4 Log 以上,并且盲传 3 代未观察到细胞病变。前期研究同样表明,60Co 辐照 (25 kGy) 处理同种异体软组织(羊膜),在足够的剂量和作用时间下是一种有效HIV 病毒灭活方法[18]。同时,本实验中采用 25 kGy辐照处理同种异体肌腱移植物,处理前后检测同种异体肌腱移植物的极限拉伸载荷,并行组织学染色观察两组组织结构变化,实验组和对照组的结果比较差异无统计学意义,表明 25 kGy 对同种异体肌腱移植物的极限载荷没有影响。由此可见,终末辐照灭菌可单独作为同种异体肌腱移植物病毒灭活的工艺使用,可避免由化学试剂的加入和残留引入的风险,并且该方法对同种异体肌腱材料的极限拉伸载荷和组织结构亦无不利影响。
参 考 文 献
[1]杨健, 葛建忠. 修复运动性肌腱损伤组织工程化肌腱及种子细胞和支架材料[J]. 中国组织工程研究, 2015, 19(51):8333-8337.
[2]Kim SJ, Bae JH, Lim HC. Comparison of Achilles and tibialis anterior tendon allografts after anterior cruciate ligament reconstruction[J]. Knee Surg Sports Traumatol Arthrosc, 2014,22:135-141.
[3]Bach BR Jr, Aadalen KJ, Dennis MG, et al. Primary anterior cruciate ligament reconstruction using fresh-frozen,nonirradiated patellar tendon allograft:minimum 2-year followup[J]. Am J Sports Med, 2005, 33(2):284-292.
[4]Santori N, Adriani E, Pederzini L. ACL reconstruction using quadriceps tendon[J]. Orthopedics, 2004, 27(1):31-35.
[5]Tanaka Y, Shino K, Horibe S, et al. Triple-bundle ACL grafts evaluated by second-look arthroscopy[J]. Knee Surg Sports Traumatol Arthrosc, 2012, 20(1):95-101.
[6]陈路, 蒲劲松, 张建光. 关节镜下自体和同种异体肌腱重建前交叉韧带的疗效比较[J]. 中国矫形外科杂志, 2017, 25(6):513-516.
[7]国家药品监督管理局血液制品去除 / 灭活病毒技术方法及验证指导原则[S]. 2002-05-09.
[8]卫生部卫生法制与监管司消毒技术规范[S]. 北京: 中国人民共和国卫生部. 2002.
[9]张玉兰, 李智峰, 汤艳, 等. 同种异体肌腱修复手部肌腱缺损优良率的 Meta 分析[J]. 生物骨科材料与临床研究, 2017,14(2):61-64,71.
[10]Jost P, Dy C, Robertson C, et al. Allograft use in anterior cruciate ligament reconstruction[J]. HSS J, 2011, 7(3):251-256.
[11]Hinsenkamp M, Muylle L, Eastlund T, et al. Adverse reactions and events related to musculoskeletal allografts: reviewed by the World Health Organisation Project NOTIFY[J]. Int Orthop(SICOT), 2012, 36:633-641.
[12]李晶, 陈学英. 同种骨移植疾病传播的风险与控制[J]. 中国修复重建外科杂志, 2015, 29(5):649-651.
[13]刘明, 张旗, 王蕊, 等. 过氧乙酸 - 乙醇对同种异体植入材料中病毒的灭活效果研究[J]. 中国消毒学杂志, 2010, 27(3):241-243.
[14]段鑫. X 射线对生鲜牛肉的杀菌效果[D]. 上海: 上海海洋大学. 2011: 3.
[15]青莉芳, 魏敏, 杨平华, 等. γ 辐照食品灭菌的机理及微生物检测[J]. 食品研究与开发, 2016, 37(5):218-220.
[16]Fideler B, Vangsness C Jr, Moore T, et al. Effects of gamma irradiation on the human immunodeficiency virus: a study in frozen human bone-patellar ligament-bone grafts obtained from infected cadavera[J]. J Bone Joint Surg Am, 1994, 76(7):1032-1035.
[17]周沫, 李幼忱, 张乃丽, 等. 过氧乙酸 - 乙醇联合辐照灭菌对同种肌腱力学强度的影响[J]. 中国矫形外科杂志, 2011,19(22):1898-1900.
[18]刘思扬, 庄道民, 董如华, 等.60钴辐照法对生物羊膜中人类免疫缺陷病毒灭活效果的研究[J]. 中国消毒学杂志, 2015,32(3):217-218,221.

