microRNA 在破骨细胞分化和功能中扮演的角色
谢保平 李劲平 石丽颖
骨质疏松症是一种全身性骨骼疾病,其特征是骨量减少和骨组织微结构破坏,骨强度下降、骨脆性增加。其主要发病机制是骨组织内的破骨细胞 (osteoclast,OC)和成骨细胞 (osteoblast,OB) 的功能活动平衡被破坏,成骨细胞主要发挥骨重建功能,而破骨细胞是来源于造血干细胞的具有骨吸收功能的一类多核细胞。破骨细胞的分化受到多种因素的调控,现已证实集落细胞刺激因子(macrophage-colony stimulating factor,M-CSF) 和 RANKL为破骨细胞分化所必需的细胞因子,RANKL 与破骨细胞膜上受体 RANK 结合,激活下游信号分子调控破骨细胞的分化,包括 c-Fos、TRAF6、NF-κB、NFATc1[1]等。此外机体自身分泌的激素,如雌激素和甲状旁腺素 (PTH) 也参与破骨细胞分化的调控。近年来,越来越多的文献报道miRNA 在破骨细胞分化的过程中扮演重要的角色。
一、microRNA 成熟过程与生物学功能
microRNA 是一段长度为 19~22 个碱基的非编码RNA,由内含子和编码基因间隔区基因编码,具有组织特异性和高度时序性的特点。作用于靶基因 mRNA 的3’-UTR 区,调控靶基因的翻译过程,从而调控细胞增殖和分化、凋亡过程[2-3]。当 miRNA 与靶基因的 3’-UTR区完全配对时,靶基因的 mRNA 完全降解,部分配对时,靶基因的翻译过程受到抑制[4]。成熟 miRNA 的形成要经过多种内切酶的作用 (图1),首先,在转录因子和RNA 聚合酶 II 的作用下将 DNA 转录为初始 miRNA (primiRNA),然后,在细胞核中 Drosha 酶将其加工成前体miRNA (pre-miRNA),通过 Exportin-5 运载体转运到胞质中,经过 Dicer 酶的加工成成熟的 miRNA[5]。故 Drosha酶和 Dicer 酶是 miRNA 成熟的关键酶,有文献报道敲除Dicer 基因的小鼠,miRNA 形成障碍,骨骼发育较正常小鼠晚,软骨的发育亦受影响[3]。成熟的 miRNA 与 RISC 结合形成复合物,复合物与靶基因 mRNA 的 3’-UTR 区结合调节靶基因的翻译过程[6]。现就与破骨细胞分化相关的信号转导过程及 miRNA 在信号转导中扮演的角色,作以下总结。
二、细胞核因子 κB 受体活化因子 (receptor activator of NF-kappaB,RANK) 信号传导过程及相关 miRNA
1. RANK 信号传导过程:RANKL 和 RANK 为肿瘤坏死因子超家族的成员,RANKL 为 II 型跨膜蛋白,由成骨细胞分泌,是破骨细胞前体分化为成熟破骨细胞的必须因子。RANK 是 RANKL 唯一的信号受体,属 I 型跨膜蛋白。RANK 和 RANKL 结合募集肿瘤坏死因子受体相关因子 (TNF receptor-associated factor-6,TRAF6) 到 RANK胞内区[7],与 TAB2 和 TAK1 形成 RANK-TRAF6-TAB2-TAK1 复合物[8],TRAF6 可通过 TAK1 将信号传导给下游的细胞核因子 κB (NF-κB) 和促分裂原活化蛋白激酶(mitogen activated protein kinase,MAPKs)。靶点 NF-κB是一类二聚体转录因子,其中 p50 和 p52 是 NF-κB 信号传导中的关键蛋白[9]。此外,NF-κB 激酶诱导剂 (IKK) 和NF-κB 可诱导性激酶 (NIK) 是激活 NF-κB 的关键因子,TRAF6 激活 NIK 和 IKK 酶,后者使 NF-κB 抑制物 IκBα(Inhibitor of NF-κB) 磷酸化[9],从而释放核因子 p65 /RrelA 和 p50 / 52 复合物入核,结合相应的 DNA 位点,调控相关基因转录或者将募集信号传导到下游靶点活化 T 细胞核因子 c1 (nuclear factor of activated T cells,NFATc1),促进 NFATc1 的募集。NFATc1 作为核转录因子调控破骨细胞相关基因的表达,进而影响破骨细胞分化。这条信号通路可表示为 RANKL+RANK → TRAF6 → NIK / IKK →NF-κB → NFATc1 → OC 分化。
TRAF6 将信号传导到 MAPKs,MAPK 途径是一个三级酶联反应传递信号,激活酶联反应的途径主要包括细胞外信号调节激酶 (ERK)、JNK、p38MAPK 途径[10]。另外,RANKL 激活 RANK 受体指导 AP-1 蛋白主要成分c-fos 蛋白的表达,进而激活 AP-1 蛋白,通过染色质免疫沉淀反应 (ChIP) 发现 c-fos 是 NFATc1 信号募集的促进剂,且 c-fos 基因缺乏的小鼠患有严重的骨硬化症[9]。因此 NFATc1 核转录因子是 NF-κB 和 AP-1 的共同靶点。由此形成两条以膜受体 RANK 和 NFATc1 为核心的调控破骨细胞分化的信号通路 (图1)。
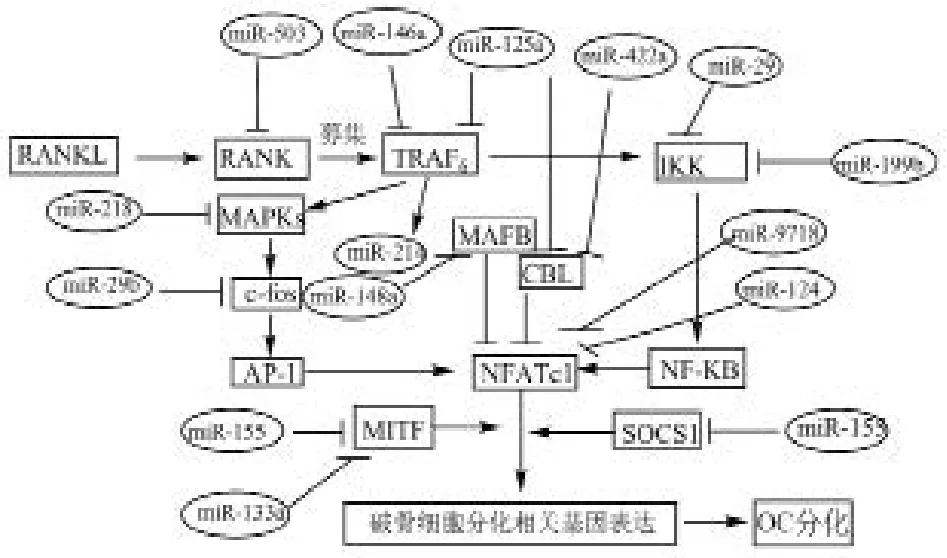
图1 RANKL / RANK 信号通路图与调节相关靶点的 miRNA(注:表示抑制, 表示促进或者信号传导过程)Fig.1 RANKL / RANK signaling pathways and the role of miRNAs in regulating related targe (Annotations:suppression, the process of promoting or signaling)
2. 调节 RANKL / RANK 信号通路的 miRNA:miR-503通过靶点 RANK 抑制破骨细胞分化,Chen 等[11]发现在绝经后骨质疏松妇女的 CD14+PBMCs 细胞中 miR-503 的表达显著减少,体外实验显示过表达 miR-503 的显著抑制RANKL 诱导 CD14+PBMCs 分化为破骨细胞,通过生物信息学分析发现 RANK 是 miRNA503 的直接靶点,miR-503-5p 端与 RNAK mRNA 的 3’-UTR 区结合抑制 RANK蛋白的翻译,从而抑制破骨细胞分化。
TRAF6 是破骨细胞分化中的关键靶点,TRAF6 基因敲除的小鼠患严重的骨石化病且骨吸收功能减弱。Guo等[12]研究表明 miRNA-125a 下调 TRAF6 的表达,进而显著降低 NFATc1 的表达抑制破骨细胞分化。在脂多糖刺激的人单核细胞白血病细胞系 (monocytic leukemia cell line,THP-1) 细胞中,过表达的 miR-146a 抑制 TRAP6 的蛋白翻译[13]另外,有学者发现 miR-146a 的直接靶点是转录信号传感器 1 (signal transducer and activator transcription 1,STAT1),miR-146a 抑制 STAT1 表达,STAT1 抑制 SOCS1的表达,从而促进破骨细胞的分化[14]。
NF-κB 通路是调节破骨细胞分化的重要通路,研究发现在破骨细胞分化过程中 miR-212 / 132 簇 和 miR-99b /let-7e / 125a 簇显著上调[15]。Zhou 等[16]用荧光素报告体研究发现 miR-199b 的直接靶点是 IKKβ,过表达的 miR-199b 与 IKKβ 的 3’-UTR 区结合,抑制 IKKβ 的翻译过程,阻断了 NF-κB 的活化。
NFATc1 是一个核转录因子,受多种 miRNA 的直接或间接调控,包括 miR-148a 和 miR-124 等,Cheng 等[17]发现在 M-CSF 和 RANKL 诱导的 CD14+PBMCs 分化破骨细胞的过程中,miR-148a 的表达显著上升,通过生物信息学分析发现 miR-148a 的直接靶点是 MAFB,miR-148a抑制 MAFB 蛋白的翻译过程,MAFB 负性调节 NFATc1 的表达。Lee 等[18]研究发现在 BMMs 分化为破骨细胞过程中,miR-124 显著的抑制 NFATc1 的表达,进而抑制破骨细胞的分化。另外,有学者报道,有些 miRNA 可以调节 NFATc1 的表达或者通过靶点干扰 NFATc1 与破骨细胞 DNA 的结合调控破骨细胞的分化。Zhang[19]研究发现INF-β 可以诱导 miRNA-155 的表达,miR-155 通过抑制靶点 MITF 和 SOCS1 的表达减弱 NFATc1 与 DNA 结合抑制破骨细胞的分化。Rossi 等[20]报道 miR-29b 可以抑制人破骨细胞的分化和功能,其作用机制是通过抑制 NFATc1信号募集的促进剂 c-fos 表达。Cao 等[21]研究表明 miR-422a 在骨密度较低的绝经后妇女当中显著上调,且发现miR-422a 的表达与 5 个破骨细胞分化相关基因 (CBL、CD226、IGF1、PAG1、TOB2) 呈负性相关,其中 CBL 是NFATc1 表达的促进剂。
另外,有些 miRNA 通过其它靶点调节 NFATc1 的表达影响破骨细胞的分化,Liu 等[22]发现 miR-9718 通过抑制靶点 PIAS3 的表达抑制 NFATc1 的效应,从而抑制破骨细胞分化。在 RANKL 诱导 BMMs 和 RAW264.7 细胞分化为破骨细胞的过程中,miR-218 的表达显著降低,且过表达的 miR-218 显著抑制破骨细胞的分化,进一步研究其机制发现 MAPKs 是 miR-218 的靶点,miR-218 通过调控p38MAPK-c-Fos-NFATc1 通路抑制破骨细胞分化[23]。
3. 调节 OPG / RANKL 系统平衡的 miRNA:OPG /RANKL 系统是调节破骨细胞分化和骨代谢的重要通路,也是药物抗骨质疏松的重要机理。Lyu 等[24]报道女贞子醇提物显著的增加雌性大鼠的骨密度和改善骨性能,且显著的减少体内体外 RANKL / OPG 的比率。Ge 等[25]研究证实 miR-31 能调控 runx2-mir-31-satb2 环路,导致 RANKL /OPG 和 RANKL / RANK 比率降低进而使破骨细胞失活和抑制骨基质重塑。Pitari 等[26]证实 miR-21 可以调控 RANKL /OPG 的平衡减弱成熟破骨细胞的活性。
三、雌激素受体 (estrogen receptor,ER) 信号通路与相关 miRNA
1. ER 信号传导过程:在破骨细胞的功能研究中,雌激素常作为阳性对照药物,显著的抑制破骨细胞的分化和骨吸收功能。雌激素是一类甾体类化合物,雌激素通过 ER 直接调控 (或者通过 FasL 旁路机制) 破骨细胞的凋亡,或者直接抑制破骨细胞的分化和骨吸收功能[8]。ER属于核转录因子[27],具有 ERα 和 ERβ 两种亚型,ERα / β以同源或异源二聚体的形式,与靶基因上的相应序列(estrogen response element,ERE) 相结合调节基因的转录过程[28]。破骨细胞分化越成熟,细胞核增多,ER 的表达下降[7]。雌激素与 ER 结合激活 ER,激活的 ER 通过以下三种方式介导调节破骨细胞的分化:(1) 直接与靶基因上的 ERE 位点结合,增强或者抑制基因的转录活性[8];(2)同其它转录因子 (NF-κB、c-fos / c-Jun) 结合,调节转录因子与细胞因子基因启动的调节位点 (NF-κB、AP-1、SP-1) 结合,进而影响细胞因子基因的转录活性[8];(3)调节某些 miRNA 的表达,通过 miRNA 抑制 OC 分化相关因子的表达抑制破骨细胞分化[29]。
2. 调节 ER 的 miRNA:Chen 等[11]体内实验研究表明雌激素通过 ER 可以显著升高 miR-503 的表达,抑制RANK 的表达,故 ER 可能是通过 miR-503 调节 RANK 的表达。由此形成 ER / miR503 / RANK 信号通路,将雌激素信号传导与 RANKL / RANK 系统联系在一起。
Castellano 等[30]发现 ER 可以调控位于 13 号染色体q31-q32 区域的 miR-17-92 家族的表达,该区域的基因具有多顺反子的特点,该家族包括 6 个 miRNAs (miR-17,miR-18a,miR-19a,miR-20a,miR-19b-1 和 miR-92-1),ER 可以上调 pri-miR17-92 的表达,从而增加了 miR-17-92 家族成熟 miRNA 的表达,而 miR-17-92a 可以抑制成骨细胞的凋亡[6]。Pandey 等[31]研究发现 ERα 有很长的3’-UTR 区,miR-22 作用于靶点 ERα 显著抑制 ERα 的翻译水平。Sugatani 等[32]报道雌激素下调 miR-21 的表达,miR-21 作用于靶点 FasL,使 FasL 蛋白表达升高,从而诱导破骨细胞的凋亡。在 OC 分化过程中,转录因子 c-fos上调 miR-21 的表达水平,miR-21 作用于靶点程序性凋亡基因 4 (PDCD4) 的 3’-UTR 区,下调 PDCD4 的蛋白表达,而 PDCD4 会抑制 c-fos 的表达[29]。Fujita 等[33]也证实了 AP-1 可以上调 miR-21 的表达,而 c-fos 蛋白是 AP-1的主要成分,如此形成一个以 ER 和 miR-21 为中心调节破骨细胞形成和凋亡的网络 (图2)。
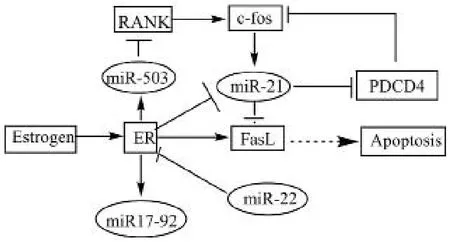
图2 ER 信号通路与调节相关靶点的 miRNA (注:表示抑制, 表示促进或者信号传导过程)Fig.2 ER signaling pathways and miRNAs regulating related targets(Annotations:suppression, the process of promoting or signaling)
四、调节破骨细胞分化的其它 miRNA
调节破骨细胞分化和骨吸收的 miRNA 种类繁多,除了上述 RANK 和 ER 两条通路上的 miRNA 外,还包括 miR-7b[34]、miR-26a[35]、miR-133a[36]、miR-33a[37]、miR-214[38]、miR-31[39]等。
其中 miR-7b、miR-26a、miR-133a、miR-33a 等对破骨细胞的分化具有负性调节效应。Dou 等[34]报道树突状细胞特异性跨膜蛋白 (dendritic cell-specific transmembrane protein,DC-STAMP) 是 miR-7b 的直接靶点,miR-7b 通过 DC-STAMP 靶点抑制 NFATc1 和 c-fos 信号通路从而抑制破骨细胞前体的融合和分化。Kim 等[35]研究发现在 RANKL 诱导的破骨细胞分化过程中 miR-26a 的表达上升,且过表达的 miR-26a 抑制破骨细胞分化,进一步研究发现 miR-26a 抑制结缔组织生长因子 (connective tissue growth factor,CTGF) 的表达,而 CTGF 通过上调DC-STAMP 表达促进破骨细胞的分化。Wang 等[36]用miRNA 微阵列分析技术发现在破骨细胞分化中 miR-133a表达显著上调,通过生物信息学分析发现 miR-133a 的靶点为 3 个破骨细胞分化相关基因 (CXCL11,CXCR3 和SLC39A1),并指出 miR-133a 可作为绝经后妇女骨质疏松诊断的生物学指标。Kou 等[37]研究发现 miR-33a 的水平与 PTHrP 表达呈负相关,PTHrP 是一种骨吸收的促进剂,深入研究发现 miR-33a 抑制 PTHrP 的表达从而减少了 IL-8 的分泌,抑制破骨细胞分化和骨吸收。
而 miR-214、miR-31a 则促进破骨细胞的分化。Zhao等[38]研究发现 miR-214 在 M-CSF 和 RANKL 诱导 BMMs分化为破骨细胞过程中表达显著上升,miR-214 通过调节 PTEN / P13k / Akt 信号通路促进破骨细胞的分化。有文献报道在 RANKL 诱导的破骨细胞分化中 miR-31 的表达显著上升,拮抗 miR-31 的功能破骨细胞的分化被显著抑制,另外,加入 miR-31 靶点 RhoA 的抑制剂可以减弱miR-31 导致的抑制破骨细胞分化的效应,表明 miR-31 是通过靶点 RhoA 调节破骨细胞分化的[39]。
破骨细胞的分化成熟是一个极其复杂的过程,受到多种细胞因子的调控,这些细胞因子作用于破骨细胞受体,激活膜受体引起某些细胞因子的募集或者激活细胞因子由胞质向细胞核转移的过程。然而,调节破骨细胞分化的细胞因子或者受体绝大多数受到 miRNA 的调控,各种 miRNA 的生物学功能表达趋势并非一致的,且这些miRNA 作用靶点或者机制并不是完全清楚。故从 miRNA层面研究破骨细胞分化的机制有重要的意义,部分功能确切作用机制清楚的 miRNA 可作为骨质疏松、骨损伤等疾病诊断的生物学指标,并为骨代谢疾病的治疗提供了新的方向。
参 考 文 献
[1]Takayanagi H, Kim S, Koga T, et al. Induction and activation of the transcription factor NFATc1 (NFAT2) integrate RANKL signaling in terminal differentiation of osteoclasts[J]. Dev Cell,2002, 3(6):889-901.
[2]Di Martino MT, Amodio N, Tassone P, et al. Functional Analysis of microRNA in multiple myeloma[J]. Methods Mol Biol, 2016, 1375:181-194.
[3]刘国印, 王瑞, 赵建宁. MicroRNA 与骨代谢相关疾病[J]. 中华骨质疏松和骨矿盐疾病杂志, 2013, 6(4):356-360.
[4]Xia Z, Chen C, Chen P, et al. MicroRNAs and their roles in osteoclast differentiation[J]. Front Med, 2011, 5(4):414-419.
[5]Guo L, Xu J, Qi J, et al. MicroRNA-17-92a upregulation by estrogen leads to Bim targeting and inhibition of osteoblast apoptosis[J]. J Cell Sci, 2013, 126(4):978-988.
[6]Lian JB, Stein GS, van Wijnen AJ, et al. MicroRNA control of bone formation and homeostasis[J]. Nat Rev Endocrinol, 2012,8(4):212-227.
[7]Xu D, Lyu Y, Chen X, et al. Fructus Ligustri Lucidi ethanol extract inhibits osteoclastogenesis in RAW264.7 Cells via the RANKL signaling pathway[J]. Mol Med Rep, 2016, 14(5):4767-4774.
[8]肖建德, 阎德文. 实用骨质疏松学[M]. 科学出版社. 2012: 46.
[9]Asagiri M, Takayanagi H. The molecular understanding of osteoclast differentiation[J]. Bone, 2007, 40(2):251-264.
[10]黄晓斌, 孙元明, 李雨民, 等. 破骨细胞分化成熟因子及其信号转导通路[J].中国骨质疏松杂志, 2007, 11:803-808.
[11]Chen C, Cheng P, Xie H, et al. MiR-503 regulates osteoclastogenesis via targeting RANK[J]. J Bone Miner Res, 2014,29(2):338-347.
[12]Guo LJ, Liao L, Yang L, et al. MiR-125a TNF receptorassociated factor 6 to inhibit osteoclastogenesis[J]. Exp Cell Res, 2014, 321(2):142-152.
[13]Taganov KD, Boldin MP, Chang KJ, et al. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA, 2006; 103(33):12481-12486.
[14]Yao Y, Jia T, Pan Y, et al. Using a novel microRNA delivery system to inhibit osteoclastogenesis[J]. Int J Mol Sci, 2015,16(4):8337-8350.
[15]De la Rica L, García-Gómez A, Comet NR, et al. NF-κB-direct activation of microRNAs with repressive effects on monocytespecific genes is critical for osteoclast differentiation[J]. Genome Biol, 2015, 5(16):2-17.
[16]Zhou HJ, Wang LQ, Xu QS, et al. Downregulation of miR-199b promotes the acute spinal cord injury through IKKβ-NF-κB signaling pathway activating microglial cells[J]. Exp Cell Res, 2016, 349(1):60-67.
[17]Cheng P, Chen C, He H, et al. miR-148a regulates osteoclastogenesis by targeting V-maf musculoaponeurotic fibrosarcoma oncogene homolog B[J]. J Bone Miner Res, 2013,28(5):1180-1190.
[18]Lee Y, Kim HJ, Park CK, et al. MicroRNA-124 regulates osteoclast differentiation[J]. Bone, 2013, 56(2):383-389.
[19]Zhang J, Zhao H, Chen J, et al. Interferon-β-induced miR-155 inhibits osteoclast differentiation by targeting SOCS1 and MITF[J]. Febs Lett, 2012, 586(19):3255-3262.
[20]Rossi M, Pitari MR, Amodio N, et al. miR-29b negatively regulates human osteoclastic cell differentiation and function:Implications for the treatment of multiple myeloma-related bone disease[J]. J Cell Physiol, 2013, 228(7):1506-1515.
[21]Cao Z, Moore BT, Wang Y, et al. MiR-422a as a potential cellular microRNA biomarker for postmenopausal osteoporosis[J]. Plos One, 2014, 5(9):97098-97104.
[22]Liu T, Qin A, Liao B, et al. A novel microRNA regulates osteoclast differentiation via targeting protein inhibitor of activated STAT3 (PIAS3)[J]. Bone, 2014, 67(10):156-165.
[23]Qu B, Xia X, Yan M, et al. miR-218 is involved in the negative regulation of osteoclastogenesis and bone resorption by partial suppression of p38MAPK-c-Fos-NFATc1 signaling: Potential role for osteopenic diseases[J]. Exp Cell Res, 2015, 338(1):89-96.
[24]Lyu Y, Feng X, Zhao P, et al. Fructus Ligustri Lucidi (FLL)ethanol extract increases bone mineral density and improves bone properties in growing female rats[J]. J Bone Miner Metab,2013, 32(3):616-626.
[25]Ge J, Guo S, Fu Y, et al. Dental follicle cells participate in tooth eruption via the RUNX2-MiR-31-SATB2 loop[J]. J Dent Res,2015, 94(7):936-44.
[26]Pitari MR, Rossi M, Amodio N, et al. Inhibition of miR-21 restores RANKLIOPG ratio in multiple myeloma-derived bone marrow stromal cells and impairs the resorbing altivity of mature osteodasts[J]. Oncotarget, 2015, 6(29):27343-27358.
[27]李劲平, 李伟娟, 曾英, 等. 壮骨止痛胶囊抗绝经后骨质疏松的 ERRα 作用机制研究[J]. 中国现代应用药学, 2016,(6):690-694.
[28]O’Donnell L, Robertson KM, Jones ME, et al. Estrogen and Spermatogenesis[J]. Eedocr Rev 2001, 22(3):289-318.
[29]Sugatani T, Vacher J, Hruska KA. A microRNA expression signature of osteoclastogenesis[J]. Blood, 2011, 117(13):3648-3657.
[30]Castellano L, Giamas G, Jacob J, et al. The estrogen receptor-induced microRNA signature regulates itself and its transcriptional response[J]. PNAS, 2009, 106(37):15732-15737.
[31]Pandey DP, Picard D. miR-22 inhibits estrogen signaling by directly targeting the estrogen receptor mRNA[J]. Mol Cell Biol, 2009, 29(13):3783-3790.
[32]Sugatani T, Hruska KA. Down-regulation of miR-21 biogenesis by estrogen action contributes to osteoclastic apoptosis[J].J Cell Biochem, 2013, 114(6):1217-1222.
[33]Fujita S, Ito T, Mizutani T, et al. miR-21 gene expression triggered by AP-1 is sustained through a double-negative feedback mechanism[J]. J Mol Biol, 2008, 378(3):492-504.
[34]Dou C, Zhang C, Kang F, et al. MiR-7b directly targets DCSTAMP causing suppression of NFATc1 and c-Fos signaling during osteoclast fusion and differentiation[J]. Biochimica Et Biophysica Acta, 2014, 1839(11):1084-1096.
[35]Kim K, Kim JH, Kim I, et al. MicroRNA-26a regulates ranklinduced osteoclast formation[J]. Mol Cells, 2015, 38(1):75-80.[36]Wang Y, Li L, Moore BT, et al. MiR-133a in human circulating monocytes: a potential biomarker associated with postmenopausal osteoporosis[J]. PLoS One, 2012, 7(4):e34641-34648.
[37]Kou PL, Liao SH, Hung JY, et al. MicroRNA-33a functions as a bone metastasis suppressor in lung cancer by targeting parathyroid hormone related protein[J]. Biochimica Biophysica Acta, 2013, 1830(6):3756-3766.
[38]Zhao C, Sun W, Zhang P, et al. miR-214 promotes osteoclastogenesis by targeting pten / pi3k / akt pathway[J]. RNA Biol,2015, 12(3):343-353.
[39]Mizoguchi F, Murakami Y, Saito T, et al. miR-31controls osteoclast formation and bone resorption by targeting rhoa[J].Arthritis Res Ther, 2013, 15(5):R102-109.

