富血小板纤维蛋白联合自体骨髓浓缩物修复骨缺损的早期疗效
杨颖,刘国,刘传通,金琼,朱飞
(温州医科大学 口腔医学院,浙江 温州 325027)
目前,临床中用于解决颌面部缺损骨重建的方法是使用自体骨、同种异体骨或异种骨等骨替代物诱导新骨生成,但这几种材料有其各自的不足。如作为骨替代材料“金标准”的自体骨在数量及大小上常不能满足缺骨区的要求,还会增加骨供区的病理损害[1],而同种异体骨和异种骨成骨作用较弱[2-3],有再吸收及病毒传播的风险[4],因此有必要寻求一种更好的方法来解决骨量不足的问题。
富血小板纤维蛋白(platelet-rich fibrin,PRF)是第二代血小板浓缩物,富含血小板及各种细胞因子,具有促进组织愈合的能力,同时还含有抗炎因子和修复介质,具有调节炎症反应和抗感染的能力。自体骨髓浓缩物(bone marrow aspirate concentrate,BMAC)是通过对骨髓抽吸物离心、分离后获得的有核细胞的浓缩物,其内富含骨髓间充质干细胞(bone marrow stem cell,BMSC)、造血干细胞和淋巴细胞,被誉为骨替代材料的“铂金标准”[5]。本研究将PRF与BMAC联合应用于兔颅骨缺损,观察其成骨能力,为其在临床中的应用提供参考。
1 材料和方法
1.1 实验动物 12~16月龄健康日本大耳白兔6只,体质量1.5~2.0 kg,雌雄不限,由温州医科大学实验动物中心提供并饲养,动物使用许可证号:SYXK(浙)2014-0006。
1.2 实验方法
1.2.1 PRF的制备:采用CHOUKROUN等[6]提出的方法:兔心脏取血5 mL,放入不添加抗凝剂的离心管中,3 000 r/min的速度离心10 min。血液样本分为3层(见图1),中间层为乳白色的纤维蛋白凝胶(即PRF),上层和下层分别是贫血小板血浆层和红细胞碎片层,取中间层,无菌纱布挤压后剪成约1 mm×1 mm大小备用,另取一份压成膜片行组织学分析。

图1 PRF的制取
1.2.2 BMAC的制备:以含有0.2 mL肝素钠(100 mg/L)的5 mL注射器,于兔双侧股骨处使用16号骨髓穿刺针各抽取骨髓2.5 mL,3 000 r/min离心10 min,可见骨髓分为3层(见图2),上层为淡黄色浆液层,中间为黄褐色有核细胞层,下层为深红色细胞层,用注射器抽取中间层(约1 mL)与PRF混合备用。

图2 BMAC的制取
1.2.3 动物模型制备:实验动物称重,3%戊巴比妥钠注射液按1 mL/kg剂量耳缘静脉麻醉适度后,颅顶备皮。2%盐酸利多卡因局部麻醉下于颅顶正中纵行切开皮肤并逐层分离,暴露颅中缝。0.9%氯化钠溶液冲洗冷却下使用环锯于颅中缝两侧各制备2个直径为5 mm的圆形骨缺损,随机植入空白(A组)、自体骨沫(B组)、PRF+BMAC混合物(C组,见图3),钛膜覆盖固定,分层缝合,10 d后拆线,术后肌注庆大霉素注射液1周(8×104U/d)。
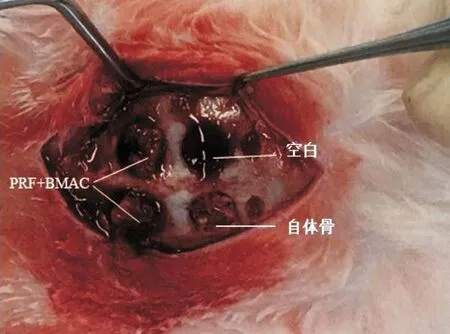
图3 骨缺损模型制备及骨移植材料填入
1.3 观测指标 术后6周处死实验兔,取颅骨标本行影像学观察。PRF制做冰冻切片,HE染色,行组织学评价。计算骨缺损区的新骨生成率:取经过圆形骨缺损中心点的组织学切片进行观测,以骨缺损边缘为外边界,颅骨外板为上边界,颅骨内板为下边界,40倍光镜下,使用Image-Pro Plus 6.0软件测量该区域的总面积以及该区域内新生骨面积,各测量3次,取平均值,计算骨缺损区的新骨生成率。
1.4 统计学处理方法 使用SPSS17.0软件进行统计分析。计量资料以±s表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 大体观察 实验动物无一例死亡,术后2 d实验兔饮食及生活习性恢复正常,骨缺损区域均无感染,创口愈合良好,钛膜无移位。
2.2 影像学观察结果 A组:骨缺损区基本无变化,骨缺损边缘可见散在不透射影。B组:可观察到骨缺损形状,骨缺损自边缘至中央可见大量低灰度不透射影。C组:骨缺损边缘及中央均为低灰度不透射影像,彼此连接成桥状,尤其是边缘与周围基骨已无明显区别。见图4。
2.3 组织学观察结果
2.3.1 PRF评价结果:PRF为乳白色胶冻样团块,具有一定的弹性和韧性。光镜观察PRF膜片上端为染色均一的网状纤维蛋白结构,呈条索状,疏松多孔,未见任何细胞;下端可观察到少量细胞核蓝染的白细胞镶嵌在纤维蛋白网内。见图5。

图4 影像学观察结果

图5 PRF膜片组织学观察(HE染色)
2.3.2 骨缺损区组织学结果:6周时组织学切片示:A组骨缺损区以纤维结缔组织为主,骨缺损边缘可见少量成骨细胞和新骨生成。B组骨缺损区内可见大量不规则形状的自体骨颗粒,并以自体骨颗粒为中心有新骨形成。与A组相比,骨缺损边缘新生骨量更多,骨质更致密。C组骨缺损区可见大量新生骨,骨小梁排列规则紧密,且矿化程度较高,成骨细胞数量较A组和B组多,新生骨组织不仅局限于骨缺损边缘,骨缺损中央也有大量新骨生成。见图6。
2.3.3 统计学处理结果:6周时A组新骨生成率为(7.64±1.02)%,B组为(12.94±0.81)%,C组为(37.19±1.26)%,C组与A、B组比较,差异均有统计学意义(P<0.05)。
3 讨论
PRF于2000年被成功制取并应用于口腔颌面部组织再生治疗,其制备过程简单易行,完全取自自体,且不添加抗凝剂及促凝剂,避免了交叉感染的风险,使用安全。有学者[7]提出,获取PRF的技术关键在于血液的收集速度和放入离心机的速度。而兔模型因其动静脉血管细小,很难快速收集到足够的血液,本研究摒弃常规耳缘静脉取血的方法,采用心脏取血的方法,证实能够快速获取足量的血液并成功制取PRF。也有学者对PRF的生物学特性进行了鉴定[8-10],结果证明PRF的主体结构为纤维蛋白构成的三维网状结构,内含血小板、各种生长因子及少量免疫细胞。本研究将成功制取的PRF制作冰冻组织学切片,证实了PRF的三维网状纤维蛋白结构及含有少量白细胞的事实,但白细胞仅存于PRF层与红细胞碎片层交界处,因此应在制取PRF时将交界处组织一并取出。
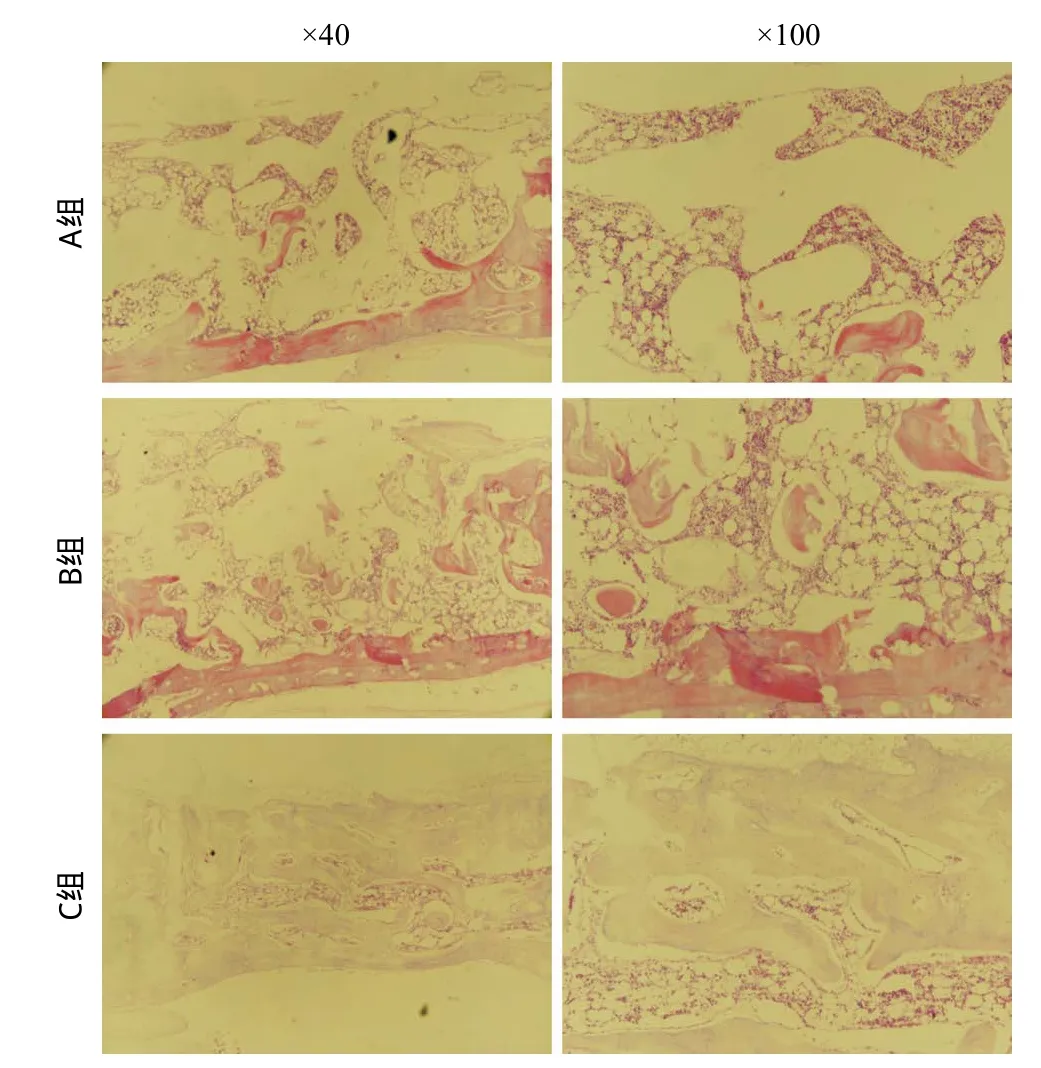
图6 术后6周组织学观察(HE染色)
自体骨髓含有促进骨再生的干细胞和骨祖细胞[11-13],且其促进骨组织再生的能力与骨髓细胞的浓度成正相关[14]。BMAC是将自体骨髓通过离心、分离后获得的有核细胞的浓缩物,与人工培养增殖的BMAC相比避免了污染的风险,且未培养的骨髓来源的细胞在骨组织再生中也表现出了更大的优势[15-17]。在笔者之前的研究中,采用离心后人工分离制取BMAC的方法可获得的细胞浓缩倍数为2~3倍,且细胞培养结果表明BMAC内的细胞具有干细胞的特性[18],本研究采用该方法可成功获取BMAC。
在以往的研究中,单独应用PRF促进骨组织再生的效果有一定的局限,联合其他骨替代材料往往可以获得较理想的骨再生效果。OLIVEIRA等[19]将PRF单独或联合Bio-oss骨粉用于修复大鼠颅骨缺损,结果表明30 d时PRF联合Bio-oss组获得了远高于其他组的新骨生成率。然而,骨替代材料的添加同时也增加了免疫及病毒传播的风险,本研究将PRF复合BMAC用于修复兔颅骨缺损,新骨生成率远大于自体骨组及空白对照组。该结论与WU等[20]的研究结果基本一致。PRF独特的三维网格状纤维蛋白结构能将骨髓干细胞网络其中,并引导其迁移[21];同时PRF较大的孔隙和良好的弹性,能够促使营养成分及氧气弥散至细胞周围,促进干细胞的增殖分化,加速成骨过程[22]。
综上,本研究探讨了PRF联合BMAC修复骨缺损的方法,二者能共同发挥作用,有效促进骨缺损的早期愈合,为临床中自体骨移植量不足或不能接受同种异体骨及异种骨移植的患者提供了新的选择。
参考文献:
[1] DIMITRIOU R, MATALIOTAKIS G I, ANGOULES A G,et al. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review[J]. Injury, 2011, 42(2): S3-15.
[2] FINKEMEIER C G. Bone-grafting and bone-graft substitutes[J]. J Bone Joint Surg Am, 2002, 84-A(3): 454-464.
[3] COLNOT C, ROMERO D M, HUANG S, et al. Mechanisms of action of demineralized bone matrix in the repair of cortical bone defects[J]. Clin Orthop Relat Res, 2005(435):69-78.
[4] BUCK B E, RESNICK L, SHAH S M, et al. Human immunodeficiency virus cultures from bone. Implications for transplantation[J]. Clin Orthop Relat Res, 1990(251): 249-253.
[5] SOLTAN M, SMILER D G, GAILANI F. A new “platinum”standard for bone grafting: autogenous stem cells[J]. Implant Dent, 2005, 14(4): 322-325.
[6] CHOUKROUN J, ADDA F, SCHOEFFLER C, et al. Une opportunité en paro-implantologie: le PRF[J]. Implantodontie, 2000, 42: 55-62.
[7] DOHAN E D M, LEMO N, JIMBO R, et al. Selecting a relevant animal model for testing the invivo effects of Choukroun’ s platelet-richfibrin (PRF): rabbit tricks and traps[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2010,110(4): 413-416.
[8] 丁俐丹, 胡赟, 唐世俊, 等. 富血小板纤维蛋白生物学特性鉴定及其对脂肪干细胞增殖和分化的影响[J]. 上海交通大学学报(医学版), 2017, 37(5): 601-605.
[9] DOHAN E D M, PINTO N R, PEREDA A, et al. The impact of the centrifuge characteristics and centrifugation protocols on the cells, growth factors, and fibrin architecture of a leukocyte- and platelet-rich fibrin (L-PRF) clot and membrane[J]. Platelets, 2018, 29(2): 171-184.
[10] MADURANTAKAM P, YOGANARASIMHA S, HASAN F K. Characterization of leukocyte-platelet rich fibrin, a novel biomaterial[J]. J Vis Exp, 2015, 103: e53221.
[11] QUARTO R, MASTROGIACOMO M, CANCEDDA R,et al. Repair of large bone defects with the use of autologous bone marrow stromal cells[J]. N Engl J Med, 2001, 344(5):385-386.
[12] MARCACCI M, KON E, MOUKHACHEV V, et al. Stem cells associated with macroporous bioceramics for long bone repair: 6- to 7-year outcome of a pilot clinical study[J].Tissue Eng, 2007, 13(5): 947-955.
[13] LEE J, SUNG H M, JANG J D, et al. Successful reconstruction of 15-cm segmental defects by bone marrow stem cells and resected autogenous bone graft in central hemangioma[J]. J Oral Maxillofac Surg, 2010, 68(1): 188-194.
[14] HERNIGOU P, POIGNARD A, BEAUJEAN F, et al. Percutaneous autologous bone-marrow grafting for nonunions. Influence of the number and concentration of progenitor cells[J]. J Bone Joint Surg Am, 2005, 87(7): 1430-1437
[15] CHANG F, ISHII T, YANAI T, et al. Repair of large fullthickness articular cartilage defects by transplantation of autologous uncultured bone-marrow-derived mononuclear cells[J]. J Orthop Res, 2008, 26(1): 18-26.
[16] HIGASHI Y, KIMURA M, HARA K, et al. Autologous bone-marrow mononuclear cell implantation improves endothelium-dependent vasodilation in patients with limb ischemia[J]. Circulation, 2004, 109(10): 1215-1218.
[17] UMEMURA T, NISHIOKA K, IGARASHI A, et al. Autologous bone marrow mononuclear cell implantation induces angiogenesis and bone regeneration in a patientwith compartment syndrome[J]. Circ J, 2006, 70(10): 1362-1364.
[18] 杨颖, 仲维剑, 刘国, 等. 自体骨髓浓缩物修复种植体周围的骨缺损[J]. 中国组织工程研究, 2014, 18(11): 1653-1658.
[19] OLIVEIRA M R, DEC SILVA A, FERREIRA S, et al. Influence of the association between platelet-rich fibrin and bovine bone on bone regeneration. A histomorphometric study in the calvaria of rats[J]. Int J Oral Maxillofac Surg, 2015,44(5): 649-655.
[20] WU C C, SHEU S Y, HSU L H, et al. Intra-articular Injection of platelet-rich fibrin releasates in combination with bone marrow-derived mesenchymal stem cells in the treatment of articular cartilage defects: An in vivo study in rabbits[J]. J Biomed Mater Res B Appl Biomater, 2017, 105(6):1536-1543.
[21] DOHAN D M, CHOUKROUN J, DISS A, et al.Platelet-rich fibrin (PRF): a secondgeneration platelet concentrate. Part I: technological concepts and evolution[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006, 101(3): e37-e44.
[22] PICARDI A, LANTI A, CUDILLO L, et al. Platelet gel for treatment of mucocutaneous lesions related to graft-versushost disease after allogeneic humatopoietic stem cell transplant[J]. Transfusion, 2010, 50(2): 501-506.

