磁共振体素内不相干运动成像评价糖尿病肾功能高滤过期的价值
周永进,叶信健,龚恩惠,黄小燕,崔诗浛,宋佳雯,刘锟,严志汉
(1.温州医科大学附属第二医院育英儿童医院 放射科,浙江 温州 325027;2.丽水市人民医院 呼吸科,浙江 丽水 323000)
糖尿病(diabetes mellitus,DM)导致的肾脏病变已成为引起临床终末期肾衰的首要病因,而在DM早期肾小球高滤过状态是渐进性发展为DM肾病的重要危险因素[1]。通常认为肾脏的高滤过状态出现在1型或2型DM发生的前几年[2],肾脏高滤过状态主要表现为肾小球滤过率(glomerular filtration rate,GFR)较正常人明显升高。随着高滤过状态的持续,肾脏血流动力学状态异常,肾功能进展性恶化,进而发展为糖尿病肾病(diabetic nephropathy,DN),继而导致终末期肾衰。目前临床评价肾功能的最常用方法是测量血清肌酐(serumcreatinine,Scr)和GFR,但该指标不能反映单一肾功能,且敏感性及特异性较低。因而寻找更准确、全面的评估方法是目前研究的热点。近年来,磁共振体素内不相干运动成像(introvoxel incoherent motion MR diffusion weighted imaging,IVIM-DWI)技术在肾脏的应用逐渐成熟。IVIM-DWI是一种基于多b值扩散成像、双指数拟合信号衰减曲线的新型扩散加权成像技术,通过模型中的扩散和灌注参数反映组织内水分子扩散与微循环灌注状态[3]。IVIM-DWI已经被广泛应用于临床及科研中,在肾脏亦显示出其价值[4-7],但目前国内对于其参数在DN的研究结果较少。本研究将IVIM-DWI技术应用于早期DM高滤过期患者肾脏功能评估,旨在通过影像学方面提供肾功能评估的新方法。
1 对象和方法
1.1 对象 2017年6月至2017年12月温州医科大学附属第二医院育英儿童医院内分泌科住院治疗的有明确诊断和临床分期的12例DM患者(DM组),DM患者确诊是依据美国糖尿病学会(American Diabetes Association,ADA)指南标准[8],至少有2年DM史。DM肾脏高滤过期的确定根据文献推荐以估计肾小球滤过率(estimated glomerular filtration rate,eGFR)≥120 mL·min-1·1.73 m-2为界限[9-10],eGFR计算公式为基于Scr的慢性肾病流行病学协作方程(chronic kidney disease epide-miology collaboration,CKD-EPI)[11]。记录所有DM患者的清晨空腹血糖、Scr、尿白蛋白、糖化血红蛋白(hemoglobin A1c,HbA1c)等实验室指标。纳入健康对照组(CON组)12例,无DM、肾脏疾病史,无高血压及相关任何药物使用史,尿常规、血常规、空腹血糖、肝肾功能均正常。排除标准:①磁共振检查禁忌证如幽闭恐惧证、金属内置物及心脏起搏器植入患者;②肾脏占位性病变包括肿瘤性病变及囊肿直径大于2 cm患者。在磁共振检查前对所有受检者严格禁食禁水3~4 h,以统一受检者的肾脏水合状态。本研究经医院伦理委员会批准,所有入选者均签署知情同意书。
1.2 方法
1.2.1 磁共振扫描:所有图像在GE Discovery MR750 3.0T磁共振扫描仪上获得,采用8通道体部线圈,所有序列扫描中心均定位于肾脏中心水平,受检者仰卧位,足先进。使用单次激发自旋平面回波序列(ss-EPI),采用呼吸触发技术采集IVIM图像,在肾周放置6条内置饱和带,扫描20个层面覆盖双侧肾脏,IVIM-DWI参数如下:TR/TE 5 000 ms/minimum,层厚/层间距5 mm/1 mm,FOV 28 cm×28 cm,矩阵128×128,激励次数(NEX)为2。IVIM-DWI肾脏扫描设置11个b值获取图像,分别为0、10、20、40、60、80、100、200、400、600、800 s/mm2,受被检者呼吸频率影响IVIM扫描时间为4~8 min。
1.2.2 图像后处理:获取的IVIM原始图像传入GE AW4.6工作站,利用内置MADC软件进行后处理分析,得到IVIM参数值D、DP、PF及ADC值。所有参数图像后处理由2名具有5年工作经验的放射科医师进行单独评估。所有参数图的ROI均置于双侧肾脏扫描中心层面的前唇、后唇及中部区域(见图1)。ROI置于皮质、髓质区域,皮质置于肾实质的外1/3。勾画ROI应注意避开肾盂、血管及局部伪影区域,记录每个ROI的平均值,对所有测得皮质、髓质ROI值取平均值,分别得到各参数左右肾皮、髓质平均值。最后,对2名观察者测得所有参数值进行平均后用于最终结果分析。
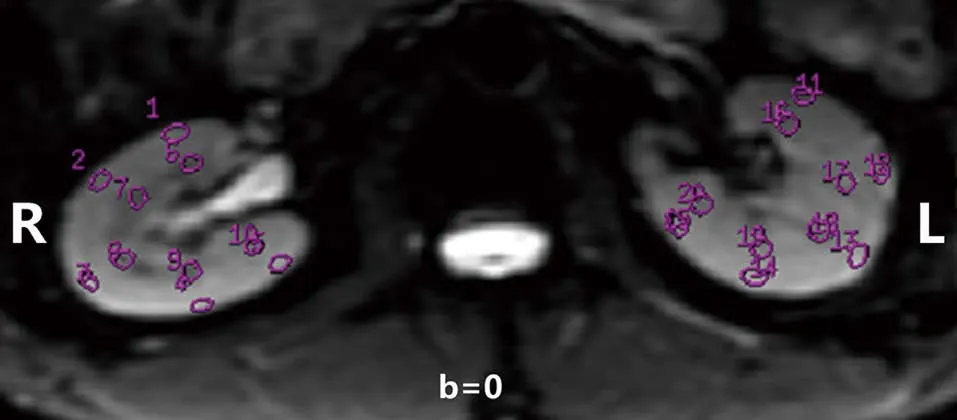
图1 1例51岁男性DM患者b=0时图像上的双肾ROI示意图
1.3 统计学处理方法 采用SPSS21.0软件包进行统计学分析。2名观察者间所有受检者各参数的测量值利用组内相关系数(intraclass correlation coefficient,ICC)进行一致性评估,ICC值大于0.75认为观察者间重复一致良好[12]。根据观察者测得数据计算变异系数(coefficient of variation,CV)以评估参数值的稳定性。利用Shapiro-Wilk检验对所有参数值及临床指标值进行正态性及方差齐性检验。2组计量数据符合正态分布,以±s表示,运用两独立样本t检验进行比较。2组计数资料采用χ2检验。运用Spearman相关检验对所有参数值和eGFR进行相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 2组一般资料比较 DM组eGFR值均高于120 mL·min-1·1.73 m-2,且明显高于CON组(P<0.01);DM组清晨空腹血糖值高于CON组,并且CON组空腹血糖值范围小于6.1 mmol/L;CON组尿白蛋白定量均为阴性。见表1。
2.2 2个观察者间所测参数的一致性评价 2个观察者测得的所有参数的ICC值在0.764~0.874间,2个观察者间一致性均良好。2个观察者测得ADC值和D值的CV均小于9%,而灌注相关参数PF值、DP值的CV值均大于13%(13.4%~45.0%)。见表2。
2.3 2组间IVIM-DWI参数比较及其与临床指标的相关性 DM组皮质和髓质的ADC、D及PF值明显高于CON组,差异有统计学意义(P<0.05);2组间DP值差异无统计学意义(P>0.05)(见表3)。肾脏皮质D值与eGFR之间存在显著正相关(r=0.581,P=0.047),其余参数与eGFR间均无相关性(P>0.05)。
表1 2组一般资料比较(n=12, ±s)
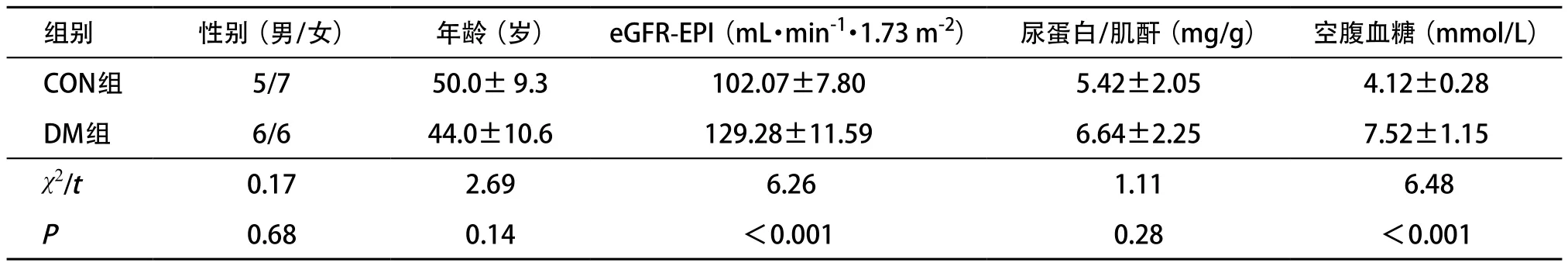
表1 2组一般资料比较(n=12, ±s)
组别 性别(男/女) 年龄(岁) eGFR-EPI(mL·min-1·1.73 m-2) 尿蛋白/肌酐(mg/g) 空腹血糖(mmol/L)CON组 5/7 50.0± 9.3 102.07±7.80 5.42±2.05 4.12±0.28 DM组 6/6 44.0±10.6 129.28±11.59 6.64±2.25 7.52±1.15 χ2/t 0.17 2.69 6.26 1.11 6.48 P 0.68 0.14 <0.001 0.28 <0.001
表2 2个观察者间所测参数的一致性评价(n=24,±s)
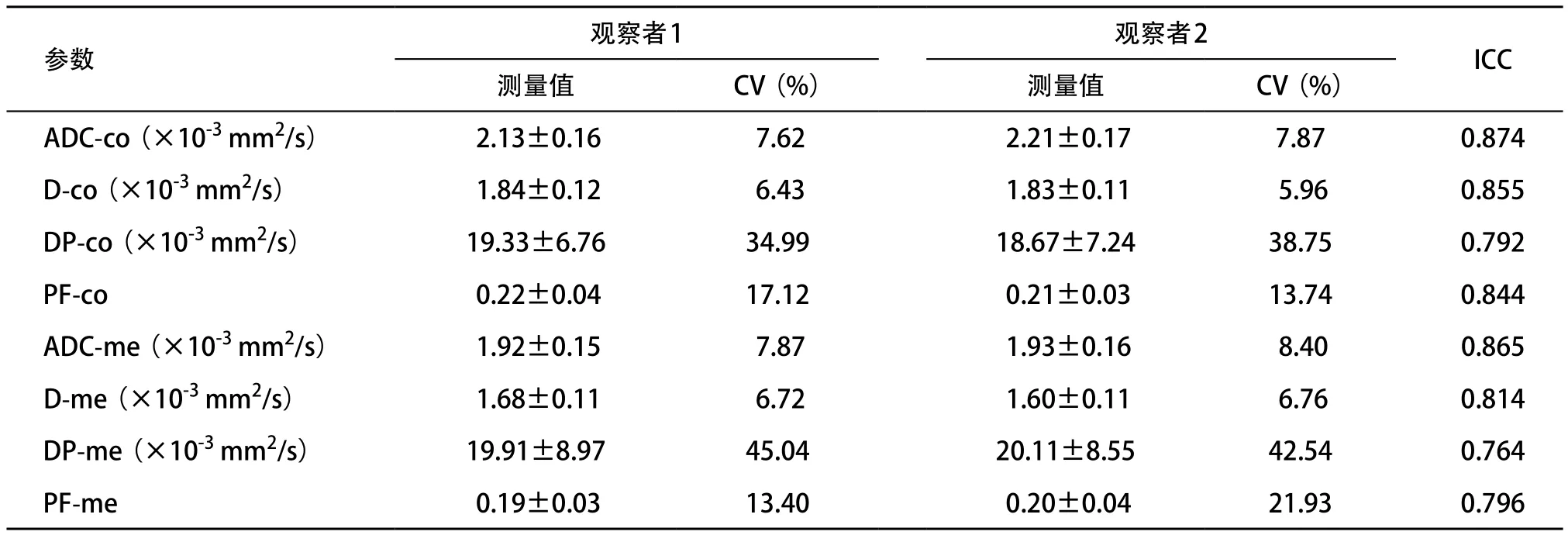
表2 2个观察者间所测参数的一致性评价(n=24,±s)
注:-co表示皮质,-me表示髓质
观察者1 观察者2 ICC测量值 CV(%) 测量值 CV(%)ADC-co(×10-3 mm2/s) 2.13±0.16 7.62 2.21±0.17 7.87 0.874 D-co(×10-3 mm2/s) 1.84±0.12 6.43 1.83±0.11 5.96 0.855 DP-co(×10-3 mm2/s) 19.33±6.76 34.99 18.67±7.24 38.75 0.792 PF-co 0.22±0.04 17.12 0.21±0.03 13.74 0.844 ADC-me(×10-3 mm2/s) 1.92±0.15 7.87 1.93±0.16 8.40 0.865 D-me(×10-3 mm2/s) 1.68±0.11 6.72 1.60±0.11 6.76 0.814 DP-me(×10-3 mm2/s) 19.91±8.97 45.04 20.11±8.55 42.54 0.764 PF-me 0.19±0.03 13.40 0.20±0.04 21.93 0.796参数
表3 2组IVIM-DWI参数比较(n=12, ±s)
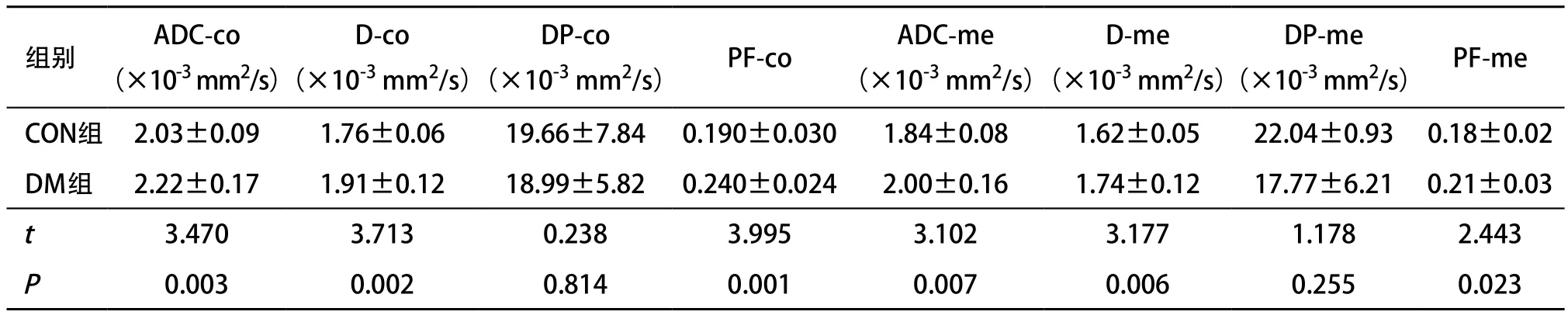
表3 2组IVIM-DWI参数比较(n=12, ±s)
注:-co表示皮质,-me表示髓质
组别 ADC-co(×10-3 mm2/s)D-co(×10-3 mm2/s)(×10-3 mm2/s) PF-co ADC-me(×10-3 mm2/s)DP-co D-me(×10-3 mm2/s)DP-me(×10-3 mm2/s) PF-me CON组 2.03±0.09 1.76±0.06 19.66±7.84 0.190±0.030 1.84±0.08 1.62±0.05 22.04±0.93 0.18±0.02 DM组 2.22±0.17 1.91±0.12 18.99±5.82 0.240±0.024 2.00±0.16 1.74±0.12 17.77±6.21 0.21±0.03 t 3.470 3.713 0.238 3.995 3.102 3.177 1.178 2.443 P 0.003 0.002 0.814 0.001 0.007 0.006 0.255 0.023
3 讨论
肾脏解剖结构特殊,大体由肾皮质、髓质构成,而肾皮质由肾小体(肾小球和肾小囊)、近曲小管和远曲小管组成,肾髓质由集合管、直小血管平行排列而成,肾小管汇合成集合管,形成皮髓质间沟通。肾脏血流非常丰富,尤其皮质血流供应特别丰富,而肾小管存在液体流动效应。肾脏的这种水分子代谢活跃、血流灌注丰富和肾小管及集合管流动性的生理学特点及特殊解剖结构为IVIM提供了理论基础。
DWI作为非侵入性功能磁共振成像技术已广泛应用于全身各大系统[13-14]。通过对获取的扩散加权图像进行单指数拟合获得ADC值,可以反映组织中水分子的扩散和灌注状态。但是,单一参数ADC值不能对组织中的扩散成份与灌注成份进行区分。由LE等[3]提出的IVIM理论,通过设置多个b值采集DWI图像,通常包括数个小于200 s/mm2的b值和数个大于200 s/mm2的b值,对获取的图像进行双指数拟合获得IVIM参数值,包括D、DP和PF 3个参数,D为扩散相关参数,DP、PF表示灌注相关参数,D代表排除了灌注效应后的纯水分子扩散系数,DP为伪扩散系数,代表微循环平均扩散系数,在肾脏主要与肾小球及肾小管流速相关,PF为微循环液体容量与组织总液体容量比值。目前已有多项研究将IVIM-DWI应用于肾脏,主要包括肾功能不全[4]、肾移植[5]、肾脏肿瘤[6-7]等。
本研究获取的图像质量可用于评估,2名观察者所测参数值的一致性较好(ICC=0.764~0.874)。虽然DP、PF值在2名观察者测量的一致性较好,但是其CV值较高,而ADC与D值的ICC值较高、CV值较小,ADC与D值相对更稳定,这些结果与先前的研究报道[15-16]基本一致,这主要是由于双指数拟合算法本身的局限性,导致其在拟合DP值和PF值时不稳定所致[17-18]。
DM发生的最初几年,大约70%的1型DM和50%的2型DM患者肾脏会出现肾小球高滤过状态[2],这一时期GFR明显高于正常。在本研究中结果显示DM组ADC、D值均较正常组明显增高,这可能与肾小球的高滤过状态有关,处于高滤过期肾脏会出现肾小球微结构和血流动力学变化。SEYER-HANSEN[19]在一项DM大鼠的研究中认为高滤过期会出现肾小球、肾小管及间质系膜细胞代偿性肥大,引起肾脏体积增大,肾实质细胞疏松,组织内水分子扩散受限减低,这些可能是引起肾脏皮髓质扩散系数ADC、D值增加的一方面因素。而灌注参数PF值在2组间亦存在显著差异,DM组肾脏实质的PF值明显高于正常组肾脏,这一结果与DM早期肾脏所出现的肾脏高滤过状态相关,高滤过期肾脏的血流动力学明显增加,肾小球、肾小管液体流速增加,肾脏整体处于高灌注状态[2,9,20]。然而,2组间DP值差异无统计学意义,这可能与DP值参数本身的拟合不稳定及本研究中DP值CV相对较高等因素所致[15],这也需要后续改善双指数拟合算法方式来提高DP值的稳定性。
在DM组内,我们得出肾脏皮质D值与eGFR间存在显著的正相关。皮质ADC、D值的增加与eGFR的增高呈线性相关性,这与文献报道的更高的GFR会出现肾小球毛细血管滤过压和肾血浆流量增加有关[21],更高GFR持续状态,通常与更快的肾脏病变进展及蛋白尿增加有关[20]。肾脏皮质ADC值与eGFR间亦存在这样的趋势,但差异无统计学意义,这亦与皮质ADC值同时反映扩散和灌注效应相关,而D值理论上排除了灌注效应而只反映组织水分子的纯扩散状态,D值可能较ADC值在反映扩散状态方面更准确,DING等[22]的IVIM和单指数比较的研究中亦证实了D值较ADC值在反映肾功能方面更好。然而,肾脏髓质ADC、D值与eGFR无相关性,这与肾脏髓质的结构与皮质不一致有关,肾髓质主要为肾小管、集合管小管,肾皮质主要为肾小球囊结构,而肾脏高滤过的出现主要表现为肾小球毛细血管滤过压力增加、肾血浆流量增加。
本研究存在一些局限性。首先,纳入的高滤过期患者样本量过少,可能会影响获取结果的可信度,我们会继续扩大样本量来进一步证实研究结果。其次,出于伦理原因对早期DM患者进行有创性的肾脏病理活检是非常困难的,因此临床诊断高滤过期肾病主要依赖GFR测定,本研究中eGFR的计算采用的是基于Scr的CKD-EPI公式[11],此公式被认为比C-G(Cockcroft-Gault)公式、肾脏病饮食修正公式能更精确地估算2型DM患者的GFR,尤其是评估中国人DM早期高滤过期肾功能的准确性更高[23],但还存在争议。有研究已经证实基于胱抑素C的计算方法来计算eGFR值相对于基于Scr值计算方式更为稳定,特别对早期的DM肾脏高滤状态更为精确[11]。因此关于IVIM-DWI与GFR的临床相关性仍有待于今后更精准的研究加以明确。再次,虽然在采集图像时,我们使用了呼吸触发模式,但是这种模式仍然不能完全消除心脏及呼吸运动伪影对图像质量的干扰,需要进一步提高图像质量以提高结果的稳定性。
综上所述,本研究选择了DM早期患者中处于高滤过期的人群为研究对象,初步证实了IVIM-DWI扩散参数及灌注参数PF在监测早期DM高滤期肾脏功能改变的可行性。然而,IVIM-DWI灌注参数DP在反映高滤过期肾脏功能改变仍存在一定局限性,亦需对序列进行优化和对双指数模型算法进行改善来提高数据的稳定性及准确性。
参考文献:
[1] MAGEE G M, BILOUS R W, CARDWELL C R, et al. Is hyperfiltration associated with the future risk of developing diabetic nephropathy? A meta-analysis[J]. Diabetologia,2009, 52(4): 691-697.
[2] HELAL I, FICK-BROSNAHAN G M, REED-GITOMER B,et al. Glomerular hyperfiltration: definitions, mechanisms and clinical implications[J]. Nat Rev Nephrol, 2012, 8(5):293-300.
[3] LE B D, BRETON E, LALLEMAND D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders[J]. Radiology, 1986,161(2): 401-407.
[4] ICHIKAWA S, MOTOSUGI U, ICHIKAWA T, et al. Intravoxel incoherent motion imaging of the kidney: alterations in diffusion and perfusion in patients with renal dysfunction[J]. Magn Reson Imaging, 2013, 31(3): 414-417.
[5] REN T, WEN C L, CHEN L H, et al. Evaluation of renal allografts function early after transplantation using intravoxel incoherent motion and arterial spin labeling MRI[J]. Magn Reson Imaging, 2016, 34(7): 908-914.
[6] GAING B, SIGMUND E E, HUANG W C, et al. Subtype differentiation of renal tumors using voxel-based histogram analysis of intravoxel incoherent motion parameters[J]. Invest Radiol, 2015, 50(3): 144-152.
[7] CHANDARANA H, KANG S K, WONG S, et al. Diffusion-weighted intravoxel incoherent motion imaging of renal tumors with histopathologic correlation[J]. Invest Radiol, 2012, 47(12): 688-696.
[8] American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2014, 37 Suppl 1: S81-S90.
[9] RUGGENENTI P, PORRINI E L, GASPARI F, et al. Glomerular hyperfiltration and renal disease progression in type 2 diabetes[J]. Diabetes Care, 2012, 35(10): 2061-2068.
[10] 杨轶萍, 杨菊红, 常宝成, 等. 纤维蛋白原是2型糖尿病尿蛋白进展的预测指标[J]. 中华内分泌代谢杂志, 2012, 28(9): 726-728.
[11] 国秀芝, 秦岩, 郑可, 等. 基于血肌酐和胱抑素C的四个CKD-EPI方程对我国慢性肾脏病患者的适用性研究[J]. 中华检验医学杂志, 2012, 35(9): 798-804.
[12] BÜSING K A, KILIAN A K, SCHAIBLE T, et al. Reliability and validity of MR image lung volume measurement in fetuses with congenital diaphragmatic hernia and in vitro lung models[J]. Radiology, 2008, 246(2): 553-561.
[13] 许化致, 周洁洁, 袁湘芝, 等. 计算弥散加权成像在乳腺癌诊断中的应用[J]. 温州医科大学学报, 2017, 47(7): 485-489.
[14] 周海生, 张爱伟, 陈伟建, 等. MRI扩散加权成像在乏脂肪肾血管平滑肌脂肪瘤和肾癌间的鉴别诊断价值[J]. 温州医科大学学报, 2016, 46(6): 447-450.
[15] ZHANG J L, SIGMUND E E, CHANDARANA H, et al.Variability of renal apparent diffusion coefficients: limitations of the monoexponential model for diffusion quantification[J]. Radiology, 2010, 254(3): 783-792.
[16] SIGMUND E E, VIVIER P H, SUI D, et al. Intravoxel incoherent motion and diffusion-tensor imaging in renal tissue under hydration and furosemide flow challenges[J]. Radiology, 2012, 263(3): 758-769.
[17] KING M D, VAN BRUGGEN N, BUSZA A L, et al. Perfusion and diffusion MR imaging[J]. Magn Reson Med, 1992,24(2): 288-301.
[18] BARBIERI S, DONATI O F, FROEHLICH J M, et al. Impact of the calculation algorithm on biexponential fitting of diffusion-weighted MRI in upper abdominal organs[J].Magn Reson Med, 2016, 75(5): 2175-2184.
[19] SEYER-HANSEN K. Renal hypertrophy in experimental diabetes: a comparison to compensatory hypertrophy[J]. Diabetologia, 1978, 14(5): 325-328.
[20] MOGENSEN C E. Glomerular hyperfiltration in human diabetes[J]. Diabetes Care, 1994, 17(7): 770-775.
[21] SASSON A N, CHERNEY D Z. Renal hyperfiltration related to diabetes mellitus and obesity in human disease[J].World J Diabetes, 2012, 3(1): 1-6.
[22] DING J, CHEN J, JIANG Z, et al. Assessment of renal dysfunction with diffusion-weighted imaging: comparing intravoxel incoherent motion (IVIM) with a mono-exponential model[J]. Acta Radiol, 2016, 57(4): 507-512.
[23] AHMAD J. Management of diabetic nephropathy: Recent progress and future perspective[J]. Diabetes Metab Syndr,2015, 9(4): 343-358.

