PI3Kp85α在甲状腺乳头状癌中的表达及意义
龚小花,周琦,吴文俊,王芳,陈肖俊
(温州医科大学附属第一医院,浙江 温州 325015,1.内分泌科;2.病理科)
甲状腺癌是内分泌科较为常见的恶性肿瘤,约占人体所有恶性肿瘤的1%,其中以甲状腺乳头状癌最为多见。尽管甲状腺乳头状癌绝大多数临床进程缓慢,手术、药物及放射性核素治疗效果理想,但仍有一部分表现出高侵袭性特征,如局部外侵严重、容易复发和转移,预后差。目前这部分高侵袭性的甲状腺乳头状癌在术前依然缺乏有效的甄别手段,需要寻找更多敏感而特异的分子标志物以评估预后并制定治疗方案。
PI3Kp85α是磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)家族中表达量最多的调节亚基,由PIK3R1基因编码。PI3Kp85α的活性增加与多种人类肿瘤的发生相关,但PI3Kp85α在甲状腺乳头状癌中的作用鲜有报道,因此,本研究分别检测甲状腺乳头状癌组织、甲状腺乳头状增生组织中PI3Kp85α蛋白的表达情况,并分析其与患者临床病理特征的相关性,利用ROC曲线评价PI3Kp85α在甲状腺乳头状癌诊断中的价值。
1 资料和方法
1.1 一般资料 收集2011年9月至2014年9月间在温州医科大学附属第一医院就诊且行外科手术治疗,术后经常规病理检查确诊为甲状腺乳头状癌的116例患者的临床资料。其中男43例,女73例;年龄18~56岁,平均(42.6±12.0)岁;肿瘤直径≥2 cm者35例,<2 cm者81例;有淋巴结转移者75例,无淋巴结转移者41例。选择同期住院手术甲状腺乳头状增生患者90例。其中结节性甲状腺肿84例,甲状腺腺瘤4例,慢性淋巴细胞性甲状腺炎2例;男26例,女64例;年龄15~60岁,平均(42.0±12.2)岁。2组性别、年龄具有可比性(均P>0.05)。纳入标准:患者的病例资料完善;无其他基础疾病或是慢性疾病或合并其他全身恶性肿瘤。排除标准:病例资料不完整;术前进行过放疗、化疗、内分泌治疗及激素治疗;合并其他全身恶性肿瘤。本研究经本院学术伦理委员会审批同意。
1.2 免疫组织化学染色评分 采用免疫组织化学SP法检测PI3Kp85α在甲状腺组织中的表达。所有病例标本均经4%中性甲醛溶液固定,乙醇脱水,常规石蜡包埋,4 μm厚连续切片备用,脱蜡,3%过氧化氢封闭内源性过氧化物酶,在0.01 mol/L枸橼酸缓冲液(pH 6.0)中微波加热30 min进行抗原修复,冷却至室温,用PBS洗涤后,分别加入鼠抗人PI3Kp85α单克隆抗体(美国Labvision公司,使用时按1:50稀释),37 ℃孵育1 h,再加生物素化的兔抗鼠二抗即用型,37 ℃孵育30 min后,滴加新鲜配置的DAB显色液,显色1~2 min,PBS缓冲液浸洗3次,每次2 min。苏木素复染1 min,脱水透明,中性树胶封片。采用已知阳性片作为阳性对照,分别用PBS液和小鼠血清代替一抗作为阴性对照。每例组织检测独立重复3次。
免疫组织化学染色结果由2名不知道患者临床资料的病理学专家独立判定。光镜下PI3Kp85α蛋白表达阳性表现为细胞膜或细胞质棕黄色着色。随机选择10个高倍视野,每个视野计数100个细胞,计算阳性细胞数占总细胞数的百分比,取10个视野的算术平均值。根据显色细胞的比例计分:显色细胞5% 0分,6%~25% 1分,26%~50% 2分,51%~75% 3分,>75% 4分;根据细胞染色强度计分:0分细胞无显色,1分浅黄色,2分黄色,3分棕黄色。每例积分按显色细胞比例计分和细胞染色强度计分的乘积计算。积分0分为阴性,1~4分为弱阳性(1+),5~8分为中等阳性(2+),9~12分为强阳性(3+)。
1.3 Western blot检测 在冰冻的甲状腺乳头状癌组织中加蛋白裂解液100 mg/500 μL提取总蛋白,采用考马斯亮蓝法进行蛋白定量。取50 μg总蛋白进行12% SDS-聚丙烯酰胺凝胶电泳;转膜,5%脱脂奶粉37 ℃摇床封闭1 h后,加入PI3Kp85α单克隆抗体(美国Chemicon公司,使用时1:1 000稀释),4 ℃孵育过夜;辣根过氧化物酶标记二抗(1:4 000稀释)室温下孵育1 h;洗膜,DAB法显色。GAPDH为内对照。判断标准:膜上出现清晰特异性条带为阳性。图像扫描仪扫描(北京清华紫光公司),定量软件分析系统(Image)测定每一样本条带的D值,目的条带与内对照GAPDH条带D值之比为该样本中蛋白的相对含量。每例组织检测重复3次,取平均值。
1.4 ELISA法检测 ELISA法检测组织匀浆上清液中蛋白的浓度。在100 mg剪碎组织中加入1 mL蛋白提取液,液氮研磨,冰上孵育30 min后离心取上清,采用BCA(bicinchoninic acid,美国Thermo公司)蛋白检测试剂盒检测蛋白浓度。采用美国Uscn公司人ELISA试剂盒依次将标准品、待测样品100 μL加入到酶标板中,在待测样品孔中先加样品稀释液80 μL,再加待测样品20 μL置于孔底部(以不加样品及酶标试剂为空白孔)。盖上覆膜,37 ℃温育2 h,弃去液体,每孔加入酶标试剂100 μL(空白孔除外),盖上覆膜后置于37 ℃温育30 min,弃去液体,用洗涤液洗涤,加入100 μL显色剂,37 ℃避光显色15 min,每孔加入终止液50 μL终止反应(此时蓝色立刻转为黄色)。加终止液后15 min内,以空白孔为调零孔,用酶标仪(美国Bio-Rad公司)在450 nm波长处依序测量各孔的吸光度(OD值)。实验设6个重复孔,取平均值,以标准品浓度为横坐标,OD值为纵坐标,绘制标准曲线,由样品的OD值查出相应的浓度,再乘以稀释倍数即样品的实际浓度。
1.5 统计学处理方法 采用SPSS19.0软件进行统计学分析。计量资料采用±s表示,2组间的比较采用独立样本t检验;计数资料采用百分比或率表示,采用χ2检验分析;诊断敏感性和特异性采用ROC曲线分析。P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学法检测PI3Kp85α蛋白在甲状腺组织中的表达 PI3Kp85α蛋白表达阳性表现为细胞质呈明显棕黄色(见图1)。PI3Kp85α在癌组织中均呈不同程度的阳性表达,在甲状腺乳头状增生组织中呈现弱表达;PI3Kp85α蛋白的阳性表达率在甲状腺乳头状癌组织中显著高于甲状腺良性病变组织,差异有统计学意义(χ2=68.322,P<0.01),见表1。
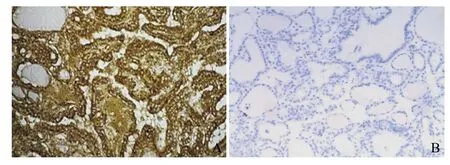
图1 PI3Kp85α蛋白在甲状腺组织中的表达(SP,×200)
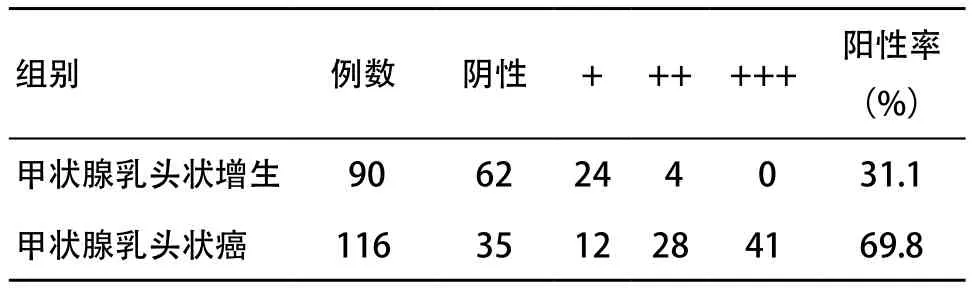
表1 免疫组织化学检测PI3Kp85α蛋白在2组中的表达
2.2 Western blot检测PI3Kp85α蛋白表达 结果显示,在甲状腺乳头状癌组织中PI3Kp85α蛋白表达水平(0.83±0.12)高于甲状腺乳头状增生组织(0.37±0.05),差异有统计学意义(P<0.01)。
2.3 ELISA检测组织匀浆上清液中PI3Kp85α蛋白浓度 结果显示,甲状腺乳头状癌组织匀浆上清液中PI3Kp85α的蛋白浓度为(2.74±0.46)ng/mL,甲状腺乳头状增生组织细胞PI3Kp85α的蛋白浓度为(1.39±0.55)ng/mL,差异有统计学意义(P<0.05)。
2.4 PI3Kp85α蛋白表达与甲状腺乳头状癌临床病理参数间的关系 PI3Kp85α蛋白表达与患者性别、年龄、肿瘤大小无关(P>0.05),与淋巴结转移、临床分期相关(P<0.05),见表2。
2.5 PI3Kp85α诊断甲状腺乳头状癌的ROC曲线分析 组织匀浆上清液中PI3Kp85α浓度诊断甲状腺乳头状癌的曲线下面积为0.966(95%CI=0.942~0.989,P<0.001),当cut-off值取2.100时,诊断灵敏度(92.2%)和特异度(91.1%)最高(见图2)。
3 讨论
PI3K是一种与细胞信号转导有关的蛋白激酶,可被多种细胞因子激活。活化的PI3K使下游信号蛋白丝氨酸/苏氨酸(Ser/Thr)蛋白激酶B(Akt)等磷酸化,进而通过信号转导通路,传递生长因子等胞外刺激信号,参与调节细胞增生、分化、代谢和凋亡等生理活动[1-3]。目前,PI3K家族中研究最广泛的是能被细胞表面受体所激活的I型PI3K。IA型PI3K由一个调节亚基P85α和一个催化亚基p110组成,PI3Kp85α对于p110催化亚基的稳定、聚集以及IA型PI3K的激活是必需的[4-5]。PI3Kp85α是PI3K家族中表达量最多的调节亚基,有研究表明PI3Kp85α突变可以引起PI3K/Akt通路的激活[6-7]。已有研究报道PI3Kp85α的活性增加与乳腺癌、肺癌、肾癌、肠癌和淋巴瘤等多种人类肿瘤的发生相关[8-10]。
表2 甲状腺乳头状癌中PI3Kp85α蛋白表达的临床病理意义(±s)
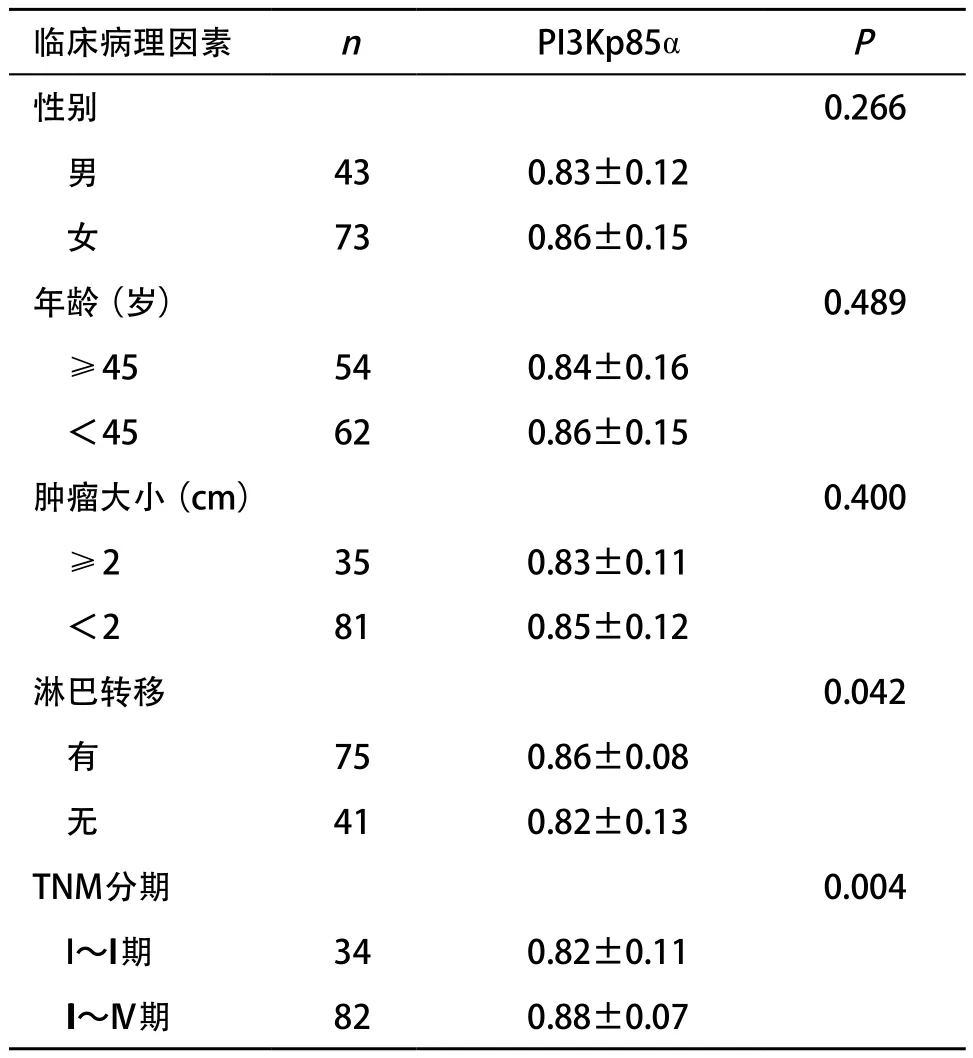
表2 甲状腺乳头状癌中PI3Kp85α蛋白表达的临床病理意义(±s)
临床病理因素 n PI3Kp85α P性别 0.266男43 0.83±0.12女73 0.86±0.15年龄(岁) 0.489≥45 54 0.84±0.16<45 62 0.86±0.15肿瘤大小(cm) 0.400≥2 35 0.83±0.11<2 81 0.85±0.12淋巴转移0.042有75 0.86±0.08无41 0.82±0.13 TNM分期0.004 I~II期 34 0.82±0.11 III~IV期 82 0.88±0.07
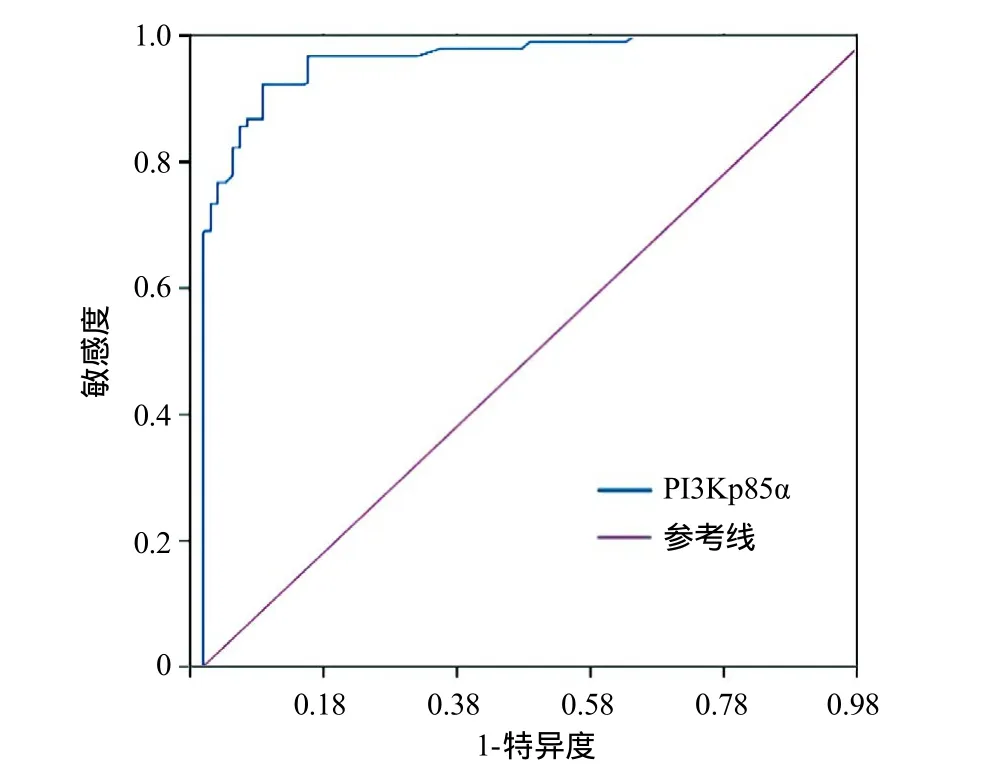
图2 PI3Kp85α诊断甲状腺乳头状癌的ROC曲线
本研究免疫组织化学检测结果显示,PI3Kp85α在甲状腺乳头状癌组织中的阳性表达率(为69.8%)显著高于甲状腺良性病变组织(为31.1%);Western blot检测结果发现,在甲状腺乳头状癌组织中,PI3Kp85α蛋白表达水平高于甲状腺乳头状增生组织,差异有统计学意义(P<0.01);ELISA检测结果亦显示,甲状腺乳头状癌组织匀浆上清液中PI3Kp85α蛋白浓度显著高于甲状腺甲状腺乳头状增生组织(P<0.05)。上述结果提示PI3Kp85α蛋白表达情况可作为甲状腺乳头状癌和甲状腺良性病变的鉴别诊断依据之一。PI3Kp85α诊断甲状腺乳头状癌的ROC曲线分析显示,曲线下面积为0.966(95%CI=0.942~0.989,P<0.001),当cut-off值取2.100时,诊断灵敏度可达92.2%,特异度可达91.1%。
本研究显示,PI3Kp85α蛋白表达与患者性别、年龄、肿瘤大小无关,但与淋巴结转移和TNM分期相关,提示PI3Kp85α与甲状腺乳头状癌的侵袭发展及淋巴结转移过程密切相关。PETRULEA等[11]也发现PI3Kp85α过表达有强烈致癌变作用,是高侵袭性甲状腺乳头状癌潜在的治疗靶点。DUMAN等[12]研究发现PI3Kp85α的异常活化与正常甲状腺组织的被膜侵犯有一定的相关性。因此,PI3Kp85α可能与少部分甲状腺乳头状癌出现高侵袭性变异,甚至在早期就出现局部侵犯或淋巴结及远处转移有关。有研究发现,PI3Kp85α的突变是导致肿瘤组织中PI3K/AKT异常激活的重要原因[13-14],PI3Kp85α的磷酸化修饰也改变了PI3K/AKT通路的活性[15-16],此外PI3K调节亚基和催化亚基之间的平衡也影响着PI3K/AKT活性和生物学效应[17]。可见,PI3Kp85α对PI3K/AKT信号通路的调节是非常复杂的,具体机制有待进一步明确。
综上所述,PI3Kp85α在甲状腺乳头状癌中高表达,且与其淋巴结转移、临床分期相关,提示PI3Kp85α可能促进了甲状腺乳头状癌的增殖、浸润及转移。早期联合检测PI3Kp85α的表达可能可以作为评估甲状腺乳头状癌侵袭性及预后的指标之一。
参考文献:
[1] CAMPOS M, KOOL M M J, DAMINET S, et al. Upregulation of the PI3K/Akt pathway in the tumorigenesis of canine thyroid carcinoma[J]. J Vet Intern Med, 2014, 28(6): 1814-1823.
[2] BADER A G, KANG S, ZHAO L, et al. Oncogenic PI3K deregulates transcription and translation[J]. Nat Rev Cancer,2005, 5(12): 921-929.
[3] 张芳芳, 林秀飞, 陈聪聪, 等. Akt在FGF21预防糖尿病心肌病中的作用研究[J]. 温州医科大学学报, 2016, 46(7):490-497.
[4] JIMÉNEZ C, HERNÁNDEZ C, PIMENTEL B, et al. The p85 regulatory subunit controls sequential activation of phosphoinositide 3-kinase by Tyr kinases and Ras[J]. J Biol Chem, 2002, 277(44): 41556-41562.
[5] YUAN T L, CANTLEY L C. PI3K pathway alterations in cancer: variations on a theme[J]. Oncogene, 2008, 27(41):5497-5510.
[6] SOO H C, CHUNG F F L, LIM K H, et al. Cudraflavone C induces tumor-specific apoptosis in colorectal cancer cells through inhibition of the phosphoinositide 3-kinase (PI3K)-AKT pathway[J]. PLoS One, 2017, 12(1): e0170551.
[7] URICK M E, RUDD M L, GODWIN A K, et al. PIK3R1(p85α) is somatically mutated at high frequency in primary endometrial cancer[J]. Cancer Res, 2011, 71(12): 4061-4067.
[8] 郑永霞, 张成文, 惠斌, 等. 磷脂酰肌醇3激酶调节亚基基因对HepG2细胞增殖的影响[J]. 浙江大学学报(医学版),2014, 43(5): 559-565.
[9] 吴迪, 刘亚林, 王梦昌. PIK3R1对多发性骨髓瘤细胞侵袭转移的影响及其机制初探[J]. 陕西医学杂志, 2015, 44(2):134-137.
[10] 郭升超, 沈波, 赵己未, 等. PI3Kp85α对大肠癌细胞侵袭及转移的影响[J]. 广东医学, 2014, 35(4): 493-496.
[11] PETRULEA M S, PLANTINGA T S, SMIT J W, et al.PI3K/Akt/mTOR: A promising therapeutic target for nonmedullary thyroid carcinoma[J]. Cancer Treat Rev, 2015, 41(8): 707-713.
[12] DUMAN B B, KARA O I, UĞUZ A, et al. Evaluation of PTEN, PI3K MTOR, and KRAS expression and their clinical and prognostic relevance to differentiated thyroid carcinoma[J]. Contemp Oncol (Pozn), 2014, 18(4): 234-240.
[13] COSTA C, ENGELMAN J. The double life of p85[J]. Cancer Cell, 2014, 26(4): 445-447.
[14] LUO J, CANTLEY L C. The negative regulation of phosphoinositide 3-kinase signaling by p85 and it’s implication in cancer[J]. Cell Cycle, 2005, 4(10): 1309-1312.
[15] VON WILLEBRAND M, WILLIAMS S, SAXENA M, et al.Modification of phosphatidylinositol 3-kinase SH2 domain binding properties by Abl- or Lck-mediated tyrosine phosphorylation at Tyr-688[J]. J Biol Chem, 1998, 273(7): 3994-4000.
[16] FEOLA A, CIMINI A, MIGLIUCCI F, et al. The inhibition of p85αPI3KSer83 phosphorylation prevents cell proliferation and invasion in prostate cancer cells[J]. J Biol Chem,2013, 114(9): 2114-2119.
[17] UEKI K, FRUMAN D A, BRACHMANN S M, et al. Molecular balance between the regulatory and catalytic subunits of phosphoinositide 3-kinase regulates cell signaling and survival[J]. Mol Cell Biol, 2002, 22(3): 965-977.

