藜麦营养成分分析及黄酮提取物的抗氧化和抗菌活性研究
李玉英,王玉玲,王转花
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西太原030006)
藜麦(Chenopodium quinoa)是原产于南美洲安第斯山脉的藜科藜属植物[1],是古印加人的传统粮食作物,种子颜色有白、红、黑3种色系,具有耐寒、耐旱、耐贫瘠、耐盐碱等特性,是喜冷凉和高海拔的作物[2-3]。由于生长习性以及对种植条件要求的特殊性,不同环境下生产出的藜麦品质相差极大,目前,其主要分布于南美洲,亚洲的中国山西、青海省及西北地区等。
藜麦营养价值极高,有营养黄金的美称。藜麦中含有大量优质蛋白,平均为12%~23%[4],是普通谷物的2倍及以上,可与肉蛋奶媲美,并且含有人体生长必需的所有氨基酸,其中,赖氨酸含量高于大多数谷物。藜麦富含镁、锌、铁、钙、钾等多种矿物质,藜麦与常见粮食作物相比,钙、铁含量是小麦的4倍。此外,藜麦还含有丰富的膳食纤维[5]、维生素以及包括多酚、皂苷等在内的生物活性成分[6],其中,黄酮类物质被认为是主要的功能活性成分,不仅具有抗氧化活性[7-8],还有良好的抑菌活性[9]。RITVA等[10]研究表明,秘鲁、西班牙、萨尔塞多等地藜麦的黄酮类含量在 36.2~144.3 mg/100 g;ZHU等[11]从美国托伦斯藜麦种子中分离出了6种黄酮苷元,这6种黄酮苷元在自由基清除试验中都表现出很强的抗氧化活性。近年来,我国一些学者也开展了对藜麦的研究,孙雪婷等[12]以浙江本土藜麦品种Vanilla为材料,对藜麦总黄酮乙醇浸提法进行优化,结果表明,在最佳条件下黄酮的得率可达2.64 mg/g。
由于藜麦丰富的营养价值,对藜麦中化学成分及生物活性的研究已成为国内外食品研究领域的热点,我国对于藜麦的研究起步较晚,大多集中在藜麦黄酮提取工艺优化方面,对藜麦黄酮成分鉴定以及抗氧化和抗菌活性的研究甚少。
本研究以山西种植的藜麦种子为材料,利用地方特色资源,采用多种方法分析测定了其中的营养成分,并利用提取获得的藜麦黄酮化合物进行了抗氧化和抑菌活性研究,旨在评价藜麦的营养价值以及为藜麦中抗氧化物质以及抗菌剂的开发提供理论依据。
1 材料和方法
1.1 材料
供试黑色(BQ)、红色(RQ)、白色(WQ)3种藜麦种子采自山西静乐,系当年收获种子。
供试菌株金黄色葡萄球菌(Staphylococcus aureus,BNCC186335),大肠杆菌(Escherichia coli,BNCC337271),枯草芽孢杆菌(Bacillus subtilis,BNCC124990),均由山西大学化学生物学与分子工程教育部重点实验室保存。
1.2 试剂及仪器设备
1,1- 二 苯 基 -2 三 硝 基 苯 肼(1,1-dipheny1-2-picrylhydrazyl,DPPH)购自美国Sigma公司;芦丁、槲皮素、山奈酚标品购自北京索莱宝科技有限公司;甲醇、甲酸为色谱纯试剂;3,5-二硝基水杨酸(DNS)、无水乙醇、浓硫酸、无水葡萄糖、碳酸钠、氢氧化钠、硼酸、硫酸铜和硫酸钾等其余试剂均为国产分析纯。
QE-250高速粉碎机(浙江屹立工贸有限公司);RE-3000B旋转蒸发器(上海亚荣生化仪器厂);HN-36B恒温培养箱(北京市恒诺利兴科技有限公司);HC-2518离心机(安徽中科中佳科学仪器有限公司);Lambda35紫外可见分光光度计(美国Perkin Elmer公司);Heto PowerDry PL3000真空冷冻干燥器(上海汇分电子科技);HS800D恒温水浴锅 (太仓华利达仪器厂);Agilent 1260系列高效液相色谱仪(安捷伦有限公司)。
1.3 方法
1.3.1 藜麦营养成分分析 采用国标方法对山西静乐藜麦营养成分进行测定,蛋白质测定采用凯氏定氮法(GB 5009.5—2010);灰分测定采用灼烧法(GB 5009.4—2010);水分含量测定采用直接干燥法(GB 5009.3—2010);粗脂肪测定采用索氏抽提法(GB 5009.6—2003);氨基酸成分委托山西粮食质量检测中心检测。
1.3.2 藜麦黄酮的提取制备 其参考文献[13],稍有改进。准确称取5 g干燥粉碎的藜麦样品,石油醚索氏抽提去脂。以料液比1∶30加入1%HCl-甲醇溶液,在恒温70℃水浴条件下回流2 h。滤渣重复上述步骤,重复提取一次,合并2次提取液,减压抽滤,滤液旋转蒸发至干,残渣用甲醇定容至5 mL,4℃冰箱中保存备用。
1.3.3 黄酮含量的测定 用甲醇配制芦丁标准品0.25 mg/mL,用甲醇稀释标准品质量浓度分别为0.05,0.10,0.15,0.20,0.25 mg/mL,吸取上述标准溶液 5.0 mL,加入到 5 个试管中,分别加 0.3 mL 5%亚硝酸钠,混匀,室温下静置5 min后再加10%硝酸铝 0.3 mL,混匀,静置 10 min 后,加入 2 mL 4%氢氧化钠,然后加水补足到10 mL,混匀后放置10 min,以甲醇为空白对照,510 nm处紫外测定吸光度值,绘制芦丁标准曲线。取用甲醇稀释后不同质量浓度的藜麦黄酮提取液重复以上步骤,根据芦丁标准曲线方程计算不同藜麦样品中总黄酮的含量。
1.3.4 藜麦黄酮的HPLC-DAD检测 藜麦黄酮提取液经0.45 μm微孔滤膜过滤后,进样5 μL进行分析。
用以下色谱条件进行定量分析。色谱柱:Venusil XBP C18(L)(4.6 mm×250 mm,5 μm);流动相为甲醇-0.4%磷酸,梯度洗脱0~10 min,45%~48%甲醇;10~30 min,48%~52%甲醇;波长为 360 nm;流速为 1.0 mL/min;柱温为 30 ℃;进样量为 10 μL。
1.3.5 抗氧化活性测定
1.3.5.1 DPPH自由基清除作用测定 配制 0.05 mg/mL DPPH甲醇溶液,避光放置备用。用甲醇稀释样品质量浓度分别为 0.05,0.10,0.15 mg/mL,试管中分别加入不同浓度的样品溶液2mL,DPPH溶液2mL,充分混匀,在黑暗中避光反应30 min,测定517 nm处的吸光值(A样品),用甲醇代替DPPH溶液测定吸光值(A对照),用甲醇代替样品测定吸光值(A空白),以维生素C为阳性对照。试验平行测定3次,取平均值。按公式(1)计算DPPH自由基的清除率。
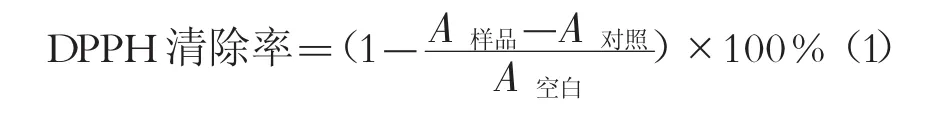
1.3.5.2 羟自由基(·OH)清除率的测定 用甲醇稀释样品质量浓度分别为 0.05,0.10,0.15 mg/mL,试管中分别加入不同浓度的样品溶液2 mL,按顺序先后加入2 mL 6 mmol/L FeSO4,2 mL 6 mmol/L水杨酸-乙醇,2 mL 6 mmol/L H2O2,充分摇匀后在37℃的水浴锅中反应30 min,以蒸馏水为参比,于510 nm下测量各浓度的吸光度(D样品)。用蒸馏水代替水杨酸测得吸光度(D对照),用蒸馏水代替样品测定吸光度(D空白)。以维生素C作为阳性对照。所有试验均平行测定3次,取平均值,按公式(2)计算·OH清除率。

1.3.5.3 总还原力的测定 试管中依次加入1 mL不同浓度提取溶液,2.5 mL 0.2 mol/L PBS 磷酸缓冲液(pH值6.6),2.5 mL 1.0%K3(Fe(CN)6)混合置于50℃的水浴锅中反应20 min,加入2.5 mL 10%三氯乙酸溶液,摇匀,将混合物以3 000 r/min离心10 min。吸取2.5 mL上清液,加2.5 mL双蒸水和0.5 mL 0.1%三氯化铁,混匀,测定样品在 700 nm波长处的吸光度值。以维生素C作为阳性对照。结果重复测定3次,取平均值。
1.3.6 抗菌活性测定 依据上述3个样品黄酮含量和抗氧化活性测定结果,选取黄酮含量和抗氧化活性都较高的BQ样品进行抑细菌活性测定。取供试的大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌菌株进行活化,加入无菌水中,制成菌悬液,借助麦氏比浊仪调制菌浓度为107cfu/mL。采用牛津杯法测黄酮提取物的抑菌活性。采用甲醇稀释黄酮贮备液质量浓度分别为16,8,4 mg/mL。无菌条件下,在培养皿中注入20 mL培养基,取0.18 mL菌悬液均匀涂布于其上,将灭菌的牛津杯均匀置于平板上,然后加入0.2 mL样液,于培养箱中培养24~28 h。用甲醇作为阴性对照,采用精确度为1 mm的游标卡尺量取抑菌圈直径,肉眼观察无明显细菌生长的区域作为抑菌圈边缘,试验抑菌圈直径为减去对照组后的值,结果平行测定3次。
1.4 数据处理
所有试验均重复测定3次,采用SPSS 17.0统计分析软件对数据进行处理。
2 结果与分析
2.1 藜麦营养成分分析
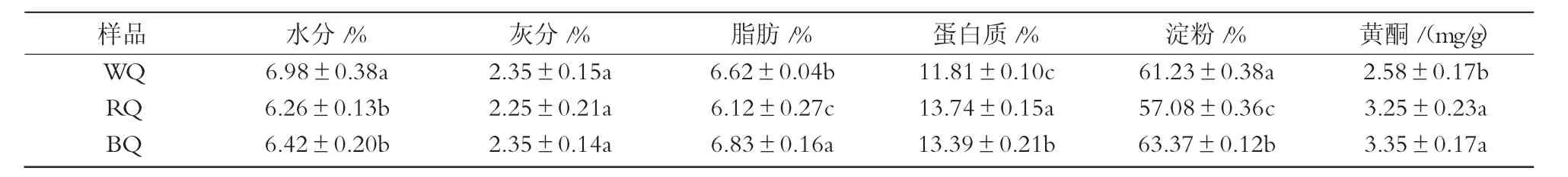
表1 藜麦基本营养成分分析
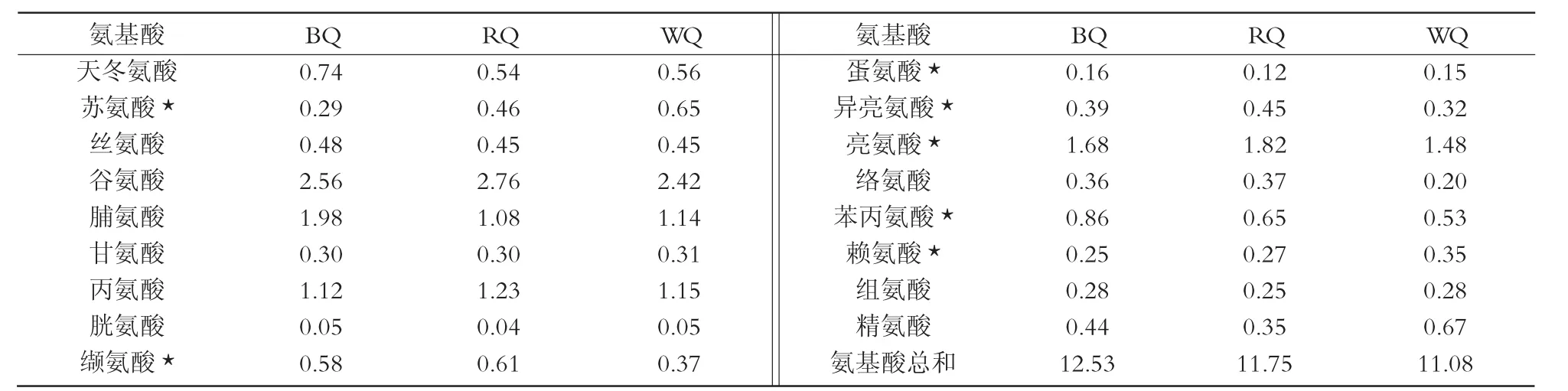
表2 藜麦氨基酸组成分析 g/100 g
由表1可知,藜麦中蛋白质含量平均为12.98%,其中,WQ为 11.81%,RQ为 13.74%,BQ为 13.39%,相比于其他谷类作物大麦(11%)、水稻(7.5%),其蛋白质含量较高,与玉米(13.4%)相当[14-15]。藜麦中的淀粉含量在57.08%~63.37%,与其他谷物水稻(70%~80%)、玉米(65%~72%)相比,藜麦中的淀粉含量稍低。3种藜麦的水分、灰分、脂肪含量差异不大。不同颜色藜麦黄酮含量差异较大,颜色越深含量越高,最大为 3.35 mg/g。
本试验对17种氨基酸进行了检测,从表2可以看出,3种藜麦的氨基酸组成的类型相差不大,但氨基酸相对含量有一定的差异。其中,BQ的氨基酸总量最高,平均为12.53 g/100 g。测定结果也显示,藜麦中富含赖氨酸(0.25~0.35 g/100 g)、亮氨酸(1.48~1.82 g/100 g)、蛋氨酸(0.12~0.16 g/100 g)等人体生长所需的必需氨基酸。
2.2 HPLC分析藜麦黄酮的成分及含量

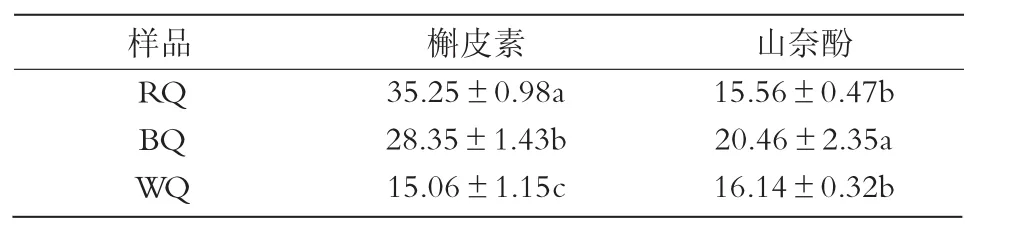
表3 藜麦中黄酮化合物的含量 mg/100 g
用高效液相色谱法测定藜麦种子中提取的黄酮类化合物。HPLC的分析测定结果如图1所示,其中,(1),(2),(3),(7) 为槲皮素,(4),(5),(6),(8)为山奈酚,都是藜麦种子黄酮的主要成分。
根据HPLC的分析测定结果,绘制标准曲线,得出2种标品中黄酮的回归方程。其中,槲皮素标准曲线回归方程为 y= 40.028x+4.308 7 (R2=0.996 19);山奈酚标准曲线回归方程为 y=35.649x+3.067(R2=0.993 6)。根据以上标准曲线回归方程计算黄酮含量,结果列于表3,藜麦中槲皮素和山奈酚的含量分别为 15.06~35.25,15.56~20.46 mg/100 g。其中,RQ样品中槲皮素含量明显高于其他2个样品。RITVA等[10]研究表明,不同品种藜麦的黄酮类含量在 36.2~144.3 mg/100 g;HIROSE等[16]利用高效液相色谱分析了4种藜麦黄酮苷,结果表明,日本藜麦种子黄酮的含量高于南美藜麦和日本的荞麦,而大部分谷物类如水稻、小麦、玉米都不含有黄酮类物质。
2.3 藜麦黄酮提取物的抗氧化活性
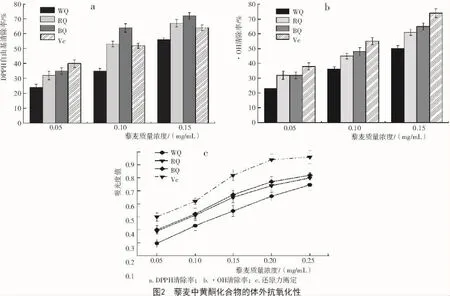
以Vc为阳性对照,采用3种常用的体外抗氧化活性方法(DPPH自由基清除法、羟自由基(·OH)清除法和总还原力法)对藜麦黄酮的抗氧化活性进行了测定,结果如图2所示。
由图2可知,3种不同颜色藜麦黄酮提取物均具有明显的抗氧化活性,清除DPPH的IC50值(半抑制浓度)分别为 0.08,0.09,0.14 mg/mL,清除·OH的 IC50值分别为 0.08,0.10,0.15 mg/mL,BQ 和 RQ样品清除自由基的能力强于WQ,表明颜色越深,其清除自由基的能力越强。还原力测定结果表明,3种样品藜麦黄酮在试验质量浓度(0.05~0.15 mg/mL)范围内总还原力与质量浓度呈线性关系,说明其具有较强的还原能力,与Vc相比,清除率略低。这一结果与上述黄酮含量测定结果也具有一定程度的一致性,整体呈正相关趋势,表明藜麦中黄酮某些成分具有清除氧自由基抗氧化的作用。
2.4 藜麦黄酮提取物对供试菌株的抑菌效果
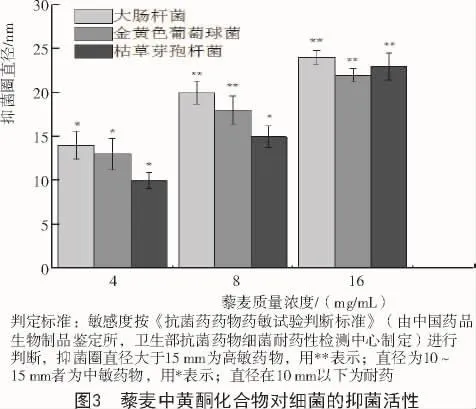
藜麦黄酮对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌抑菌作用通过牛津杯法进行了检测。由图3可知,藜麦黄酮对各供试菌株均表现出明显的抑制作用,最大抑菌圈直径分别为22,24,23 mm,随着黄酮质量浓度的增大,抑菌范围也逐渐增大,对大肠杆菌抑制效果最为明显。
3 讨论
已有研究表明,不同产地、生态环境、栽培条件会影响藜麦种子营养成分及其抑菌性、抗氧化活性。山西省静乐县作为我国最大的藜麦种植生产县,与种植地方小杂粮相比具有比较高的竞争优势。本研究以3种山西静乐藜麦种子为材料,营养成分测定结果表明,其蛋白质、脂肪、氨基酸含量稍有差异,但均高于小麦、水稻等传统粮食作物。WRIGHT等[17]研究表明,玻利维亚的甜藜麦和苦藜麦蛋白质含量分别为14.8%和15.7%,与本试验测得的结果稍有不同,可能是由于不同基因型、生长环境以及检测方法导致了不同产地藜麦中蛋白质的差异,高海拔有利于藜麦蛋白质品质的提高。
藜麦中含有丰富的黄酮。许多研究表明,藜麦中黄酮和植物甾醇类物质具有很强的抗氧化能力。ADBERRAHIM等[18]对秘鲁13种有色藜麦进行了研究,结果表明,秘鲁藜麦种子是酚类和黄酮类物质的良好来源,并且抗氧化能力高于一般谷物,不同植物品种间黄酮化合物的含量差异很大[19-20]。本研究表明,山西静乐3种藜麦中深色种子有更高黄酮含量和抗氧化活性,而常见谷物小麦、燕麦、大麦等谷物中几乎不含有黄酮类化合物。由此可见,深色藜麦可作为一种很好的天然抗氧化剂的来源。已有研究表明,黄酮化合物具有抗真菌、抗细菌活性,本研究也发现,藜麦黄酮提取物对供试菌种大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌均有明显的抑制作用,但其抑菌活性成分还需进一步研究。本研究结果对于藜麦作为山西地标特色农产品的推广种植具有一定的促进作用,也可为我国藜麦资源的功能开发与应用提供一定的参考。
参考文献:
[1]BHARGAVA A,SYDHIRS,OHRI D.Chenopodium quinoa:an Indian per-spective[J].Industrial Crops and Products,2006,23(1):73-87.
[2]肖正春,张广伦.藜麦及其资源开发利用 [J].中国野生植物资源,2014,33(2):62-66.
[3]魏爱春,杨修仕,么杨,等.藜麦营养功能成分及生物活性研究进展[J].食品科学,2015,36(15):272-276.
[4] ABUGOCH L E,ROMERO N,TAPIA C A,et al.Study of some physicochemical and functional properties of quinoa(Chenopodium quinoa Willd)protein isolates[J].Journal of Agricultural and Food Chemistry,2008,56(12):4745.
[5]ANDOH,CHENY,TANGH,et al.Food components in fractions of quinoa seed[J].Food Science and Technology Research,2002,8(1):80-84.
[6]王黎明,马宁,李颂,等.藜麦的营养价值及其应用前景[J].食品工业科,2014,35(1):381-384.
[7]吴雨,李红艳,牛灿杰,等.竹叶中黄酮类化合物的研究进展[J].河南农业科学,2015,44(11):1-4.
[8]李济芳,李芳,金舒宁,等.杏叶总黄酮提取工艺及抗氧化性研究[J].山西农业科学,2017,45(2):258-262.
[9]游庭活,刘凡,温露,等.黄酮类化合物抑菌作用研究进展[J].中国中药杂志,2013,38(21):3645-3650.
[10]REPO-CARRASCO-VALENCIA R,HELLSTRÖM J K,PIHLAVA J M,et al.Flavonoids and other phenolic compounds in Andean indigenous grains:Quinoa (Chenopodium quinoa),kañiwa(Chenopodium pallidicalue)and kiwicha(Amaranthus caudatus)[J].Food Chemistry,2010,120(1):128-133.
[11] ZHU N,SHENG S,LI D,et al.Antioxidative flavonoid glycosides from quinoa seeds(Chenopodium quinoa Willd.)[J].Food Lipids,2001,8(1):37-44.
[12]孙雪婷,袁俊杰,蒋玉蓉,等.藜麦种子总黄酮提取及其抗氧化性[J].山西农业科学,2015,43(10):355-358.
[13]聂国伟.柚皮中黄酮物质的提取工艺研究 [J].天津农业科学,2014,20(8):29-31.
[14]VERENA N,JUAN D,U RUTH C.Assessment of the nutritional composition of quinoa (Chenopodium quinoa Willd.)[J].Food Chemistry,2016,193:47-54.
[15]PEIRETTI P G,GAI F,TASSONE S.Fatty acid profile and nutritive value of quinoa (Chenopodium quinoa Willd.) seeds and plants at different growth stages[J].Animal Feed Science and Technology,2013,183(1/2):56-61.
[16]HIROSE Y,FUJITA T,ISHII T,et al.Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan[J].Food Chemistry,2010,119(4):1300-1306.
[17]WRIGHTK H,PIKE OA,FAIRBANKS DJ,et al.Composition of atriplex hortensis,sweet and bitter Chenopodium quinoa seeds[J].Journal of Food Science,2010,67(4):1383-1385.
[18] ABDERRAHIM F,HUANATICO E,SEGURA R,et al.Physical features,phenolic compounds,betalains and total antioxidant capacity of coloured quinoa seeds (Chenopodium quinoa Willd.)fromPeruvian Altiplano[J].Food Chemistry,2015,183:83-90.
[19]孔卫青.不同品种桑树根与毛状根总黄酮含量比较[J].山西农业科学,2015,43(7):828-830.
[20]侯名语,崔顺立,穆国俊,等.花生种子黄酮及多酚含量的生态差异分析[J].华北农学报,2017,32(3):155-160.

