谷子种子DNA快速提取新方法
庞 冰 ,王艳梅 ,郝建平 ,,王陆军 ,王创云 ,李培良 ,邓艳芳,周 琼,李志敏,董永军,张婷婷,裴成成,牛学谦
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院作物科学研究所,山西太原030031;3.山西省玉米工程技术研究中心,山西太原030031;4.山西省农业科学院农业科技信息研究所,山西太原030031)
DNA作为分子试验的基础,其质量的好坏决定着试验的成功与否[1]。随着SSR,SNP和基因测序等高通量生物技术的发展,农作物研究需要检测的样本量显著增加,所以,能够在短时间内快速地提取大量高质量样本的DNA,是提高分子试验效率的有效手段[2-4]。
当前,谷子DNA提取的主要方法包括SDS(十二烷基磺酸钠)法、CTAB(十六烷基三乙基溴化铵)法和高盐提取法等[5-7]。但这几种提取方法均以植物幼叶为材料,需经过3~7 d的发芽期,需要进行液氮研磨,水浴、异丙醇沉淀耗时较长,批量核酸提取工作量繁重[8-10]。
本试验旨在探究直接以谷子种子为材料提取DNA的方法,简化操作流程,缩短提取周期,为谷子高通量分子检测奠定基础。
1 材料和方法
1.1 材料
山西省主要谷子种质资源及常规品种如表1所示。
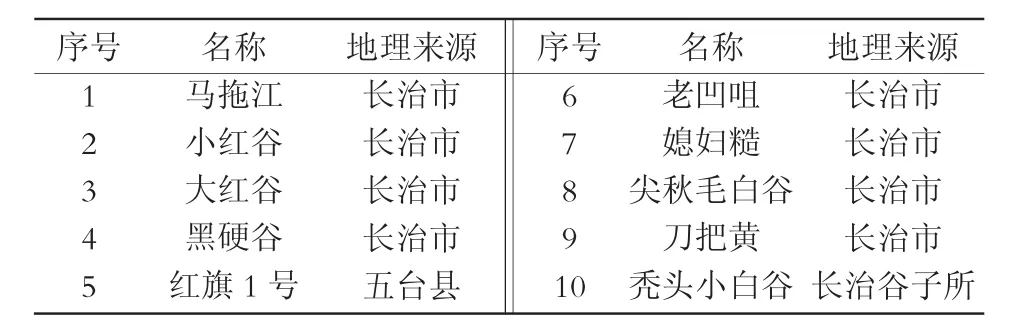
表1 10份材料名称及地理来源
1.2 试剂及主要仪器设备
2%的CTAB分离缓冲液;0.5 mol/L的EDTA;1 mol/L的 Tris-HCl;β-巯基乙醇;TE 缓冲液;氯仿 /异戊醇(24∶1);异丙醇;琼脂糖;TAE 缓冲液;乙醇(70%);GelStain。
高速冷冻离心机(Eppendorf 5810R);PCR仪(eppendorf);微量紫外分光光度计(北京凯奥5600);电泳仪(北京君意东方JUNYI3000E)。
1.3 试验方法
1.3.1 谷子基因组DNA提取 取种子0.1 g或幼叶50 mg,机械粉碎;加入 800 μL CTAB 提取液,65 ℃水浴15 min,期间不定期摇匀;加入等体积氯仿/异戊醇,混匀3 min,以12 000 r/min离心5 min,取上清,重复2次;加入0.8倍体积的异丙醇(-20℃预冷),置于-20℃放置5 min;取出后12 000 r/min离心1 min,弃上清;加入500 μL的70%乙醇,摇匀;小心将酒精倒出,自然风干后加入50 μL含RNase的TE缓冲液,保存备用。
1.3.2 DNA质量检测 采用0.8%琼脂糖进行电泳检测;采用紫外分光光度计测定A260/280值及其质量浓度。
1.3.3 SSR-PCR检测 引物名称为 SiGMS462,正向序列:AGGCCCAGTTTAAATGCAAG;反向序列CTAGGAAGCATCATCCTCCG。反应体系(20 μL):DNA模板60ng;10×Buffer(含MgCl2)2μL;2.5mmol/L dNTPs 1 μL;10 mmol/L 引物各 0.5 μL;2.5 U/μL Taq酶 0.1 μL;ddH2O12.9 μL。反应条件:94 ℃ 5 min;94℃30 s,52℃40 s,72℃ 1 min,循环 35次;72℃延伸10 min。采用0.8%琼脂糖进行电泳检测,120 V电泳45 min。
2 结果与分析
2.1 谷子基因组DNA的纯度与质量浓度分析
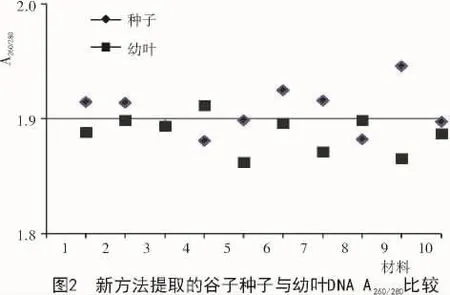
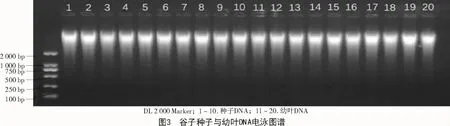
采用新方法提取的幼叶DNA质量浓度比种子高,但个体差异较大,最高可达 4 671.88 ng/μL,最低为 2 530.51 ng/μL,总体趋势不稳定;新方法提取的种子DNA总体趋势相对稳定,基本都在2 000~3 000 ng/μL(图1、表2)。采用新方法提取的种子和幼叶的核酸,A260/280值均处于 1.8~2.0(图 2);经过琼脂糖电泳检测,结果显示,所得条带清晰,一致度高,无拖尾现象,DNA完整性较好(图3)。说明使用新方法提取的种子DNA质量与幼叶一致,无明显差异。
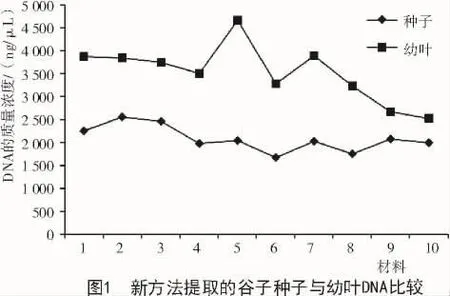
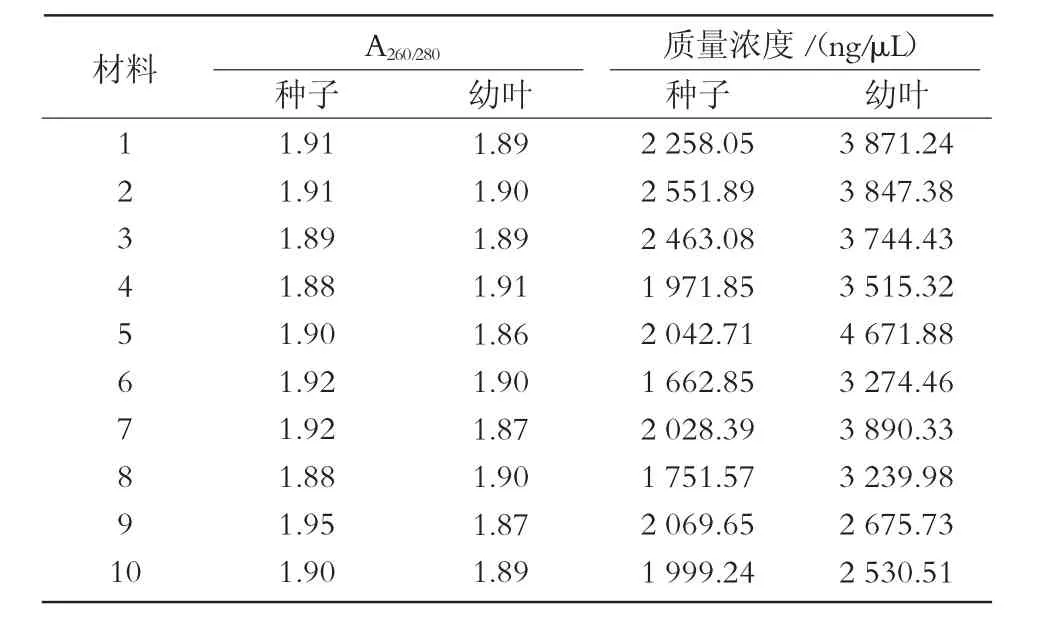
表2 谷子种子与幼叶基因组DNA紫外分光光度计检测结果
2.2SSR-PCR 验证效果
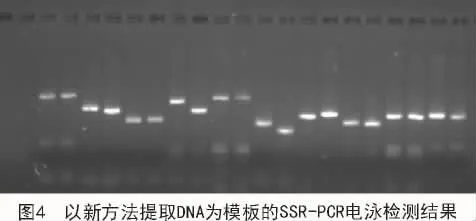
为验证新方法提取的DNA能否用于SSR分子标记试验,采用SSR引物SiGMS462对所提取的谷子核酸进行扩增。从图4可以看出,扩增产物的电泳条带清晰,多态性显著。表明新方法提取的DNA能够满足SSR等分子标记检测对DNA质量与数量的要求。
3 讨论与结论
随着谷子基因组测序的完成,谷子分子标记开发与检测成为当前的研究热点。作为谷子分子标记检测的第1步,核酸提取的结果直接影响下游试验,因此,找到一套简便、高效的DNA提取方法很有必要[11-13]。近年来,人们对于谷子基因组DNA提取方法进行了大量的研究,如碱处理法[14]、高温水煮法[15]、SDS 一步法[16]、TE 研磨法[17]等,这些提取方法速度快、成本低,避免使用液氮研磨、苯酚等有毒化学试剂,甚至将破碎后的提取液直接作为模板,但都存在所得DNA质量不稳定,无法保证后续分子检测的准确性[18-20]。并且所用材料多为谷子的幼叶,需要加入β-巯基乙醇等防止氧化,对人体以及环境会造成一定程度的危害[21-22]。
本试验直接以谷子干种子为材料进行DNA提取,无需经过3~7 d的发苗期,无需液氮研磨,直接通过机械研磨破碎细胞壁,减少了核酸在异丙醇中的沉淀时间,提取过程简便、高效。同时无需加入苯酚、β-巯基乙醇等对人体有害的试剂,所获DNA能够满足SSR等分子检测试验的需求,为实现谷子高通量分子检测奠定了基础。
参考文献:
[1]周晶,曾庆涛,刘铨义,等.一种适用于棉花种子的DNA快速提取方法[J].作物杂志,2014(2):31-33.
[2]魏琦超,畅丽萍,周岩,等.利用改良CTAB法提取小麦干种子总 DNA[J].山西农业科学,2009,37(6):30-32.
[3]王惠,郭峰,关超,等.适用于SSR分析的半粒水稻干种子DNA快速提取[J].科技导报,2013(25):58-60.
[4]田丽波,谷幸幸,商桑,等.苦瓜基因组DNA的提取及ISSR扩增体系的优化[J].中国农学通报,2013,29(4):88-93.
[5]韩玉杰,贾炜珑,王自霞,等.几种提取植物DNA方法的比较[J].山西农业科学,2008,36(7):17-19.
[6]凌莉,李志勇,黄韵,等.食品中植物基因组DNA提取纯化方法研究进展[J].食品科技,2012(5):6-10,15.
[7]张换样,李静,南芝润,等.甘薯DNA的小量快速提取[J].山西农业科学,2009,37(1):12-14.
[8]戴剑,洪德林,张大栋,等.一种快速高效的DNA提取方法研究[J].麦类作物学报,2011(3):437-442.
[9]龚双军,杨立军,刘辉,等.1种小麦白粉病菌DNA基因组的微量简捷提取方法[J].微生物学杂志,2011(1):24-27.
[10]颜松.药用植物基因组DNA提取及铁皮石斛RAPD反应体系的优化[D].重庆:西南交通大学,2009.
[11]张晓祥,王玲,寿路路.一种快速提取小麦基因组DNA的改良CTAB 方法[J].中国农学通报,2012,28(36):46-49.
[12]许明,程祖锌,黄志伟,等.一种适于转基因水稻PCR检测的微量 DNA 快速提取法[J].生物技术通报,2010(3):128-130.
[13]王兰,龙云铭,刘耀光.一种用于PCR的植物基因组DNA快速制备方法[J].分子植物育种,2009,7(2):425-428.
[14]楼巧君,陈亮,罗利军.三种水稻基因组DNA快速提取方法的比较[J].分子植物育种,2005(5):749-752.
[15]任海龙.药用植物大黄种子基因组DNA的提取方法研究[J].山西农业科学,2018,46(3):325-327,349.
[16]刘风路,张金丽,李靖,等.西南地区榧树属植物3种不同总DNA 提取方法的比较分析 [J].天津农业科学,2018,24(3):1-4.
[17]文静,谢培,孙琛,等.珠子参新鲜和干燥块茎DNA提取方法的比较研究[J].陕西农业科学,2018,64(2):1-3,11.
[18]盛鸥,张玉娥,邓贵明,等.香蕉不同组织的基因组DNA制备方法的比较[J].分子植物育种,2017,15(12):5052-5059.
[19]董永军,王陆军,郝建平,等.玉米干种子基因组DNA提取方法的改进[J].山西农业科学,2017,45(12):1903-1906.
[20]王瑞云,刘笑瑜,王海岗,等.用高基元微卫星标记分析中国糜子遗传多样性[J].中国农业科学,2017,50(20):3848-3870.
[21]闫玖英,马长青,常博,等.改良CTAB法用于苹果果实基因组DNA 的提取[J].分子植物育种,2017,15(9):3610-3615.
[22]曾巧英,凌秋平,胡斐,等.5种提取方法对甘蔗汁中DNA提取的效果[J].安徽农业科学,2017,45(25):136-138,152.

