TNF-α和IL-1β通过MAPK通路上调人支气管平滑肌细胞的缓激肽受体和内皮素受体
蔡 艳,杨旭东,雷 莹
(1.西安交通大学第二附属医院药学部,西安 710004;2.西安交通大学医学部生物化学与分子生物学系,西安 710061;3.深圳华大生命科学研究院,深圳 518083)
气道高反应性(AHR)是哮喘最重要的临床特征之一,AHR的病理过程与慢性气道炎症密切相关[1-3]。炎性介质肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)在慢性呼吸道炎症发生期间被合成和释放,且在哮喘患者的支气管肺泡灌洗液中的水平增加[4]。研究发现,这2种细胞因子可促进哮喘中的气道高反应性和气道炎症[5-6]。
缓激肽、内皮素-1和血栓素A2是重要的支气管收缩物质。缓激肽对非哮喘患者的肺和支气管无明显作用,但对哮喘患者的支气管有显著收缩作用[7]。研究发现,与对照组相比,哮喘患者体内的内皮素-1和血栓素A2的水平显著上调[8-10]。缓激肽和相关激肽,内皮素-1和血栓素A2分别作用于各自的G蛋白偶联受体(GPCRs)缓激肽B1和B2受体、内皮素A型和B型受体以及血栓素A2受体,诱导支气管收缩和引发炎性反应。
以往研究发现,TNF-α和IL-1β通过改变支气管收缩物质的G蛋白偶联受体的表达,参与诱导了气道高反应性的发生。TNF-α和IL-1β通过激活离体小鼠气管平滑肌细胞的丝裂原活化蛋白激酶(MAPK)途径,上调缓激肽B1和B2受体介导的收缩以及受体的表达[11-12]。以往研究证明,通过给予哮喘模型大鼠TNF-α受体进行治疗,可显著降低内皮素A受体(ETA)和内皮素B受体(ETB)介导的气道高反应性[13]。迄今为止,炎性细胞因子TNF-α和IL-1β与气道收缩性物质如缓激肽、内皮素-1和血栓素A2在人气道平滑肌细胞上的相互作用以及相关的信号调控通路仍不明确。本研究旨在探索TNF-α和IL-1β对人支气管平滑肌细胞缓激肽B1和B2受体,内皮素ETB受体和血栓素A2受体的影响,并发现其潜在的细胞内MAPK信号转导机制。
1 仪器与材料
1.1仪器 T100热循环仪,iQ5实时PCR检测系统(美国Bio-Rad公司)。
1.2试药 TNF-α,IL-1β,IL-6,IL-13,SP600125(1,9-吡唑烷酮),SB203580(4-(4-氟苯基)-2-(4-甲基亚磺酰基苯基)-5-(4-吡啶基)-1H-咪唑),U0126(1,4-二氨基-2,3-二氰基-1,4-双-(2-氨基苯硫基)丁二烯)(美国Sigma公司);LY294002(2-(4-吗啉基)-8-苯基-4H-1-苯并吡喃-4-酮)(美国Cayman Chemical公司);吡啶-6(美国Santa Cruz公司);SMEM细胞培养基,聚-L-赖氨酸(美国ScienCell实验室);RNAfast1000总RNA提取试剂盒(中国先锋生物技术有限公司);cDNA逆转录合成试剂盒(美国Thermo Fisher Scientific公司);FastStart Universal SYBR Green Master试剂盒(瑞士Roche公司)。
1.3细胞培养 人支气管平滑肌细胞(HBSMCs),购自美国ScienCell实验室,将细胞在平滑肌细胞培养基(SMEM)中以5×103个活细胞/cm2的密度接种在聚-L-赖氨酸包被的细胞培养瓶中。当细胞超过90%融合时,将细胞传代培养或移至24孔板中,在此阶段添加细胞因子和抑制剂。
2 方法
2.1总RNA的提取和逆转录到cDNA 总RNA的提取和逆转录到cDNA使用RNAfast1000总RNA提取试剂盒提取总RNA。提取总RNA的质量和数量分别用260/280 nm和260/230 nm的紫外吸光度值比进行评估。所有RNA样品均符合完整性标准,不含蛋白质、有机物和基因组DNA污染物(即260/280 nm处的吸光度值比为1.8~2.1,260/230 nm处的吸光度值比为1.65~1.8)。使用T100热循环仪,用cDNA逆转录合成试剂盒在20 μL体积反应中进行总RNA向cDNA的逆转录。将RNA在65 ℃孵育5 min变性。变性后,将RNA立即在冰中冷却至少1 min,并将反转录母体混合物加入管中。反转录反应在42 ℃进行1 h,70 ℃反应10 min,后将cDNA在-80 ℃保存直到进行实时定量PCR。
2.2实时聚合酶链反应(实时PCR) 实时聚合酶链反应(实时PCR)使用FastStart Universal SYBR Green Master试剂盒在20 μL反应中,于iQ5实时PCR检测系统上进行实时定量PCR反应,95 ℃加热10 min,随后在95 ℃变性20 s,退火温度20 s,72 ℃延伸30 s,55~100 ℃的熔解曲线为记录。见表1。由表1可知,研究中使用的所有PCR引物均使用Oligo 6.65软件设计,并通过DNA技术合成。采用ΔΔCT方法计算受体mRNA的相对量。将管家基因β-actin的mRNA的CT值作为使受体的mRNA的相对量标准化的参考。通过相同样品中β-actin mRNA的CT值与受体mRNA的CT值的比值获得mRNA的相对量。
2.3总RNA的提取和逆转录 使用RNAfast1000总RNA提取试剂盒提取总RNA。总RNA的提取质量和数量分别用260/280 和260/230紫外吸光度值比进行评估。所有RNA样品均符合完整性标准,不含蛋白质、有机物和基因组DNA污染物(即260/280吸光度值比为1.8~2.1,260/230吸光度值比为1.65~1.8)。使用T100热循环仪,用cDNA逆转录合成试剂盒在20 μL体积反应中进行总RNA向cDNA的逆转录。RNA于65 ℃孵育5 min变性,之后置于冰中冷却至少1 min,并将逆转录反应体系混合物按照建议比例加入管中。逆转录反应在42 ℃进行1 h,70 ℃反应10 min,然后将得到的cDNA产物于-80 ℃保存至进行实时定量PCR。
2.4实时聚合酶链反应(实时PCR) 使用FastStart Universal SYBR Green Master试剂盒在20 μL反应中,于iQ5实时PCR检测系统上进行实时定量PCR反应,95 ℃加热10 min,随后在95 ℃变性20 s,退火温度20 s,72 ℃延伸30 s,记录55~100 ℃的熔解曲线。由表1可知,所用引物信息,研究中使用的所有PCR引物均使用Oligo 6.65软件设计,并通过DNA技术合成。采用ΔΔCT方法计算受体mRNA的相对量(相对量为相对于管家基因mRNA量的倍数)。将管家基因β-actin的mRNA的CT值作为参比值,计算受体mRNA的相对量。通过相同样品中β-actin mRNA的CT值与受体mRNA的CT值的比值获得mRNA的相对量。
表1引物信息
Tab.1 Primer information

基因名序列ID序列长度/bp退火温度/℃β⁃actinNM_001101.3F:5′⁃ATCGTGCGTGACATTAAGGAGAAG⁃3′R:5′⁃AGGAAGGAAGGCTGGAAGAGTG⁃3′17460B1RNM_000710.3F:5′⁃ATATTCTGGGTTTCCTCCTAC⁃3′R:5′⁃GCTGTGGTCTTGCTATCC⁃3′12960B2RNM_000623.3F:5′⁃AGGTGCTGCGGAACAACG⁃3′R:5′⁃GGAAGGTGCTGATCTGGAAGG⁃3′12860β2RNM_000024.5F:5′⁃CCTATGGGAATGGCTACTC⁃3′R:5′⁃CCTTGTGAATCAATGTTATCG⁃3′16260ETBRNM_000115.3F:5′⁃GCGAAACGGTCCCAATATC⁃3′R:5′⁃GCACATAGACTCAGCACAG⁃3′18560TXA2RNM_001060.5F:5′⁃CCCTTCTGGTCTTCATCG⁃3′R:5′⁃CGGCGGAACAGGATATAC⁃3′15958
3 结果
3.1TNF-α上调HBSMCs中缓激肽B1和B2受体mRNA 将质量浓度为1,10和100 ng·mL-1的TNF-α加入HBSMCs培养体系中24 h,通过实时PCR测定缓激肽B1和B2受体、ETB受体、血栓素A2受体和β2肾上腺素受体的mRNA水平。见图1。由图1A可知,TNF-α增加了缓激肽B1和B2受体的mRNA水平,且这种效应具有浓度依赖性,而ETB受体、血栓素A2受体或β2肾上腺素受体的mRNA水平不受TNF-α的影响。为了评估TNF-α的效应-时间相关性,分别用质量浓度为10 ng·mL-1的TNF-α处理HBSMCs 3,6,12,24和48 h。由图1B可知,在未刺激的HBSMCs中可检测到低水平的缓激肽B1和B2受体mRNA。6 h时,TNF-α增加了缓激肽B1和B2受体的mRNA水平,这种mRNA水平的增加可随着孵育时间延长至48 h。
3.2IL-1β上调HBSMCs中内皮素B受体mRNA 将质量浓度为1,10和 100 ng·mL-1的IL-1β加入HBSMCs培养体系中24 h,通过实时PCR测定缓激肽B1和B2受体、ETB受体、血栓素A2受体和β2肾上腺素受体的mRNA水平。见图2。由图2A可知,IL-1β增加了ETB受体的mRNA水平,这种效应具有浓度依赖性,而缓激肽B1和B2受体,血栓素A2受体或β2肾上腺素受体的mRNA水平不受IL-1β的影响。为了评估IL-1β的效应-时间相关性,将质量浓度为10 ng·mL-1的IL-1β加入HBSMCs培养体系中维持3,6,12,24和48 h。由图2B可知,在未刺激的HBSMCs中可检测到低水平的ETB受体mRNA。6 h时,IL-1β开始增加内皮素B受体mRNA水平,这种效应随着孵育时间延长至48 h。
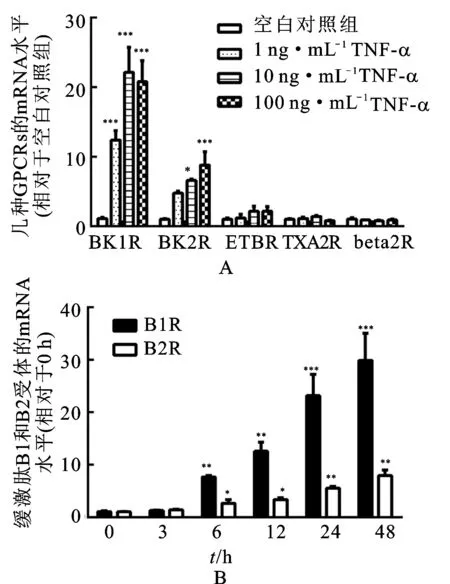
图1TNF-α刺激后HBSMCs中G蛋白偶联受体的mRNA

Fig.1 G-protein coupled receptors mRNA in HBSMCs when stimulated with TNF-α
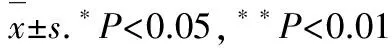

图2IL-1β刺激后HBSMCs中G蛋白偶联受体的mRNA

Fig.2 G-protein coupled receptors mRNA in HBSMCs when stimulated with IL-1β
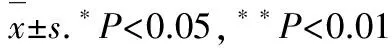
见图3。由图3可知,IL-6(质量浓度为1,10和100 ng·mL-1)和IL-13(质量浓度为0.5,5和50 ng·mL-1)分别与HBSMCs共同孵育24 h后,对缓激肽B1和B2受体、ETB受体、血栓素A2受体和β2肾上腺素受体的mRNA水平均无显著影响。
3.3TNF-α通过p38和JNK通路上调缓激肽B1和B2受体mRNA 为了确认MAPK信号通路是否参与TNF-α对缓激肽B1和B2受体mRNA水平的上调作用,在质量浓度为10 ng·mL-1的TNF-α加入前1 h,将p38 MAPK抑制剂SB203580(10 μmol·L-1)、c-Jun N-末端激酶(JNK)抑制剂SP600125(10 μmol·L-1)、MAPK/ERK激酶(MEK1/2)抑制剂U0126(10 μmol·L-1)、NF-κB通路IκB激酶(IKK)抑制剂TPCA-1(10 μmol·L-1)和相应的空白溶剂加入到HBSMCs培养液中,分别与HBSMCs共同孵育24 h后,测试缓激肽B1和B2受体的mRNA水平变化,见图4。由图4A和4B可知,SB203580和SP600125降低了由TNF-α上调的缓激肽B1和B2受体mRNA水平,而U0126和TPCA-1未有明显作用。
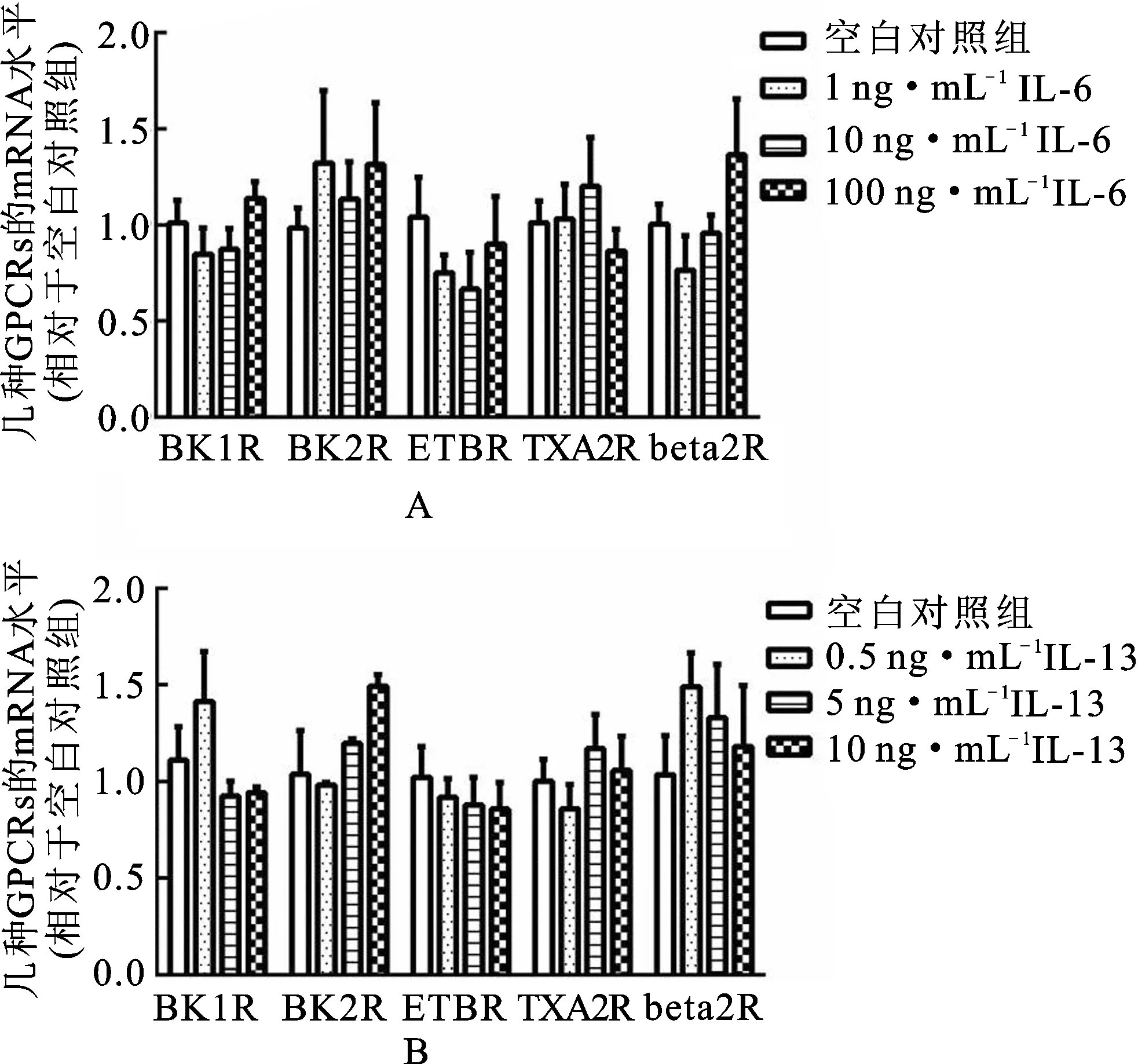
图3IL-6和IL-13刺激后HBSMCs中G蛋白偶联受体的mRNA

Fig.3 G-protein coupled receptors mRNA in HBSMCs when stimulated with IL-6 and IL-13
已报道Janus激酶/信号转导和转录激活因子(JAK/STAT)通路和Ⅰ类磷脂酰肌醇3激酶(PI3K)通路参与调节TNF-α介导的细胞增殖。为了研究这些信号通路是否也参与调节缓激肽B1和B2受体mRNA水平,在质量浓度为10 ng·mL-1的TNF-α加入前1 h加入泛JAK抑制剂吡啶-6(10 μmol·L-1)和PI3K抑制剂LY294002(10 μmol·L-1)至HBSMCs培养体系中。由图4A和4B可知,它们都不影响缓激肽B1和B2受体的mRNA水平。
3.4IL-1β通过MEK1/2和下游IκB激酶上调内皮素B受体Mrna 为了研究 MAPK信号通路是否参与IL-1β对ETB受体mRNA水平的上调作用,在质量浓度为10 ng·mL-1的IL-1β加入前1 h,向HBSMCs培养体系中分别加入p38 MAPK抑制剂SB203580(10 μmol·L-1),JNK抑制剂SP600125(10 μmol·L-1),MEK1/2抑制剂U0126(10 μmol·L-1)和IκB激酶抑制剂TPCA-1(10 μmol·L-1)或空白溶剂。由图4C可知,10 (〗μmol·L-1)〗的U0126和TPCA-1几乎消除了IL-1β对ETB受体mRNA水平的上调作用,而SB203580和SP600125无显著影响。
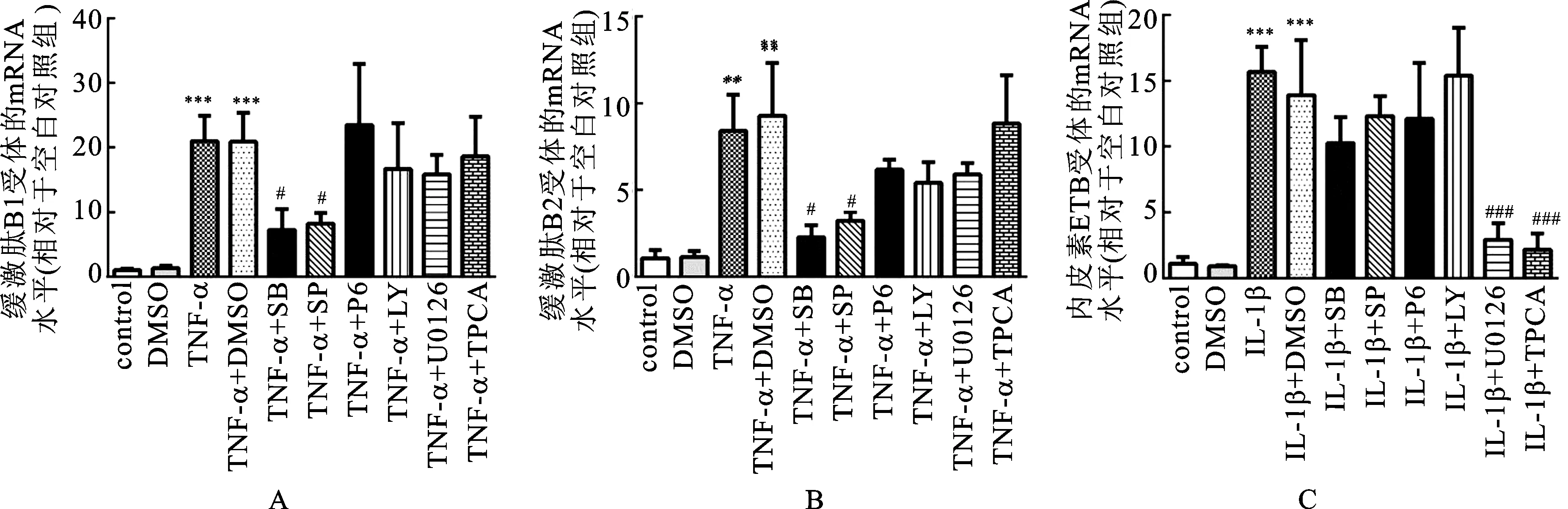
图4MAPK与NF-κB通路参与上调TNF-α和IL-1β诱导的缓激肽受体和内皮素受体mRNA

Fig.4 MAPK and NF-κB pathways were involved in TNF-αand IL-1βinduced upregulation of bradykinin receptors and endothelin receptor mRNA
本实验还研究了pan-JAK抑制剂吡啶-6(10 μmol·L-1)和PI3K抑制剂LY294002(10 μmol·L-1)是否参与IL-1β对HBSMCs中ETB受体mRNA水平的调节作用。由图4C可知,它们均不影响ETB受体mRNA的水平。
4 讨论
已有研究提出,促炎性细胞因子TNF-α和IL-1β在免疫反应和变应性哮喘炎症发展中发挥着重要作用[14]。之前的研究发现,抗TNF-α抗体英夫利昔单抗降低了过敏性哮喘模型大鼠支气管收缩反应,并减少了肺部的炎症反应[13]。本研究中,我们观察了炎症细胞因子TNF-α和IL-1β与几种重要的支气管收缩剂(如缓激肽、血栓素A2和内皮素-1)之间的相互作用。实验发现,TNF-α上调了缓激肽B1和B2受体mRNA,IL-1β上调了人支气管平滑肌细胞中的ETB受体mRNA。P38MAPK抑制剂SB203580、JNK抑制剂SP600125、ERK1/2抑制剂U0126和IκB激酶抑制剂TPCA-1的干预实验显示MAPK通路参与这些上调机制。
哮喘患者对激肽类物质表现出高反应性[15],且与正常人相比,过敏性呼吸道炎症受试者的气道中缓激肽B1和B2受体表达上调[16-17]。以往在小鼠气管上的研究发现,缓激肽B1和B2受体都被TNF-α诱导上调[12],本研究结果与这一发现相符,TNF-α同样诱导人支气管平滑肌细胞的缓激肽B1和B2受体mRNA上调。研究发现,人支气管平滑肌细胞在加入TNF-α后截至48 h,缓激肽B1和B2受体mRNA随着时间的延长而增加。其他小组对原代人气管平滑肌细胞的研究发现,TNF-α增加了缓激肽诱导的胞质游离Ca2+浓度上调,且需要至少6 h的刺激才可完成对Ca2+的动员[16],这一发现解释了本研究中缓激肽B1和B2受体mRNA上调的起始时间为6 h。综上所述,TNF-α可能通过增加气道平滑肌表面缓激肽受体的表达来上调过敏性呼吸道炎症患者对体内缓激肽的反应。
IL-1β是哮喘气道平滑肌高反应性的关键调节因子[19]。之前在小鼠气管中的研究表明,IL-1β降低了ETB受体介导的收缩反应,且气管平滑肌中ETB受体mRNA被下调[20]。本研究显示,IL-1β上调了人支气管平滑肌细胞ETB受体mRNA。在离体人支气管中,ETB受体分布于呼吸道平滑肌细胞并介导收缩反应,而ETA受体存在于呼吸道上皮细胞中,介导一氧化氮的释放,抵消收缩效应[21]。与之不同的,小鼠气管平滑肌中可同时检测到ETA和ETB受体的功能和mRNA,且2种类型的受体均介导收缩反应[20]。因此,人和小鼠呼吸道之间ETA和ETB受体的不同分布和功能可能是IL-1β对小鼠和人气道平滑肌细胞的不同作用的一个解释。
MAPK信号通路可诱导核因子κB(NF-κB)等转录因子,并参与受体的转录。以往研究表明,MAPK信号通路和下游NF-κB的激活可导致小鼠气道平滑肌细胞中G蛋白偶联受体的改变[22-23]。JNK抑制剂SP600125降低了TNF-α对体外培养的小鼠气管缓激肽B1和B2受体mRNA的上调[20]。本研究中,SB203580和SP600125降低了TNF-α诱导的HBSMCs中缓激肽B1和B2受体mRNA的上调,表明JNK和P38 MAPK途径参与了该过程。因此,TNF-α和缓激肽之间的相互作用,很可能在人和小鼠气道平滑肌细胞中经由类似的细胞内信号机制发生。以往研究证实,MEK1/2信号通路参与调解大气污染颗粒物对大鼠支气管平滑肌ETB受体的上调作用[24]。在本研究中,MEK抑制剂U0126和IκB激酶抑制剂TPCA-1,显著降低IL-1β上调的人气道平滑肌细胞中ETB受体mRNA。因此,本研究为MEK1/2在呼吸道炎症中调节ETB受体的表达提供了更多的证据。
综上所述,研究发现TNF-α上调HBSMCS中缓激肽B1和B2受体mRNA,IL-1β上调HBSMCS中内皮素ETB受体mRNA。P38 MAPK抑制剂SB203580和JNK MAPK抑制剂SP600125显著降低TNF-α上调的缓激肽B1和B2受体mRNA,MEK1/2抑制剂U0126和IκB激酶抑制剂TPCA-1显著降低IL-1β上调的ETB受体mRNA。本研究为炎性细胞因子诱导的支气管高反应性的发生机制提供了进一步的证据。
参考文献:
[1] Busse W W.The relationship of airway hyperresponsiveness and airway inflammation:airway hyperresponsiveness in asthma:its measurement and clinical significance[J].Chest,2010,138(2 Suppl):4S-10S.
[2] 邓跃林,吴华杰,柴华,等.孟鲁司特钠联合咳喘三伏贴对哮喘患儿血清IL-4和IFN-γ水平的影响及其机制[J].西北药学杂志, 2017, 32(1):102-105.
[3] 张静玉,王彦辉,张明亮.多索茶碱与盐酸氨溴索联合治疗支气管哮喘急性期患者的临床疗效观察[J].西北药学杂志, 2016,31(2):192-194.
[4] Broide D H, Lotz M, Cuomo A J, et al.Cytokines in symptomatic asthma airways [J].J Allergy Clin Immunol, 1992, 89(5):958-967.
[5] Stamatiou R,Paraskeva E,Gourgoulianis K,et al.Cytokines and growth factors promote airway smooth muscle cell proliferation[J].ISRN Inflamm,2012,2012:731472.
[6] Reuter S,Heinz A,Sieren M,et al.Mast cell-derived tumour necrosis factor is essential for allergic airway disease[J].Eur Respir J,2008,31(4):773-782.
[7] Fuller R W,Dixon C M,Cuss F M,et al.Bradykinin-induced bronchoconstriction in humans.Mode of action[J].Am Rev Respir Dis,1987,135(1):176-180.
[8] Dogne J M,de Leval X,Benoit P,et al.Therapeutic potential of thromboxane inhibitors in asthma[J].Expert Opin Investig Drugs,2002,11(2):275-281.
[9] El-Gamal Y,Hossny E,Awwad K,et al.Plasma endothelin-1 immunoreactivity in asthmatic children[J].Ann Allergy Asthma Immunol,2002,88(4):370-373.
[10]Trakada G,Tsourapis S,Marangos M,et al.Arterial and bronchoalveolar lavage fluid endothelin-1 concentration in asthma[J].Respir Med,2000,94(10):992-996.
[11]Zhang Y,Adner M,Cardell L O.IL-1beta-induced transcriptional up-regulation of bradykinin B1 and B2 receptors in murine airways[J].Am J Respir Cell Mol Biol,2007,36(6):697-705.
[12]Zhang Y,Adner M,Cardell L O.Up-regulation of bradykinin receptors in a murinein-vitromodel of chronic airway inflammation[J].Eur J Pharmacol,2004,489(1/2):117-126.
[13]Cai Y,Cao Y X,Lu S M,et al.Infliximab alleviates inflammation and ex vivo airway hyperreactivity in asthmatic E3 rats[J].Int Immunol,2011,23(7):443-451.
[14]Patel J K,Clifford R L,Deacon K,et al.Ciclesonide inhibits TNFα-and IL-1β-induced monocyte chemotactic protein-1 (MCP-1/CCL2) secretion from human airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2012,302(8):L785-L792.
[15]Polosa R,Holgate S T.Comparative airway response to inhaled bradykinin,kallidin,and [des-Arg9]bradykinin in normal and asthmatic subjects[J].Am Rev Respir Dis,1990,142(6 Pt 1):1367-1371.
[16]Christiansen S C,Eddleston J,Woessner K M,et al.Up-regulation of functional kinin B1 receptors in allergic airway inflammation[J].J Immunol,2002,169(4):2054-2060.
[17]Ricciardolo F L,Petecchia L,Sorbello V,et al.Bradykinin B2 receptor expression in the bronchial mucosa of allergic asthmatics:the role of NF-κB[J].Clin Exp Allergy,2016,46(3):428-438.
[18]Amrani Y,Krymskaya V,Maki C,et al.Mechanisms underlying TNF-alpha effects on agonist-mediated calcium homeostasis in human airway smooth muscle cells[J].Am J Physiol,1997,273(5 Pt 1):L1020-L1028.
[19]Liao Z,Xiao H T,Zhang Y,et al.IL-1β:a key modulator in asthmatic airway smooth muscle hyper-reactivity [J].Expert Rev Respir Med,2015,9(4):429-436.
[20]Zhang Y,Adner M,Cardell L O.Interleukin-1beta attenuates endothelin B receptor-mediated airway contractions in a murine in vitro model of asthma:roles of endothelin converting enzyme and mitogen-activated protein kinase pathways[J].Clin Exp Allergy,2004,34(9):1480-1487.
[21]Naline E,Bertrand C,Biyah K,et al.Modulation of ET-1-induced contraction of human bronchi by airway epithelium-dependent nitric oxide release via ET(A) receptor activation[J].Br J Pharmacol,1999,126(2):529-535.
[22]Lei Y,Cao Y X,Xu C B,et al.The Raf-1 inhibitor GW5074 and dexamethasone suppress sidestream smoke-induced airway hyperresponsiveness in mice[J].Respir Res,2008,9:71.
[23]Lei Y,Zhang Y,Cao Y,et al.Up-regulation of bradykinin receptors in rat bronchi via I kappa B kinase-mediated inflammatory signaling pathway[J].Eur J Pharmacol,2010,(634):149-161.
[24]Wang R,Xiao X,Cao L,et al.Airborne fine particulate matter induces an upregulation of endothelin receptors on rat bronchi[J].Environ Pollut,2016,209:11-20.

