利用半制备型HPLC分离捆仙七中的非生物碱成分
仙 靓,金 明,马艳茹,张新新,郭增军
(西安交通大学药学院,西安 710061)
药材捆仙七是“陕西七药”中重要的品种,分布在我国陕西、甘肃、四川、湖北、浙江等省及日本等地[1-6]。据《中华本草》记载,该药材具有清热解毒、祛风除湿、舒筋活络、消炎止痛和活血止带等作用,在民间应用广泛[7-9]。一般以全草入药,味苦微辛,可作为复方药治疗老年慢性支气管炎和风湿性关节炎等疾病[10-14]。目前,国内外学者对捆仙七的生物碱成分进行了大量研究,发现捆仙七中含有大量孕甾烷型生物碱[15],但对其非生物碱成分的研究相对较少。本文用Semi-preparative HPLC法对捆仙七非生物碱部分进行分离并采用NMR等波谱学方法进行结构鉴定。
1 仪器与试药
1.1仪器 TM-010超声波清洗机(无锡台铭环保科技有限公司);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);XPE105电子天平(梅特勒-托利多仪器有限公司);UV-1800紫外可见分光光度计(日本岛津公司);New Style制备高效液相色谱仪(含N7000二元泵、NV3000 serials紫外双波长检测器、2 mL定量环和Easy Chrom色谱工作站,江苏汉邦科技有限公司);Megres C18色谱柱(10 mm×250 mm,5 μm);Bruker AM-400 MHz核磁共振光谱仪(美国Bruker公司)。
1.2试药 捆仙七药材采自西安交通大学医学部药学院药圃,经西安交通大学医学部药学院天然药物化学实验室鉴定为黄杨科(Buxacea)板凳果属(Pachysandra)植物顶花板凳果(PachysandraterminalisSieb.et Zucc.)的干燥全草。乙醇,工业纯(西安化学试剂厂);石油醚、乙酸乙酯和正丁醇均为分析纯(天津大茂化学试剂厂);盐酸,分析纯(武汉市鑫华松化工有限公司);氘代二甲基亚砜、氘代氯仿和氘代甲醇(美国Fisher公司);甲醇,色谱纯(天津科密欧化学试剂厂);水为自制双蒸水;柱层析硅胶和薄层色谱硅胶均为分析纯(青岛海浪硅胶干燥剂有限公司);其他试剂均为分析纯。
2 方法与结果
2.1捆仙七非生物碱部位的制备与分离 将7.5 kg捆仙七药材粗粉用10倍量乙醇回流提取3次,每次2 h,回收溶剂,得到1.5 kg乙醇提取物浸膏。取浸膏1.0 kg,用10倍量20 mL·L-1的盐酸进行溶解,过滤,得滤渣(即捆仙七非生物碱部位粗提物)。将上述滤渣用石油醚、乙酸乙酯和正丁醇等不同极性溶剂萃取,将萃取液减压浓缩后得到石油醚部位(25.3 g)、乙酸乙酯部位(36.2 g)和正丁醇部位(102.3 g)提取物。
取30 g捆仙七乙酸乙酯部位浸膏,用硅胶柱进行分离,流动相为石油醚-乙酸乙酯(100∶1~1∶10),收集洗脱液并合并,减压蒸干溶剂,得到Frac.A1~A10馏分。
将Frac.A5用硅胶柱进行分离,流动相为石油醚-乙酸乙酯(50∶1~1∶5),收集洗脱液并合并,得到Frac.A5-3及Frac.A5-4馏分。将Frac.A6用硅胶柱进行分离,流动相为石油醚-乙酸乙酯(30∶1~1∶5),收集洗脱液并合并,得到Frac.A6-6及Frac.A6-11馏分。
2.2Semi-preparative HPLC分离纯化
2.2.1Frac.A5-3馏分分离 将Frac.A5-3用色谱甲醇溶解,0.45 μm滤膜过滤,备用。用Semi-preparative HPLC法进行分离。色谱条件:流动相:甲醇-水(53∶47);柱温:室温;紫外检测波长:345 nm。将色谱图中的主峰收集,回收溶剂,得单体化合物1。见图1。
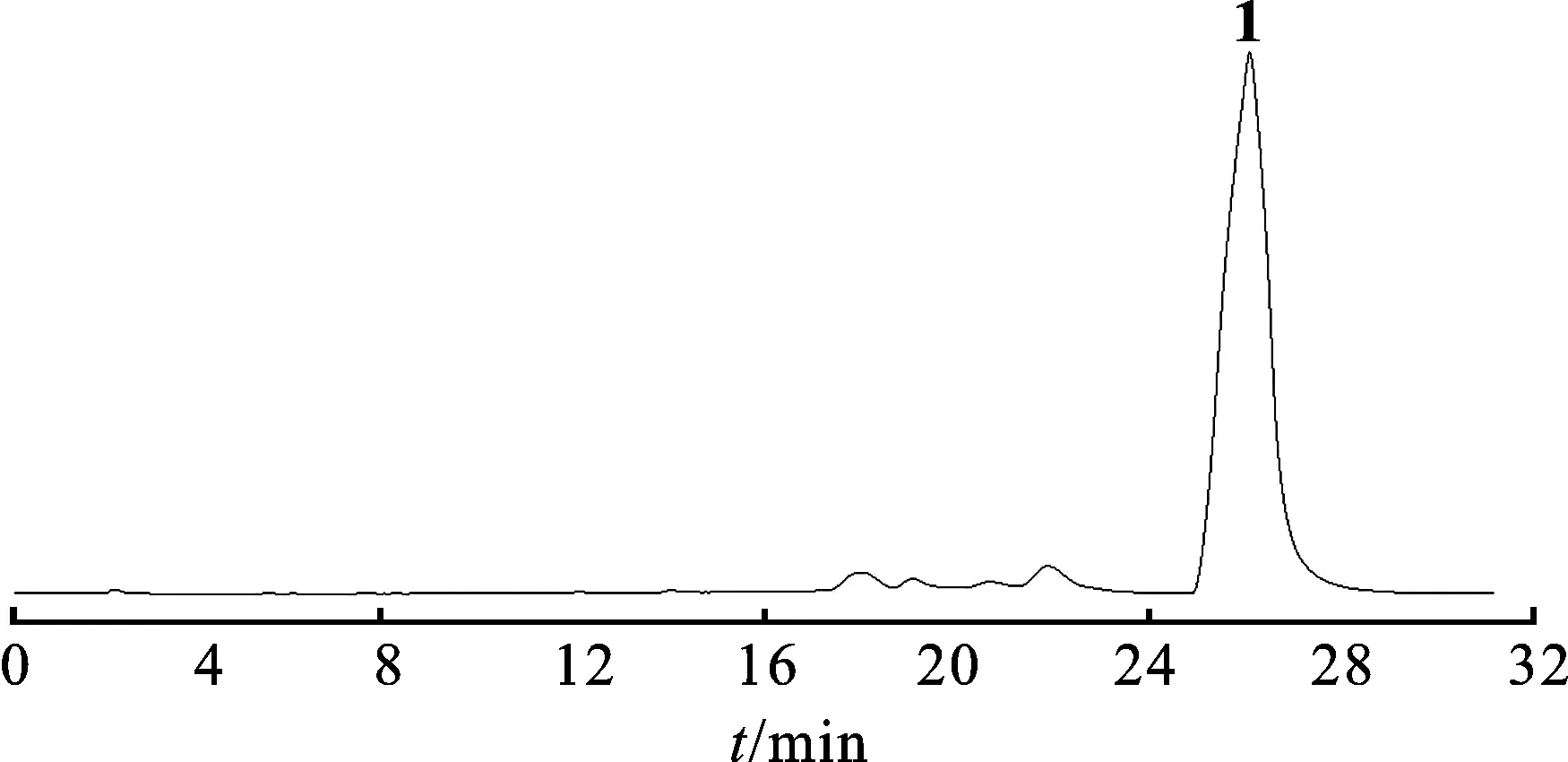
图1化合物1Semi-preparativeHPLC图
Fig.1 The Semi-preparative HPLC chromatogram of compound1
2.2.2Frac.A5-4馏分分离 将Frac.A5-4用色谱甲醇溶解,0.45 μm滤膜过滤,备用。Semi-preparative HPLC进行分离。色谱条件:流动相:甲醇-水(30∶70)洗脱;柱温:室温;紫外检测波长:250 nm。将色谱图中的主峰收集,回收溶剂,得单体化合物2和3。见图2。
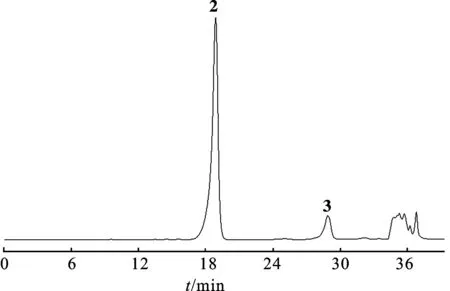
图2化合物2~3Semi-preparativeHPLC图
Fig.2 The Semi-preparative HPLC chromatogram of compounds2-3
2.2.3Frac.A6-6馏分分离 将Frac.A6-6用色谱甲醇溶解,0.45 μm滤膜过滤,备用。用Semi-preparative HPLC进行分离。色谱条件:流动相:甲醇-水(20∶80)梯度洗脱;柱温:室温;紫外检测波长:261 nm。将色谱图中的主峰收集,回收溶剂,得单体化合物4。见图3。
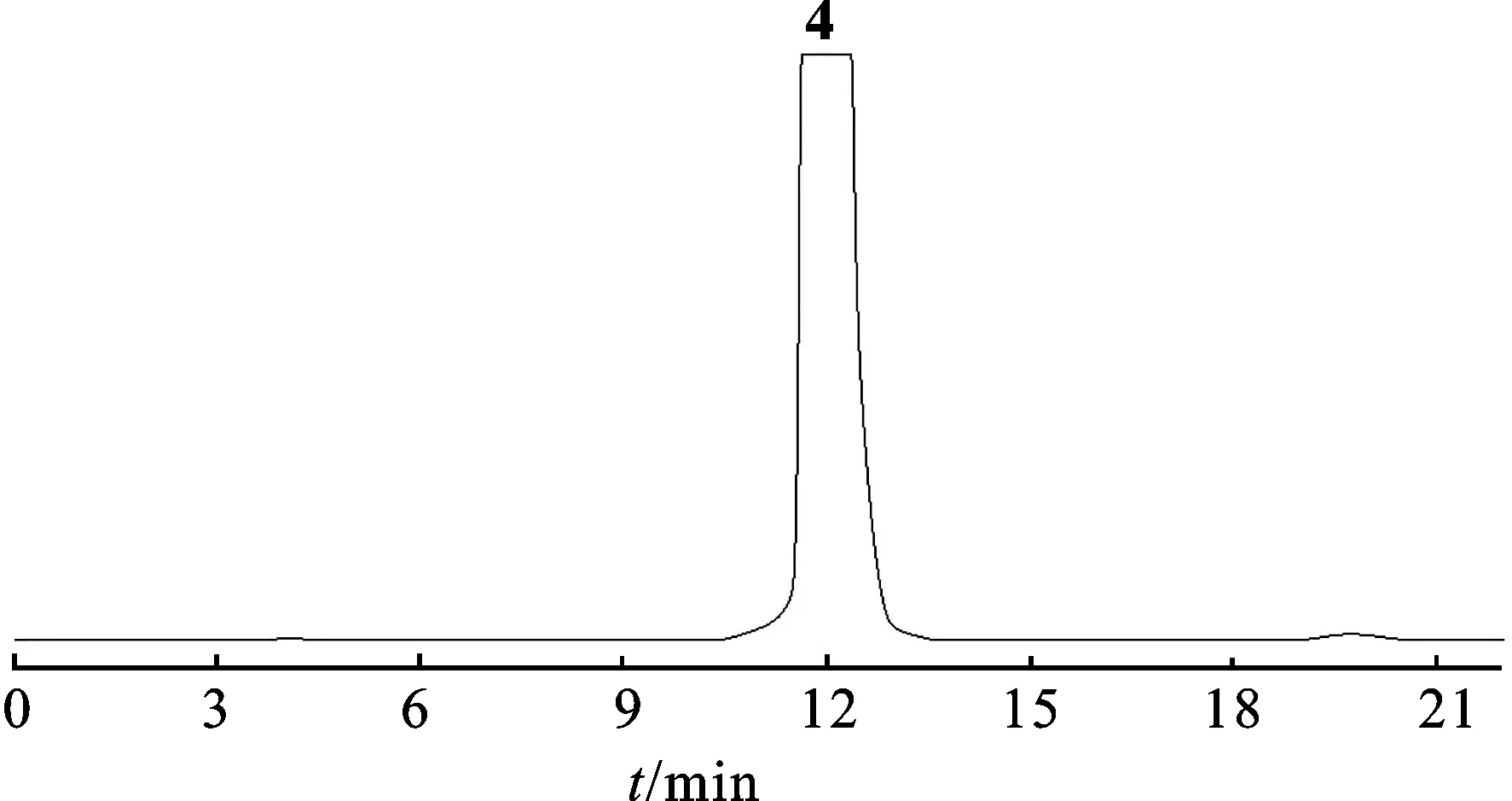
图3化合物4Semi-preparativeHPLC图
Fig.3 The Semi-preparative HPLC chromatogram of compound4
2.2.4Frac.A6-11馏分分离 将Frac.A6-11用色谱甲醇溶解,0.45 μm滤膜过滤,备用。Semi-preparative HPLC进行分离。色谱条件:流动相:甲醇-水(60∶40)梯度洗;柱温:室温;紫外检测波长:250 nm。将色谱图中的主峰收集,回收溶剂,得单体化合物5。见图4。
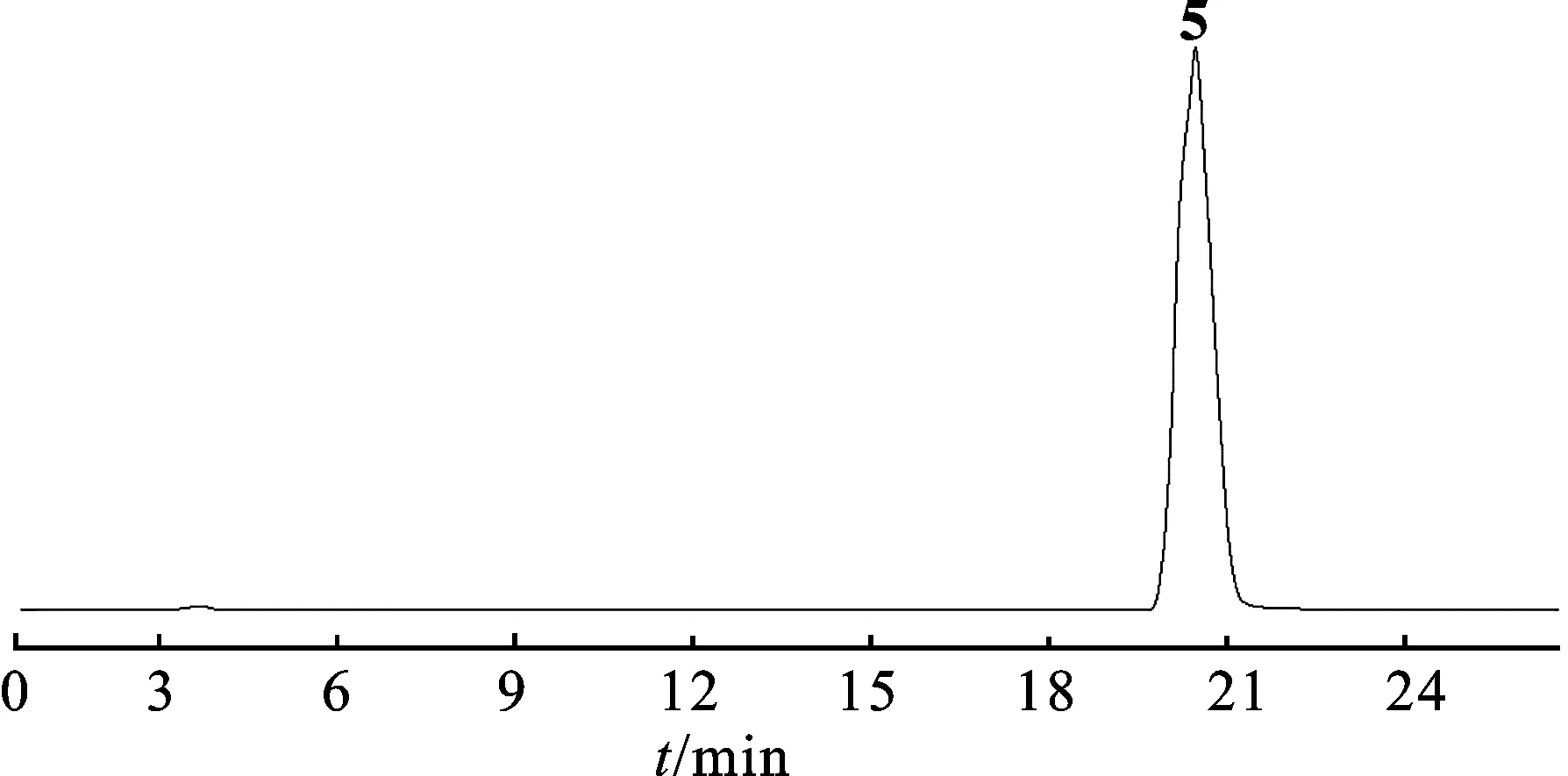
图4化合物5Semi-preparativeHPLC图
Fig.4 The Semi-preparative HPLC chromatogram of compound5
2.3化合物的结构鉴定
2.3.1化合物11H-NMR(400 MHz,DMSO)δppm:10.33 (s,1H),7.92 (d,J=9.4 Hz,1H),7.23 (s,1H),6.79 (s,1H),6.23 (d,J=9.4 Hz,1H),3.82 (s,3H)。13C-NMR(100 MHz,DMSO)δppm:56.30 (-OCH3),103.05(C-8),109.87(C-5),110.86 (C-10),112.02 (C-3),144.80(C-4),145.52 (C-6),149.80 (C-9),151.39(C-7),160.99(C-2)。以上数据与文献[16]报道的东莨菪亭一致,故鉴定化合物1为东莨菪亭(scopoletin)。
2.3.2化合物21H-NMR (400 MHz,DMSO)δppm:7.61 (1H,d,J=9.5 Hz,H-4),6.28 (1H,d,J=9.5 Hz,H-3),6.66 (1H,s,H-5),4.09 (3H,s,8-OCH3),3.94 (3H,s,6-OCH3)。13C-NMR(100 MHz,DMSO)δppm:160.7(C-2),113.5(C-3),143.9(C-4),103.2(C-5),144.6 (C-6),142.4(C-7),134.54(C-8),143.1(C-9),111.2(C-10),61.7(8-OCH3),56.58(6-OCH3)。以上数据与文献[17]报道的异秦皮定一致,故鉴定化合物2为异秦皮定(isofraxidin)。
2.3.3化合物31H-NMR(400 MHz,CDCl3)δppm:3.11(2H,m,H-1,5),4.74 (2H,d,J=4.3 Hz,H-2,6),4.25 (2H,dd,J=9.1,6.9 Hz,H-4eq,8eq),6.82~6.90 (6H,m,aromatic protons),3.91 (6H,s,-OCH3)。13C-NMR(100 MHz,CDCl3)δppm:54.2(C-1,5),85.9(C-2,6),71.7(C-4),132.9(C-1′,1″),108.6(C-2′,2″),146.7(C-3′,3″),145.2(C-4′,4″),114.3(C-5′,5″),118.9 (C-6′,6″),55.9 (2-OCH3)。以上数据与文献[18]报道的松脂醇一致,故鉴定化合物3为松脂醇(pinoresinol)。
2.3.4化合物41H-NMR(400 MHz,MeOD)δppm:7.44 (1H,d,J=1.6 Hz,H-2),7.42(1H,J=6.0 Hz,H-5),6.80(1H,dd,J=6.0,1.6 Hz,H-6)。13C-NMR(100 MHz,MeOD)δppm:121.85(C-1),114.36(C-2),144.65(C-3),150.10(C-4),116.33(C-5),122.51(C-6),168.98(-COOH)。以上数据与文献[19]报道的原儿茶酸一致,故鉴定化合物4为原儿茶酸(protocatechuic acid)。
2.3.5化合物51H-NMR(400 MHz,MeOD)δppm:6.18 (1H,d,J=2.3 Hz,H-6),6.38 (1H,d,J=2.3 Hz,H-8),6.88 (1H,d,J=8.2 Hz,H-5′),7.63 (1H,dd,J=8.2,2.3 Hz,H=6′),7.74 (1H,d,J=1.7 Hz,H-2′)。13C-NMR(400 MHz,MeOD)δppm:146.6(C-2),135.9(C-3),175.9(C-4),161.1(C-5),97.9(C-6),164.4(C-7),93.0(C-8),156.8(C-9),103.1(C-10),120.3(C-1′),114.6(C-2′),144.8(C-3′),114.8 (C-5′),122.7(C-6′)。以上数据与文献[20]报道的槲皮素一致,故鉴定化合物5为槲皮素(quercetin)。
3 讨论
3.1样品前处理 为了增加建立Semi-preparative HPLC法的重复性及稳定性,同时保证从捆仙七中分离得到高纯度的化合物以满足结构解析的要求,在经Semi-preparative HPLC进一步分离纯化前,样品中对待分离化合物的干扰杂质成分要尽可能少。因此,乙酸乙酯非生物碱部位要经过多次常压硅胶色谱柱层析,所得不同极性的馏分在薄层色谱上视检时,仅能观察到2到3个主斑点,或常压硅胶色谱柱不能将成分再次分离。
3.2优化制备色谱条件
3.2.1选择溶解样品的溶剂 本实验比较了甲醇、乙腈、甲醇-水和乙腈-水对样品的溶解情况,结果表明,样品在甲醇中的溶解度较大。为了降低进样体积和避免色谱峰展宽同时提高分离目标化合物的纯度,本实验最终选择甲醇作为溶解样品的溶剂。
3.2.2流动相的选择 为了使分离目标化合物与邻近杂质达到基线分离,实验过程中比较了甲醇-水、乙腈-水、甲醇-水(含5 mL·L-1冰醋酸)和乙腈-水(含5 mL·L-1冰醋酸)等溶剂系统。结果表明,捆仙七中的非生物碱成分在甲醇-水系统中具有较好的分离度,且峰形良好,出峰时间较短,因此,本实验最终选择甲醇-水作为从捆仙七中分离非生物碱成分的流动相。
3.2.3优选其他条件 在确定了流动相组成后,为了提高效率和保证所分离目标成分的纯度,实验过程中还对其他色谱条件进行了优化,如流速、洗脱模式和进样量。由于本实验所用的Megres C18直径为10 mm,根据Van Deemter方程得出其最佳流速为4 mL·min-1。本实验采用紫外检测器对分离化合物进行检测,为了避免基线漂移影响化合物峰形辨识,最终选用等度洗脱模式。不同样品所含杂质复杂程度不同,在满足目标化合物与邻近杂质满足基线分离的前提条件下,进样量可一直增加。
3.3检测波长的确定 由于前期缺少对捆仙七非生物碱成分结构属性的信息,本实验首先用紫外分光光度计在200~400 nm范围内对分离样品进行全波长扫描,确定最佳检测波长,便于目标成分在Semi-preparative HPLC紫外检测器上检出。
参考文献:
[1] 郭增军,卜筱茜,王军宪,等.陕西“七药”植物资源及研究概要[J].中国民族民间医药杂志,2006,(79):79-81.
[2] 席可,郭增军,张卉,等.陕西七药中的一药多源考证及分析[J].西北药学杂志,2013,28(6):565-569.
[3] 李梦怡,张卉,韩玲,等.捆仙七石油醚部分的GC-MS分析[J].现代中药研究与实践,2014,28(1):40-42.
[4] 马祥瑞,焦丽华,朱永强.顶花板凳果特性及繁育应用[J].林业科学,2016,(31):129.
[5] 王世军.顶花板凳果甾体生物碱的提取和次生代谢物的检测[D].杨凌:西北农林科技大学,2014:1-8.
[6] 张祥,崔卫军,周玲,等.陕西太白山国家自然保护区“太白七药”种质资源及其分布[J].陕西林业科技,2012,(3):7-13.
[7] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1998:222-224.
[8] 韩玲,郭增军,吴楠,等.十种陕西“七药”的红外光谱法鉴别研究[J].现代中药研究与实践,2011,25(6):32-34.
[9] 韩玲,郭增军,吴楠,等.10种陕西七药的紫外谱线组研究[J].陕西中医,2011,32(4):483-484,486.
[10]郭增军.陕西七药[M].西安:陕西科学技术出版社,2003:259-261.
[11]吴振海,傅青,陈书文.陕西民间“七”药种类整理[J].中药材,1990,13(5):14-16.
[12]李萍,任红莉.陕西地产“七”药[J].世界最新医学信息文摘,2003,2(3):681-686.
[13]李晨阳.转筋草中极性化学成分及生物活性研究[D].天津:天津医科大学,2010:51-65.
[14]赵川.转筋草生物碱成分及抗肿瘤转移活性研究[D].天津:天津医科大学,2013:77-98.
[15]仙靓,李梦怡,薛璇玑,等.顶花板凳果化学成分及药理活性研究进展[J].西北药学杂志,2017,32(4):534-538.
[16]Wu Q,Zou L,Yang X W,et al.Novel sesquiterpene and coumarin constituents from the whole herbs ofCrossostephiumchinense[J].J Asian Nat Prod Res,2009,11(1):85-90.
[17]孙丽仁,何明珍,冯育林,等.山蜡梅叶的化学成分研究[J].中草药,2009,40(8):1214-1216.
[18]El-Hassan A,El-Sayed M,Hamed A I,et al.Bioactive constituents ofLeptadeniaarborea[J].Fitoterapia,2003,(74):184-187.
[19]张爱军,任凤霞,赵毅民.藏药独一味化学成分的研究[J].中国药学杂志,2011,46(2):102-104.
[20]Wei X H,Yang S J,Liang N,et al.Chemical constituents ofCaesalpiniadecapetala(Roth) Alston[J].Molecules,2013,18(1):1325-1336.

