四种基于MELD的评分系统对慢加急性乙型肝炎肝衰竭患者短期生存的预测价值分析*
李 磊,胡 辉,郑晓玮,江守伟,沈 强
慢加急性肝衰竭(acute-on-chronicliver failure,ACLF)是指在慢性肝病基础上出现的急性肝功能失代偿的临床症候群[1]。目前,报道较多的关于预后评估系统主要包括Child-Turcotte-Pugh(CTP)、终末期肝病模型(model for end-stage liver disease,MELD)[2,3]、慢性肝衰竭-序贯器官衰竭评估模型(chronic liver failure-sequential organ failure assessment,CLIF-SOFA)、亚太肝脏研究协会慢加急性肝衰竭研究小组评分(AARC-ACLF)等[4,5]。国内外多个研究团队以此为基础,衍生出MELD-Na、iMELD、MELD-to-sodium ratio(MESO)等多个评分系统,认为经过调整的MELD衍生评分模型可以更好地对重症肝病患者生存情况进行有效的预测,但仍存在一定的争议。我们在乙型肝炎相关的ACLF患者对它们进行了全面的比较,以期能发现相对较准确的评分系统。
1 资料与方法
1.1 研究对象 2015年4月~2017年10月我院感染病科收治的HBV感染相关ACLF患者67例,男性54例,女13例;年龄27~65岁,平均年龄为48.9±12.6岁。诊断参照《慢性乙型肝炎防治指南(2015年更新版)》[6]《肝衰竭诊治指南(2012年版)》[1]的标准,剔除合并恶性肿瘤、自身免疫性疾病、药物性肝损伤、酒精性肝炎、HAV、HEV、HCV感染和妊娠或哺乳期妇女。
1.2 研究方法 记录达到ACLF诊断标准时的相关实验室检测指标,如凝血酶原时间国际标准化比值(international normalized ratio,INR)、血肌酐(serum creatinine,Cr)、血清总胆红素(serum total bilirubin,TBIL)、血清钠 (serum sodium,Na)、胱抑素 C(cystatin C,Cyc)。分别按照以下公式计算相关评分值。MELD:r=11.2×ln(INR)+9.6×ln[Cr(mg/dL)]+3.8×ln[TBIL(mg/dL)]+6.4×病因(胆汁淤积性和酒精性取值为 0,其余取值为 1);MELD-Na:r=MELD+1.59×(135-Na),其中血清Na的取值方法为:血清Na+>135 mmol/L时,按 135 mmol/L计,<125 mmol/L时,按 125 mmol/L计,在125~135 mmol/L 者,按实际数值计算[3,10];iMELD:r=MELD+(年龄×0.3)-(Na×0.7)+100;MESO:r=MELD/Na×10。
1.3 统计学处理 应用SPSS 13.0软件进行数据分析。对符合正态分布的计量资料以(±s)表示,采用t检验,对方差不齐资料采用Satterthwaite近似t检验。计数资料的比较采用x2检验。应用MedCalc 15.8软件分析比较受试者工作特征曲线(receiver operating characteristic curve,ROC),确定MELD及其衍生评分系统对ACLF患者12周死亡风险预测的最佳截断点和约登指数,以评价不同评分预测ACLF患者短期生存的效能,P<0.05被认为差异具有统计学意义。
2 结果
2.1 生存组与死亡组一般资料的比较 在治疗12周内,死亡45例(67.2%)。并发症主要为自发性细菌性腹膜炎25例(37.3%)、肝性脑病26例(38.8%)、肝肾综合征11例(16.4%)、消化道出血3例(4.5%)、其它部位感染6例(9.0%)。两组在TBIL、INR和血Na+水平方面无显著性差异(P>0.05),但死亡组Cr和Cyc水平显著高于生存组(P<0.05)。
2.2 生存与死亡患者四种MELD模型评分比较 死亡患者入组时 MELD、iMELD、MELD-Na和 MESO评分均显著高于生存患者(P<0.01,表2)。
2.3 四种MELD评分系统评估效能比较 应用MedCalc15.8软件制作四种评分模型对HBVACLF患者 12周预后的ROC曲线(图1),四种评分模型对患者12周生存情况预测的AUC均在0.8以上(表3),即均具有较好的预测价值,对其预测的AUC行两两比较,发现各评分模型之间在评价效能方面均无显著性差异(P>0.05,表4)。
表1 生存与死亡患者一般资料(±s)比较

表1 生存与死亡患者一般资料(±s)比较
?
表2 生存与死亡患者四种模型评分(±s)比较

表2 生存与死亡患者四种模型评分(±s)比较
?
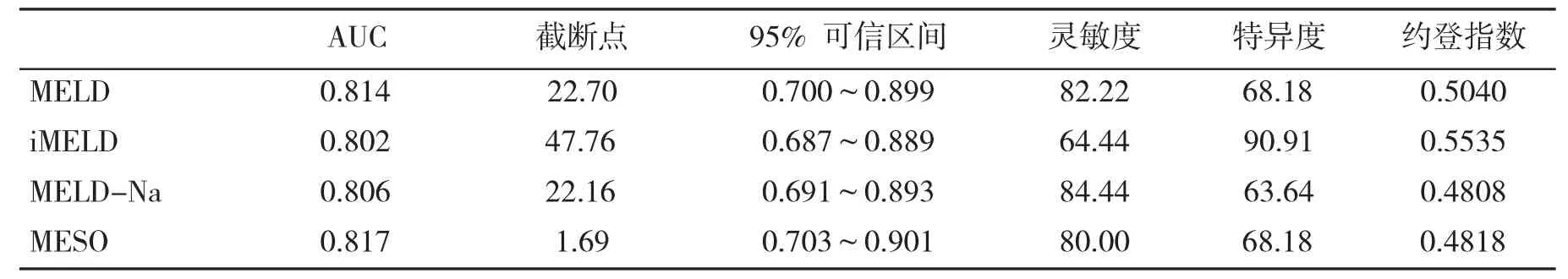
表3 四种MELD评分预测ACLF患者12周预后的效能

表4 四种MELD评分预测ACLF 12周预后的AUC比较
3 讨论
MELD评分模型最初是于2000年通过对经颈静脉肝内门体静脉分流术(transjugular intrahepatic portosystemic stent shunt,TIPS) 患者预后相关危险因素分析而建立的[2]。为方便临床实际应用,Kamath et al于2001年对前述模型进行了修改,即建立了现行的MELD评分模型[3]。该模型具有重复性好、客观性强,涵盖了患者肾功能指标的优势,在临床上得到了广泛的认可和应用。多项研究证实该模型在预测失代偿期肝硬化患者生存预后方面优于CTP分级[7-11]。美国器官共享联合网络(The U nited Network of Organ Sharing,UNOS)也于 2002 年正式开始使用该评分模型取代CTP分级,对等待肝移植的晚期肝病患者进行供体选择优先排序。后续研究发现患者血清钠浓度和年龄也是影响肝硬化预后较为重要的预测因素。因此,通过将前述因素加入到原始的MELD中,衍生出了MELD-Na、iMELD和MESO,以提高 MELD 的预测能力[12,13]。
ACLF的概念早在1995年由日本学者首先提出,但不同地区对ALCF的界定存在较多争议,目前大约有10余种不同的定义。其中东西方的诊断标准存在的差别最大。主要与病因和诱因差别较大有关,东方以病毒性肝炎为最主要的直接肝损原因,其次还有外伤、感染、药物、手术等。HBV再激活、重叠其它病毒感染等为常见的诱因,也有相当比例的ACLF无明确的诱因,而西方国家主要肝损原因为酒精滥用,诱因多为药物、感染、短期狂饮或其它不明原因。另外,在诊疗ACLF的目的方面也存在差异,东方以早发现、早治疗、预防致死性并发症为主,而西方主要是评估筛选肝移植人群和手术时机[14-16]。因此,尽管MELD评分模型在西方得到了广泛的应用,但对于我国的特殊情况,有必要进行重新审视和评估。
本文通过对67例符合我国肝衰竭诊治指南标准的HBV感染相关ACLF患者12周生存情况的分析,发现生存组 MELD、MELD-Na、iMELD、MESO 四种评分结果均明显高于死亡组。分析其ROC曲线发现,四种预测模型的AUC均在0.8以上,提示均具有良好的预测评估能力。四种评分系统的两两比较,发现它们的预测能力无显著性差异,故认为四种评分系统之间无显著性差异,对HBV-ACLF患者12周的生存情况均具有良好的预测价值。依据现有结果,我们认为尽管基于MELD评分模型增加了血清Na、反映凝血功能的指标INR和年龄因素,但并未提高MELD对于HBV-ACLF短期生存情况的预测能力。
国内部分学者在MELD评分模型基础上还尝试联合其它实验室指标对ALCF患者短期生存预后进行了研究,发现MELD评分联合平均血小板体积(mean platelet volume,MPV)[17]、 血 清 降钙素原(procalcitonin,PCT)[18]可以提高 MELD 模型对 ACLF预后的预测效能。本研究也尝试对前述指标进行了联合分析(文中未列出资料),但未能证实其必要性。其他学者还比较了MELD评分模型与CLIF-SOFA和AARC-ACLF评分模型对HBV ACLF短期预后的预测能力,证实CLIF-SOFA模型相对于MELD也无明显的优势[19-21]。有人认为AARC-ACLF评分模型优于MELD评分模型,因为它涵盖了其它系统的功能评价,可能更适合于亚太地区ALCF患者的实际情况,但该评分模型系统相对复杂,目前有关此模型的应用研究还较少。
本研究结果也提示,患者短期预后差与肝性脑病、自发性细菌性腹膜炎、消化道出血等并发症有关,是否应该将这些并发症作为此类患者预后的预测指标及如何综合这些因素以调整或建立新的评分预测模型,都值得我们扩大研究队列,以进一步明确。
【参考文献】
[1]中华医学会感染病学分会肝衰竭与人工肝学组和肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南.实用肝脏病杂志,2013,16(3):210-216.
[2]Malinchoc M,Kamath PS,Gordon FD,et al.A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts.Hepatology,2000,31(4):864-871.
[3]Kamath PS,Wiesner RH,Malinchoc M,et al.A model to predict survival in patients with end-stage liver disease.Hepatology,2001,33(2):464-470.
[4]Zhou XD,Chen QF,Zhang MC,et al.Scoring model to predict outcome in critically ill cirrhotic patients with acute respiratory failure:comparison with MELD scoring models and CLIF-SOFA score.Expert Rev Gastroenterol Hepatol,2017,11(9):857-864.
[5]Choudhury A,Jindal A,Maiwall R,et al.Liver failure determines the outcome in patients of acute-on-chronic liver failure(ACLF):comparison ofAPASL ACLF research consortium(AARC) and CLIF-SOFA models.Hepatol Int,2017,11(5):461-471.
[6]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2015年版).实用肝脏病杂志,2016,19(3):Ⅴ-ⅩⅩⅢ.
[7]Fan JG.Epidemiology of alcoholic and nonalcoholic fatty liver disease in China.J Gastroenterol Hepatol,2013,28 (Suppl 1):11-17.
[8]Jalan R,Yurdaydin C,BajajJS,etal.Toward an improved definition ofacute-on-chronic liverfailure.Gastroenterology,2014,147(1):4-10.
[9]Durand F,Nadim MK.Management of acute-on-chronic liver failure.Semin Liver Dis,2016,36(2):141-152.
[10]Arroyo V,J alan R.Acute-on-chronic liver failure:Definition,diagnosis,and clinical characteristics.Semin Liver Dis,2016,36(2):109-116.
[11]Chaurasia RK,Pradhan B,Chaudhary S,et al.Child-Turcotte-Pugh versus modelforend stage liverdisease score for predicting survival in hospitalized patients with decompensated cirrhosis.J Nepal Health Res Counc,2013,11(23):9-16.
[12]Lee YH,Hsu CY,Huo TI.Assessing liver dysfunction in cirrhosis:role of the model for end-stage liver disease and its derived systems.J Chin Med Assoc,2013,76(8):419-424.
[13]El-Ghannam MT,Hassanien MH,El-Talkawy MD,et al.Performance of disease-specific scoring models in intensive care patients with severe liver diseases.J Clin Diagn Res,2017,11(6):OC12-OC16.
[14]Bernal W,Jalan R,Quaglia A,et al.Acute-on-chronic liver failure.Lancet,2015,386(10003):1576-1587.
[15]Srikureja W,Kyulo N L,Runyon B A,et al.MELD score is a betterprognostic modelthan Child-Turcotte-Pugh score or discriminant function score in patients with alcoholic hepatitis.J Hepatol,2005,124(5):700-708.
[16]Rahimidehkordi N,Nourijelyani K,Nasiritousi M,et al.Model for end-stage liverdiseas (MELD) and Child-Turcotte-Pugh(CTP) scores:ability to predict mortality and removal from liver transplantation waiting list due to poor medical conditions.Arch Iran Med,2014,17(2):118-121.
[17]Hoffmann K,Hinz U,Hillebrand N,et al.The meld score predicts the short-term and overall survival after liver transplantation in patients with primary sclerosing cholangitis or autoimmune liverdiseases.LangenbecksArch Surg,2014,399(8):1001-1009.
[18]Jiang M,Liu F,Xiong W J,et al.Combined meld and blood lipid level in evaluating the prognosis of decompensated cirrhosis.World J Gastroenterol,2010,16(11):1397-1402.
[19]Bie C Q,Yang D H,Tang S H,et al.The value of model for end-stage liver disease and Child-Turcotte-Pugh scores over time in evaluating the prognosis of patients with decompensated cirrhosis:experience in the Chinese mainland. Hepatology,2009,39(8):779-783.
[20]Hsu CY,Lin HC,Huang YH,et al.Comparison of the model for end-stage liver disease(MELD)and MELD-na for outcome prediction in patients with acute decompensated hepatitis.Dig Liver Dis,2010,42(2):137-142.
[21]Fernández C C,Lens S,Lop E,et al.Treatment of hepatitis C virus infection in patients with cirrhosis and predictive value of MELD:Analysis of data from the heap-cregistry.Hepatology,2017,65(6):1810-1822.

