葛根素联合二甲双胍治疗NAFLD合并2型糖尿病前期患者初步临床研究
赵文涛,曹高峰,焦小红,马辰辰,林 苗
糖尿病前期系介于正常血糖与糖尿病之间的状态,是糖尿病发病的必经阶段,患者糖调节功能受损,常表现为糖耐量降低或空腹血糖升高[1]。随着人民生活水平的提高,饮食结构的变化,糖尿病前期人群逐渐增多[2]。调查显示,我国成人中糖尿病前期人群逾4亿人次,其脂肪肝患病率高达45%,尤其以绝经期女性多发[3]。早期研究发现,胰岛素抵抗、肥胖和脂代谢紊乱是非酒精性脂肪性肝病(NAFLD)合并糖尿病前期发病的主要危险因素[4]。目前,尚未确定治疗NAFLD合并糖尿病前期患者的特效药物,多采用常规降糖、降脂药物干预,但疗效有限。葛根素为自中药葛根中提取的有效成分,属异黄酮类化合物,已被证实具有抗氧化、降血压、降血糖、调脂、清除氧自由基、提高免疫力等功效[5]。Chon et al[6]通过动物实验发现,葛根素对实验性肝损伤大鼠肝组织有保护作用,可通过拮抗氧化应激反应,抑制炎症介质的释放,抑制肝细胞凋亡。我们应用葛根素联合二甲双胍治疗NAFLD合并糖尿病前期患者,现将结果报道如下。
1 资料与方法
1.1 一般资料 2014年4月~2017年6月我院收治的NAFLD合并糖尿病前期患者84例,男32例,女52例;年龄49~59岁,平均年龄(55.4±3.5)岁;NAFLD 病程1~5年,平均(2.3±0.5)年;体质指数(body mass index,BMI)为(26.5±3.2)kg/m2。符合中华医学会肝脏病学会发布的NAFLD诊疗指南[7],空腹血糖(fasting blood glucose,FBG)受损为FBG在6.1~6.9 mmol/L,餐后2 h血糖(2 h postprandial plasma glucose,2hPG)<7.8 mmol/L,或糖耐量异常,即虽然FPG低于6.1 mmol/L,但禁食次日空腹进食葡萄糖75 g后2hPG为7.8~11.0 mmol/L。排除标准:①合并心肝肾肺器质性功能障碍者;②合并急慢性感染性疾病者;③既往有甲状腺功能异常、贫血和糖尿病、入组前2个月服用过影响血糖、血脂类药物者;④合并其他肝脏疾病者;⑤合并遗传性疾病者;⑥继发性血糖上升者;⑦有饮酒史者或饮酒量女>70 g/w,男>140 g/w;⑧对本试验用药过敏者。采用随机数字表法将患者分为对照组42例和观察组42例,两组性别、年龄、BMI等资料比较差异无统计学意义(P>0.05),具有可比性。本研究获得医院医学伦理委员会审核通过,患者及其家属签署知情同意书。
1.2 治疗方法 给予两组患者常规对症处理及生活方式干预,包括饮食控制、运动指导、体质量控制等。在对照组,给予盐酸二甲双胍片(北京双鹤现代医药技术有限责任公司,国药准字H1020908)0.5口服,2次/d,逐渐增量至0.5口服,3次/d,治疗3个月;观察组在对照组治疗的基础上,给予葛根素(浙江康恩贝制药股份有限公司,国药准字H20056320)500 mg加入0.9%氯化钠溶液250 ml中静脉滴注,1次d,连续治疗2个月。
1.3 观察指标 使用日本日立公司7170A型全自动生化分析仪测定血生化指标和FBG、2hPG、糖化血红蛋白 (hemoglobin A1c,HbA1c)、空腹胰岛素(fasting insulin,FINS,北京中生北控生物科技股份有限公司),计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR),HOMAIR=Fins×FBG/22.5;采用紫外分光光度法测定超氧化物歧化酶(superoxide dismutase,SOD)水平【生工生物工程(上海)股份有限公司】;采用酶联免疫法测定血清白介素 -6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、C 反应蛋白(C-reactive protein,CRP)、丙二醛(malondialdehyde,MDA)水平(武汉博士德生物工程有限公司)。
1.4 统计学方法 应用SPSS 19.0统计学软件进行分析。计量资料以(±s)表示,采用t检验,率的比较采用x2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后血糖指标变化的比较 治疗前,两组血糖指标比较差异无统计学意义(P>0.05);治疗后,观察组FBG、2hPG、FINS、HOMA-IR均低于对照组,差异有统计学意义(t=4.190、t=2.286、t=5.129、t=2.148,P<0.05,表1)。
表1 两组血糖指标(±s)比较
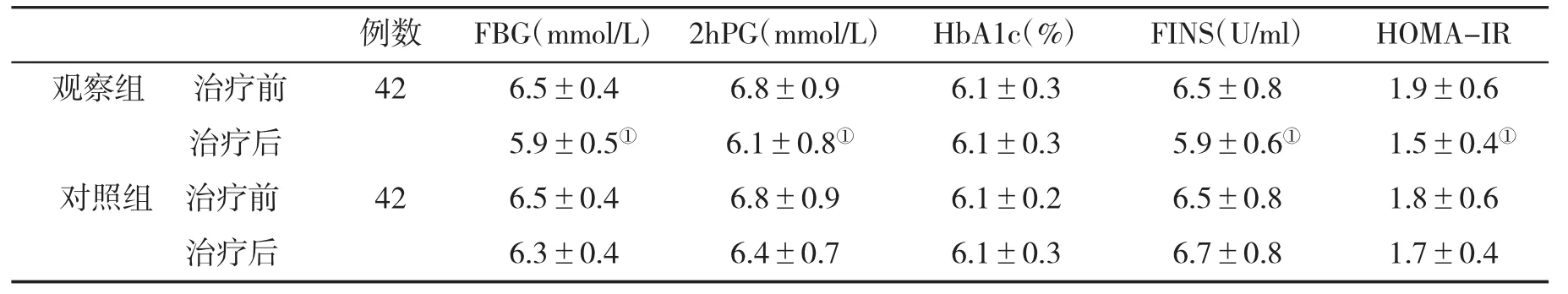
表1 两组血糖指标(±s)比较
与对照组比,①P<0.05
?
2.2 两组治疗前后血脂指标变化的比较 治疗前,两组血脂指标比较差异无统计学意义(P>0.05);治疗后,观察组TC、TG、LDL-C低于对照组,HDL-C高于对照组,差异有统计学意义(t=10.527、t=4.818、t=13.746、t=5.452,P<0.05,表2)。
2.3 两组治疗前后肝肾功能指标比较 治疗前,两组肝肾功能指标比较差异无统计学意义(P>0.05);治疗后,观察组血清转氨酶水平低于对照组,差异有统计学意义(t=7.534、t=9.412,P<0.05,表3)。
2.4 两组治疗前后血清炎症因子水平比较 治疗前,两组血清炎症指标比较差异无统计学意义(P>0.05);治疗后,观察组血SOD高于对照组,其余各指标均低于对照组,差异有统计学意义(t=13.483、t=12.515、t=10.694、t=6.105、t=15.694,P<0.05,表4)。
表2 两组血脂指标(±s)比较

表2 两组血脂指标(±s)比较
与对照组比,①P<0.05
?
表3 两组肝肾功能指标(±s)比较

表3 两组肝肾功能指标(±s)比较
与对照组比,①P<0.05
?
表4 两组血清炎症指标(±s)比较

表4 两组血清炎症指标(±s)比较
与对照组比,①P<0.05
?
3 讨论
NAFLD系排除酒精过量所引起的脂肪性肝病,病理学特征表现为肝脏脂肪聚集[9]。调查发现,我国成年人群糖尿病前期所占比例较高,其中有超过40%合并脂肪肝[10]。随饮食结构的改变,肥胖人数在增多,脂肪肝合并糖尿病前期发病率逐渐上升[11]。研究[12,13]认为,NAFLD合并糖尿病前期的发病与遗传-环境-代谢紊乱等有关。糖尿病前期患者胰岛功能呈进行性降低,部分出现胰岛素抵抗,导致机体血糖升高,长期处于高胰岛素及高血糖状态,进一步加重胰岛素抵抗,引起血糖上升,加速外周中性脂肪组织分解,上调非酯化脂肪酸水平,提升细胞膜通透性,造成肝细胞内脂肪聚集,引起脂肪性病变,加重肝细胞受损,增加脂肪肝病变程度。此外,高胰岛素血症对甘油三酯调节产生影响,造成低密度脂蛋白合成受阻,增加肝脏脂质堆积,影响肝细胞结构及功能,进一步加重血脂代谢紊乱,两者形成恶性循环,加重脂肪肝进展。也有研究[14]提出,氧化应激与脂质过氧化两者均在NAFLD发病中有重要作用,机体氧化应激反应加重,抗氧化物、促氧化物平衡调节紊乱,加重脂肪变性,促进脂肪肝发病及进展。女性NAFLD合并糖尿病前期发病率明显高于同龄男性。本研究发现,NAFLD合并糖尿病前期患者存在明显的血脂代谢、糖代谢紊乱表现,且存在炎症因子水平明显上调,伴肝功能异常改变,与Gawrieh et al[15]研究结论相符,提示糖脂代谢紊乱、炎症刺激等均在NAFLD合并糖尿病前期发病中有重要作用。
目前,对NAFLD合并糖尿病前期患者的治疗尚未确立特异性的药物,多采用生活方式调节、饮食干预及降糖药物治疗。近年来有研究者提出,葛根素有显著的护肝效果,富含氨基酸、膳食纤维及多种矿物质成分,具备抗肿瘤,强化机体免疫抵抗力等功效[16]。Abruzzese et al[17]表示,葛根素含异黄酮成分,可改善脑部微循环,有显著的降血糖、抗氧化应激等功效。有动物实验研究发现,葛根素可降低2型糖尿病实验大鼠血糖水平,同时可增强胰岛素敏感性,提高HDL-C水平[18,19]。葛根素系自中药野葛根茎中提出的单一有效成分异黄酮,可促进骨骼肌对葡萄糖摄取,促进脂质分化,降低血糖。同时,葛根素可保护胰岛细胞及肝细胞功能,降低TC、TG水平,调节肝细胞一氧化氮生成,提升肝脏组织对胰岛素的敏感性。此外,葛根素可上调SOD活性,提升一氧化氮、谷胱甘肽过氧化物酶水平,降低MDA水平,提升机体拮抗氧化能力,减轻脂质过氧化损伤。本研究对照组采用二甲双胍常规治疗,观察组加用葛根素治疗,结果发现,观察组患者治疗后血糖紊乱得到改善,胰岛素抵抗减轻,TC、TG、LDL-C水平下调,HDL-C上调,且肝功能得到显著改善,氧化应激状态及炎症状态明显减轻,肯定了加用葛根素对NAFLD合并糖尿病前期患者的干预价值。
综上所述,采用葛根素联合二甲双胍治疗NAFLD合并糖尿病前期患者疗效肯定,可明显降血糖、降血脂,下调炎症反应,改善患者病情,且有较高的安全性。但本研究观察时间尚短,还需要临床扩大验证和长时间的随访。
【参考文献】
[1]胡跃霜,钟兴,潘天荣.艾塞那肽治疗2型糖尿病合并NAFLD患者的疗效观察.安徽医科大学学报,2017,52(4):546-549.
[2]郭伟,高明松,彭聪,等.利拉鲁肽联合二甲双胍对2型糖尿病合并NAFLD病肝脂肪变的影响.中国现代医学杂志,2016,26(13):107-111.
[3]阮勇,谭擎缨,阮芸,等.二甲双胍治疗2型糖尿病合并非酒精性脂肪性肝病的临床观察.中国药房,2015,26(33):4659-4661.
[4]杨帆,李钶,蒋晓岚,等.利拉鲁肽对肥胖2型糖尿病合并NAFLD患者的肝脏脂肪沉积的影响研究.重庆医学,2016,45(25):3493-3495.
[5]方新华,卢晓,吴国清.葛根素对妊娠期糖尿病大鼠调节血脂和抗氧化作用的实验研究.中华中医药学刊,2016,34(6):1504-1507.
[6]Chon YE,Kim KJ,Jung KS,et al.The relationship between type 2 diabetes mellitus and non-alcoholic fatty liver disease measured by controlled attenuation parameter.YonseiMed J,2016,57(4):885-892.
[7]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南.实用肝脏病杂志,2007,10(1):1-3.
[8]Yamazaki H,Tsuboya T,Tsuji K,et al.Independent association between improvement of nonalcoholic fatty liverdisease and reduced incidence of type 2 diabetes.Diabetes Care,2015,38(9):1673.
[9]王成剑,黄荣曦,姜英松,等.DPP-4抑制剂沙格列汀对糖尿病NAFLD 的作用研究. 重庆医学,2017,46(11):1490-1491.
[10]Hallsworth K,Thoma C,Hollingsworth KG,et al.Modified highintensity interval training reduces liver fat and improves cardiac function in non-alcoholic fatty liver disease:a randomized controlled trial.Clin Sci(Lond),2015,129(12):1097.
[11]周步高,邹勇,王馨,等.葛根素对损伤后肝细胞再生障碍大鼠的肝保护作用评价.中华中医药杂志,2017,32(5):2046-2047.
[12]赵月蓉,侯碧玉,张莉,等.葛根素对实验性肝损伤的治疗作用研究进展. 中国新药杂志,2017,26(9):1005-1010.
[13]李笠,梁学亚.水飞蓟宾葡甲胺联合多烯磷脂酰胆碱治疗酒精性脂肪肝患者初步临床研究.实用肝脏病杂志,2017,20(4):412-415.
[14]赵文霞,张丽慧.合理应用中成药治疗NAFLD.实用肝脏病杂志,2017,20(2):132-134.
[15]Gawrieh S,Chalasani N.Pharmacotherapy for nonalcoholic fatty liver disease.Semin Liver Dis,2015,35(3):338.
[16]Lee YH,Kim JH,Kim SR,et al.Lobeglitazone,a novel thiazolidinedione,improves non-alcoholic fatty liver disease in type 2 diabetes:Its efficacy and predictive factors related to responsiveness.J Korean Med Sci,2017,32(1):60.
[17]Abruzzese GA,Motta AB.Nonalcoholic fatty liver disease in children and adolescents-Relationship with polycystic ovary syndrome.Curr Pharm Des,2015,21(35):5144.
[18]Kwok R,Choi KC,Wong GL,et al.Screening diabetic patients for non-alcoholic fatty liver disease with controlled attenuation parameter and liver stiffness measurements:a prospective cohort study.Gut,2016,65(8):1359-1368.
[19]Selvakumar PK,Kabbany MN,Lopez R,et al.Reduced lysosomal acid lipase activity-a potential role in the pathogenesis of non alcoholic fatty liver disease in pediatric patients.Dig Liver Dis,2016,48(8):909-913.

