c-Met基因过表达脐带间充质干细胞株的构建*
张永婷,朱传龙,李军,章莉莉
目前进行细胞移植治疗的种子细胞主要来源于自体骨髓间充质干细胞(mesenchymal stem cell,MSC),但因取材有创,获得细胞数量有限。随着年龄增长,人体骨髓MSC细胞数量及细胞活性明显下降。人脐带间充质干细胞(human umbilical cord mesenchymal stem cell,hUMSC)作为工具细胞,具有分化潜能强、来源丰富、无伦理争议等优点,同时免疫原性低、免疫调控功能和自我更新能力强大,可作为治疗肝衰竭的种子细胞[1]。赵思达将hUMSC移植到肝衰竭大鼠体内后发现能显著改善肝功能,减轻肝脏损伤,促进肝细胞再生,提高了动物存活率[2]。细胞间质表皮转化因子(cellular mesenchymal to epithelial transition factor,c-Met)是肝细胞生长因子(hepatocyte growth factor,HGF)的特异性受体,由50 kD的α链和145 kDa的β链通过二硫键组成异源二聚体[3]。C-Met与HGF特异性结合后,酪氨酸激酶自主磷酸化激活下游信号转导通路,发挥促进细胞增殖、迁移、血管生成、抗纤维化、抗凋亡等作用[4-6]。Trapp T et al[7]发现 HGF/c-Met轴可促进间充质干细胞迁移至损伤部位。间充质干细胞c-Met表达量与其迁移能力密切相关[8]。还有研究结果表明肝脏损伤后HGF水平增加,可上调MSC中c-Met与磷酸化Met的表达,促进MSC迁移至肝脏,进一步减轻肝损伤[9]。敲除c-Met基因能损伤干细胞的迁移及向肝细胞分化能力,并进一步抑制了肝组织的修复[10]。本文旨在建立c-Met基因过表达的hUMSC,并移植治疗肝衰竭大鼠,观察该方法是否可促进hUMSC迁移至受损肝脏部位,并观察其向肝细胞分化的能力。
1 材料与方法
1.1 细胞、主要试剂与仪器 人脐带间充质干细胞(由江苏省人民医院干细胞临床实验研究基地提供),胎牛血清(Corning公司,美国),DMEM 低糖培养基(HyClone公司,美国),PBS粉末(Sigma公司,美国),重组人表皮生长因子(hEGF)和重组人生长因子(hEGF)(PeroTech公司,美国),胰蛋白酶(碧云天公司),抗人 CD31、CD34、CD44、CD45、CD90 和CD109抗体(Biolegend公司,美国),构建成功慢病毒重组载体GV358-c-Met(上海吉凯公司),嘌呤霉素(Amresco公司,美国),凝聚胺(Sigma公司,美国),兔抗人c-met(abcam公司,英国),兔抗人β-actin(abcam公司,英国),辣根过氧化物酶标记的羊抗兔 lgG(杭州联科公司),细胞培养箱(Thermo公司),超净台和荧光倒置相差显微镜(Olympus公司),制冰机(厦门国仪科学仪器公司)。
1.2 人脐带间充质干细胞体外培养与鉴定 取冻存P2代hUMSCs,37℃水浴复苏后铺板,使用含10%血清,10 ng/ml的hEGF和hbFGF低糖DMEM培养,培养至P5代细胞。取P5代hUMSC进行流式细胞仪鉴定,分别取100μlhUMSC细胞悬液,加入到流式管中,每管细胞总数为1×105个。分别在各流式管中加入抗体 PE-CD31、PE-CD34、PE-CD45、FITC-CD44、FITC-CD45和FITC-CD105,随后避光冰浴30 min,PBS洗涤后离心,放入流式细胞仪检测,并记录结果。
1.3 确定嘌呤霉素筛选浓度 取对数生长期的hUMSC,接种于6孔板,待2~3 d各孔细胞长满后,重新各孔加入含梯度浓度嘌呤霉素的完全培养基2 ml,各孔嘌呤霉素浓度分别为 0 μg/ml、1 μg/ml、1.4 μg/ml、2 μg/ml、3 μg/ml和 4 μg/ml,显微镜下每日观察各孔细胞生长情况。2~3 d换液,加入含有相应浓度嘌呤霉素的完全培养基,以4 d可完全杀死相应孔中全部细胞的最低嘌呤霉素浓度为最终药物筛选浓度。
1.4 最适多重感染复数(multiple of infection,MOI)的筛选 转染前24 h,取第五代hUMSCs,以5×104个/ml接种于96孔培养板,使转染时细胞融合至30%~40%。次日,用含有5 μg/ml polybrene的新鲜培养基200μl替换原培养基,加入滴度为2×108TU/ml,MOI 依 次 为 0、10、30、50、80、100 的c-Met病毒悬液,37℃孵育。12 h后,加入新鲜培养基200μl,继续培养,48 h后于荧光倒置显微镜下观察转染情况,阳性细胞在荧光显微镜下显示为绿色,计算同一视野下阳性细胞与总细胞数百分比。根据以下公式计算转染效率:转染效率=绿色荧光蛋白(GFP)阳性细胞数/总细胞数×100%。转染效率90% 以上的最低MOI值即为最适MOI。
1.5 c-Met重组慢病毒转染人脐带间充质干细胞及转染后嘌呤霉素的筛选 取第五代hUMSCs,以5×105个/ml接种于24孔培养板,分为对照组和实验组,每组设置3个复孔。按照上述方法进行转染,实验组按最佳 MOI值加入重组慢病毒Lenti-GFP-c-Met,对照组加入等体积的阴性病毒液Lenti-GFP,48 h后于倒置荧光显微镜下观察荧光,72 h后向培养基中加入最终浓度的嘌呤霉素筛选。1 w后,在荧光显微镜下观察筛选效果,待显微镜下荧光效率接近或者高于99%时,将药物浓度维持在1/5筛选浓度,即获得稳定表达c-Met基因的脐带间充质干细胞株。
1.6 稳定转染细胞株c-Met蛋白表达的检测 采用Western blot法,分别取实验组和对照组相同数目的细胞,提取细胞总蛋白,采用BCA法测定蛋白浓度,采用冷冻干燥技术调整各个蛋白样品浓度为5 g/L。随后,取待测样品与5×蛋白上样缓冲液按照4:1体积进行混合,充分混匀后,放于沸水中煮5 min,装置好电泳设备,每孔按照20μg蛋白量上样,根据已知浓度算出每孔对应蛋白体积,加入Marker 10μl,进行 10%SDS-PAGE电泳。进行PVDF膜转膜,TBST缓冲液洗膜,室温封闭2 h,分别加兔抗人c-Met(1∶500),兔抗人β-actin(1∶1 000),4℃过夜,用TBST洗膜后,加入辣根过氧化物酶标记的羊抗兔IgG(1∶1 000),室温下孵育 2 h。用TBST缓冲液洗膜,按ECL试剂盒说明进行化学发光检测,暗室中进行X线片曝光显色,使用Image J软件进行条带灰度分析。
2 结果
2.1 脐带间充质干细胞的培养与鉴定情况 培养至P5代的hUMSC细胞呈长梭形,或旋涡状生长,细胞排列紧密,大小一致,形态均一(图1)。经流式细胞仪检测显示P5代细胞表面CD44、CD90和CD105表达阳性均在96%以上(分别为99.7%、97.7%和96.4%),而CD31、CD45和CD34表达均低于3%(图2),上述结果符合间充质干细胞特性。

图2 第五代hUMSC表面鉴定结果A:CD105+,CD34-;B:CD90+,CD45-;C:CD44+,CD31-
2.2 筛选嘌呤霉素药物浓度情况 经不同浓度的嘌呤霉素处理hUMSCs 4 d,在显微镜下观察发现在药物浓度为1.4 μg/ml时,即可杀死全部细胞,故最终确定嘌呤霉素筛选浓度为1.4 μg/ml(图3)。

图3 不同浓度嘌呤霉素筛选1 w结果(40×)A:0 μg/ml;B:1 μg/ml;C:1.4 μg/ml
2.3 c-met重组慢病毒载体转染hUMSCs及转染后嘌呤霉素筛选情况 在转染48 h后,在荧光显微镜下即可见绿色荧光,GFP阳性细胞占总细胞的50%(图4);在转染72 h后,加入嘌呤霉素筛选,浓度为1.4μg/ml。经药物筛选1 w后在荧光显微镜下观察荧光,发现荧光阳性率大于99%(图 5),即形成稳定表达c-met基因的人脐带间充质干细胞株(c-met-hUMSC),收集细胞冻存、备用。
2.4 c-met-hUMSC细胞c-Met蛋白表达情况 经Western blot检测显示,稳定转染c-met的hUMSCs细胞显著表达c-Met蛋白,明显高于对照组hUMSCs的c-met表达水平(图 6)。
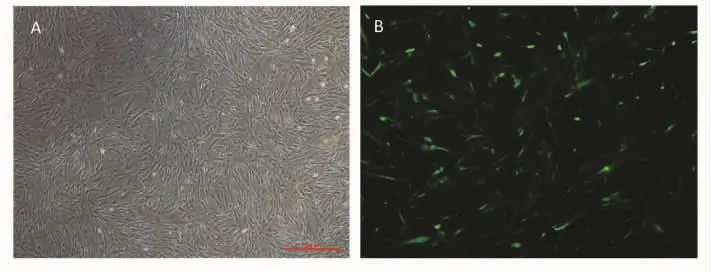
图4 培养细胞表现 hUMSCs转染48 h后在荧光显微镜下观察GFP荧光(MOI=80,40×)A:白光视野;B:荧光视野

图5 培养细胞表现 经嘌呤霉素筛选hUMSC 1 w后在荧光显微镜下观察GFP荧光(40×)A:白光视野;B:荧光视野

图6 细胞c-Met蛋白表达情况A:稳定转染 c-Met的 hUMSCs组;B:hUMSCs组
3 讨论
其中MSC是一类来源于中胚层非造血的干细胞,其可体外增殖、分化、归巢至损伤部位,改善炎性微环境[11,12]。MSC 主要从骨髓、脂肪、脐带中提取[13],与骨髓间充质干细胞和脂肪间充质干细胞相比,hUMSC具有一些优势:①无创性。脐带作为医学废物不会给捐献者造成新的创伤和痛苦;②来源丰富。每年有大量新生儿出生,一般不涉及医学伦理学问题;③hUMSC 表达OCT-4、Sox-2、Nanog等转录因子,原始且免疫原性低,同时具有更强的增殖能力和可塑性;④hUMSC在体内外诱导因素作用下可分化为肝样细胞[14]。大量实验证明输入MSC到体内后并没有长期停留,而且随着时间的延长被机体清除。将人MSC通过颈静脉移植到大鼠体内,1 h后,大鼠体内检测到的MSC已减少到了82%左右,8 d后只能检测到0.06%。外周静脉输入MSC后,大部分MSC滞留在肺部,然后随着血流到达肝脏等部位[15]。临床研究结果亦表明移植MSC在短期内可改善肝衰竭患者病情,但长期观察肝功能无明显变化[16,17]。
在肝衰竭发生过程中,肝脏间质细胞产生大量的HGF,后者通过与受体c-Met结合形成信号通路,促进细胞再生,诱导细胞迁移等[18]。C-Met作为HGF的特异性受体,具有酪氨酸激酶活性,可促进细胞增殖分化、形态发生和侵袭运动。但肝细胞再生取决于肝细胞表面细胞膜上c-Met的激活,而不是单纯HGF的水平增加。敲除小鼠c-Met基因严重影响肝细胞的存活和肝组织修复功能[19]。肝衰竭大鼠血清HGF水平升高,但c-Met蛋白表达水平却明显降低[20]。肝大部切除大鼠血清HGF和c-Met水平均升高,表明c-Met在肝细胞再生中起到重要作用。以上研究结果提示可以通过基因修饰,以提高hUMSC细胞c-Met的表达,移植c-Met高表达的hUMSC细胞能够更好地定向归巢于损伤肝组织。基因治疗作为一种治疗手段已初见成效,其中载体细胞的选择至关重要,hUMSC可自我更新,分化为肝样细胞,异体移植时不易发生免疫排斥反应,成为组织工程研究的热门工具细胞。同时,慢病毒载体转染干细胞能力强,能够保证目的基因长期高效表达,且细胞毒性较低。
本实验通过构建慢病毒重组载体GV358-c-Met转染hUMSCs,用嘌呤霉素抗性基因筛选后获得成功稳定表达c-Met基因的hUMSC细胞。该细胞的建立为下一步观察c-Met是否促进hUMSC归巢于损伤肝脏组织,促进肝细胞再生,以及以后是否可作为治疗肝衰竭患者的一种新方法提供了实验基础。
【参考文献】
[1]Baksh D,Yao R,Tua n R S.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow.Stem Cells,2007,25(6):1384.
[2]赵思达,张玲芳,郭红英,等.人脐带间充质干细胞对急性肝功能衰竭大鼠肝组织Wnt/β-catenin信号表达的影响.中华传染病杂志,2015,33(4):225-230.
[3]Bottaro DP,Rubin JS,Faletto DL,et al.Identification of the hepatocyte growth factor receptor as the c-met protooncogene product.Science,1991,251(4995):802-804.
[4]Toshikazu N,Shinya M.The discovery of hepatocyte growth factor(hgf) and its significance for cell biology,life sciences and clinical medicine.Proc Jpn Acad Ser B Phys Biol Sci,2010,86(6):588.
[5]Trusolino L,Bertotti A,Comoglio PM.Met signalling:principles and functions in development,organ regeneration and cancer.Nat Rev Mol Cell Biol,2010,11(12):834.
[6]Birchmeier C,Birchmeier W,Gherardi E,et al.Met,metastasis,motility and more.Nat Rev Mol Cell Biol,2003,4(12):915-925.
[7]Trapp T,K gler G,Elkhattouti A,et al.Hepatocyte growth factor/c-met axis-mediated tropism of cord blood-derived unrestricted somatic stem cells for neuronal injury.J Biol Chem,2008,283(47):32244-32253.
[8]黄小兵,李靖,梁平,等.龟板含药血清对骨髓间充质干细胞c-met表达及迁移的影响.中国中西医结合消化杂志,2013,21(11):569-571.
[9]Liu J,Pan G,Liang T,et al.HGF/c-met signaling mediated mesenchymalstem cell-induced liverrecovery in intestinal ischemia reperfusion model.Int J Med Sci,2014,11(6):626.
[10]Ishikawa T,Factor VM,Marquardt JU,et al.Hepatocyte growth factor(hgf)/c-met signaling is required for stem cell mediated liver regeneration.Hepatology,2011,55(4):1215-1226.
[11]中华医学会感染病学分会肝衰竭与人工肝学组和肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南.实用肝脏病杂志,2006,9:321-324.
[12]Saunders SJ,Hickman R,Macdonald R,et al.The treatment of acute liver failure.Prog Liver Dis,1972,4:333-344.
[13]Anzalone R,Lo IM,Corrao S,et al.New emerging potentials for human wharton'sjellymesenchymalstem cells:immunological features and hepatocyte-like differentiative capacity.Stem Cells Dev,2010,19(4):423-438.
[14]Jo CH,Kim OS,Park EY,et al.Fetal mesenchymal stem cells derived from human umbilical cord sustain primitive characteristics during extensive expansion.Cell Tiss Res,2008,334(3):423-433.
[15]Schmuck EG,Koch JM,Centanni JM,et al.Biodistribution and clearance of human mesenchymal stem cells by quantitative three-dimensional cryo-imaging after intravenous infusion in a ratlunginjurymodel.Stem CellsTranslMed,2016,5(12):1668-1675.
[16]Peng L,Xie DY,Lin BL,et al.Autologous bone marrow mesenchymalstem celltransplantation in liverfailure patients caused by hepatitis B:short-term and long-term outcomes.Hepatology,2011,54(3):820-828.
[17]Spahr L,Chalandon Y,Terraz S,et al.Autologous bone marrow mononuclear cell transplantation in patients with decompensated alcoholic liver disease:a randomized controlled trial.Plos One,2013,8(1),e53719.
[18]Wu J,Yu J,Wu H,et al.Expressions and clinical significances of c-met,p-met and e2f-1 in human gastric carcinoma.BMC Res Notes,2014,7(1):1-13.
[19]Huh CG,FactorVM,SánchezA,etal.Hepatocyte growth factor/c-met signaling pathway is required for efficient liver regeneration and repair.Proc Natl Acad Sci U S A,2004,101(13):4477-4482.
[20]Zhu C,Li Y,Li W,e t al.Gene transfer of c-met confers protection against d-galactosamine/lipopolysaccharide-induced acute liver failure.Dig Dis Sci,2012,57(4):925-934.

