早产儿肺脏的超声特征及超声评分
贺 晓,梅 雪,程秀永,李 燕,王 璐,于瑞娜,商丽娜,丁 璐,高剑波
(1.郑州大学第一附属医院超声科,3.新生儿重症监护病房,4.放射科,河南 郑州 450052;2.河南省实验幼儿园,河南 郑州 450003)
新生儿、特别是早产儿处于快速发育期,而分化期细胞对射线损伤尤为敏感。超声检查无辐射、简便易行,已逐渐广泛应用于新生儿肺脏疾病的诊断中。随着研究的进展和临床医师的经验积累,超声检查对新生儿呼吸窘迫综合征、新生儿暂时性呼吸增快症、胎粪吸入综合征、感染性肺炎和肺不张等肺部病变已能做出准确诊断。本研究采用超声观察早产儿肺部的声像学特点,评价超声评分的意义。
1 资料与方法
1.1 一般资料 选择2016年10月—2017年6月在我院住院、无心肺疾病及低蛋白血症的患儿70例,其中早产儿37例(早产儿组),年龄<1周8例(<1周亚组)、1~4周11例(1~4周亚组)、>4周18例(>4周亚组);足月儿33例(足月儿组),年龄<1周9例(<1周亚组)、1~4周7例(1~4周亚组)、>4周17例(>4周亚组)。患儿均接受肺部超声检查,一般资料见表1。本研究获我院伦理委员会批准,并经患儿家长知情同意。
1.2 仪器与方法 采用Hitachi Arietta70彩色多普勒超声诊断仪,线阵探头,频率7.5~10.0 MHz。检查时使患儿在安静状态下仰卧、侧卧或俯卧,以腋前线、腋中线、腋后线为界,将每侧肺脏分为前、侧、后3个区域。使探头与肋骨垂直或平行,分别对双侧肺脏的每个区域进行扫查,观察内容包括胸膜线、A线、B线、肺滑动征及肺实变,并对双肺6个区域分别进行评分。
1.3 图像分析 所有肺部检查及评分均由经过规范化培训的医师进行。超声评分标准:1分,A线为主,仅见零星B线(图1A);2分,A线为主,可见多条边界清楚、规律或不规律分布且间距>7 mm的B线(图1B);3分,弥漫分布且间距<3 mm的密集B线,伴或不伴瀑布征(图1C、1D);4分,肺不张(图1E)。对每个区域根据最严重的超声表现进行评分[1-2],新生儿肺超声评分结果为6个区域的总和。
1.4 统计学分析 采用SPSS 16.0统计分析软件。计量资料用±s表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD法。以Spearman相关性分析评价早产儿肺超声评分与一般资料的相关性,并获得超声评分与胎龄的线性回归方程式。P<0.05为差异有统计学意义。
2 结果
2.1 早产儿肺脏超声表现 早产儿组主要表现为弥漫分布密集B线,伴或不伴“瀑布征”,提示肺泡内积液。
2.2 肺超声评分 早产儿组肺超声评分结果为(15.24±2.76)分,足月儿组肺超声评分为(12.21±3.62)分,两组差异有统计学意义(t=3.962,P<0.001)。年龄<1周早产儿与足月儿组间超声评分差异无统计学意义(P=0.513),年龄为1~4周及>4周的早产儿与足月儿组间超声评分差异均有统计学意义(P均<0.05,表2)。
早产儿组3亚组患儿间肺超声评分差异无统计学意义(P=0.393)。足月儿组3亚组患儿间肺超声评分差异有统计学意义(P=0.023);两两比较,<1周与1~4周亚组差异无统计学意义(P=0.813),<1周与>4周亚组、1~4周与>4周亚组差异均有统计学意义(P=0.015、0.043)。见表2。

表1 早产儿组与足月儿组患儿一般资料
表2 早产儿与足月儿不同年龄的肺超声评分比较(分,±s)
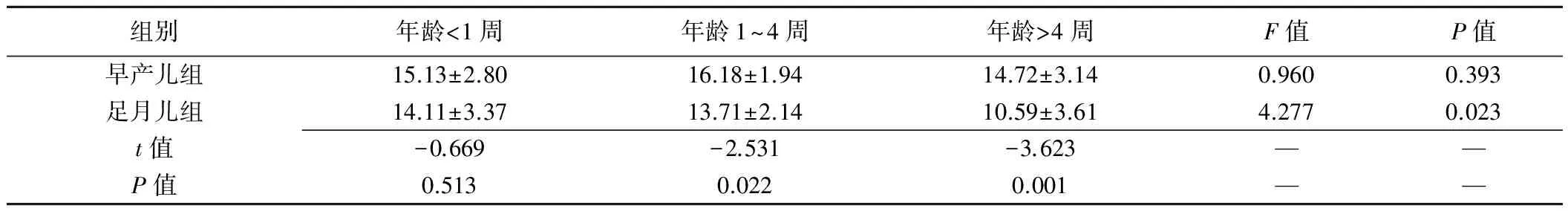
表2 早产儿与足月儿不同年龄的肺超声评分比较(分,±s)
组别年龄<1周年龄1~4周年龄>4周F值P值早产儿组15.13±2.8016.18±1.9414.72±3.140.9600.393足月儿组14.11±3.3713.71±2.1410.59±3.614.2770.023t值-0.669-2.531-3.623——P值0.5130.0220.001——
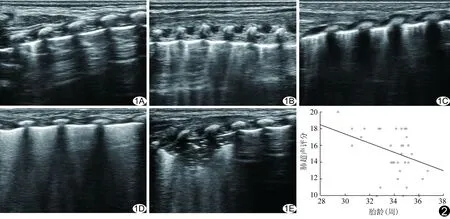
图1 患儿肺部超声评分标准 A.1分; B.2分; C.3分,示密集B线; D.3分,示“瀑布征”; E.4分 图2 早产儿肺超声评分与胎龄呈负相关
2.3 相关性分析 早产儿组肺超声评分结果与性别(r=0.013,P=0.939)、生产方式(r=0.099,P=0.560)、出生体质量(r=-0.187,P=0.268)、出生时Apgar评分(r=-0.218,P=0.194)及年龄(r=-0.221,P=0.189)均无相关性;与胎龄呈负相关(r=-0.352,P=0.033),其线性回归关方程为Y=33.805-0.548X(Y为肺超声评分,X为胎龄,图2)。
3 讨论
肺小叶是由细支气管及其分支和肺泡组成的最小肺单位,呈不规则多面形,直径1.0~2.5 cm。在肺小叶之间为小叶间隔,其中含有血管、淋巴管、神经纤维等。正常胸膜下小叶间隔厚度约0.10~0.15 mm,小于超声的分辨率(约1 mm),且超声探查时被肺泡内气体强回声包绕而不能显示,故正常肺脏超声可显示光滑、清晰、规则的高回声胸膜线和等间距平行排列的A线。约28%正常人在第11~12肋间隙(膈肌上方)可见局限性B线[3]。B线是一种超声混响伪像,表现为由胸膜线发出的激光束样高回声带,垂直向屏幕底部无衰减延伸,且随呼吸运动而移动[4];部分可表现为自胸膜拖曳而下,长达屏幕边缘,另一部分B线则稍短,后方逐渐衰减、内收呈尾状。长短不同B线的形成机制及意义有待进一步研究[5]。当小叶间隔增厚或肺泡内有液体时,小叶间隔或液体与肺泡内气体的声阻抗差增大而形成B线。
B线与血管外肺水含量有良好的相关性[6-7],其数量可随血管外肺水量的变化而变化,甚至在出现临床症状前即可经超声检测发现,因而具有较高的敏感度和特异度[8-9]。2010年,欧洲心血管病学会及重症医学会推荐对急性心力衰竭患者可采用超声检测“彗尾征”评估肺水肿,并进行分级[10]。肺水肿包括小叶间隔水肿和肺泡积液。有学者[3,11]提出,B线间距≥7 mm可能是由于小叶间隔增厚所致,提示间质性肺水肿;当B线间距≤3 mm则提示肺泡性肺水肿。
胎儿时期呼吸道充满液体,肺液对正常肺功能的发育至关重要。出生时胎儿—胎盘循环中断,肺液被清除,气管、肺泡内充气,进行气体交换[12]。胎龄越小,肺泡Na+离子通道的表达越低,Na+和肺液重吸收越少,早产儿、尤其是胎龄<35周的早产儿肺泡上皮Cl-离子通道处于开放状态,仍有大量肺液分泌,而Na+离子通道表达低,开放少,肺液重吸收还末完全建立,出生后肺内液体量明显高于足月儿。本研究中早产儿组肺部超声主要表现为密集的B线,部分呈“瀑布征”,提示肺泡内积液;其超声评分结果为(15.24±2.76)分,明显高于足月儿(t=3.962,P<0.001),且与胎龄呈直线回归关系,其线性回归关方程为Y=33.805-0.548X,提示胎龄越小,超声评分越高,肺内液体量越多。年龄<1周早产儿与足月儿超声评分差异无统计学意义(P=0.513),而年龄1~4周及>4周早产儿超声评分均大于足月儿(P均<0.05)。年龄<1周、1~4周、>4周早产儿肺超声评分差异无统计学意义(F=0.960,P=0.393),而足月儿随年龄增长超声评分逐渐降低,考虑原因为早产儿机体代谢机能较差,清除肺内液体能力低于足月儿。
本组2例早产儿无任何呼吸系统症状,而超声检出肺不张:其中1例胎龄29+3周、出生时体质量1 100 g,检出2处第3肋间肺不张,超声评分为20分;另1例胎龄31+4周、出生时体质量1 300 g,检出2处第4肋间肺不张,超声评分为18分。此2例患儿均为早期早产儿、剖宫产、极低出生体质量儿,出生时伴有新生儿窒息、新生儿呼吸窘迫综合征和低蛋白血症,出生时尚处于胎儿期,肺液以分泌为主,吸收较少;生产方式为剖宫产,胸廓未经历产道挤压,无肺液排除;出生后存在低蛋白血症,肺液吸收能力弱;患儿存在呼吸窘迫综合征和肺表面活性物质分泌不足。以上因素导致患儿在出生后106天和60天接受超声检查时仍有较多肺液残留及小范围肺不张,虽无临床症状,但对肺通气和肺换气功能有一定影响,仍需临床关注。
综上所述,早产儿由于肺液重吸收机制尚末建立,出生后肺内液体量高于足月儿,其肺部超声表现和评分与足月儿不同,超声诊断时应避免误诊为病理情况。
[参考文献]
[1] Beaulieu Y. Bedside echocardiography in the assessment of the critically ill. Crit Care Med, 2007,35(Suppl):S235-S249.
[2] 于红奎,夏焙,黄惠君,等.肺超声评分评估新生儿呼吸窘迫综合征肺病变及预后的可行性及临床意义.中国医学影像技术,2017,33(8):1216-1220.
[3] Lichtenstein D, Meziere G, Biderman P, et al. The comet tail artifact: An ultrasound sign of alveolar-interstitial syndrome. Am J Respir Crit Care Med, 1997,156(5):1640-1646.
[4] Gargani L. Lung ultrasound: A new tool for the cardiologist. Cardiovasc Ultrasound, 201l,27(9):6-15.
[5] 孙秀明,陈敏华.超声对肺胸膜小彗星尾征的研究及临床意义.中华超声影像学杂志,2002,11(1):35-38.
[6] Volpicelli G, Elbarbary M, Blaivas M, et al. International evidence -based recommendations for point-of-care lung ultrasound. Intensive Care Med, 2012,38(4):577-591.
[7] Cardinale L, Priola AM, Moretti F, et al. Effectiveness of chest radiography, lung ultrasound and thoracic computed tomography in the diagnosis of congestive heart failure. World J Radiol, 2014,6(6):230-237.
[8] Picano E, Frassi F, Asricola E, et a1. Ultrasound lung comets: A clinically useful sign of extravascular lung water. J Am Soc Echocardiogr, 2006,19(3):356-363.
[9] Noble VE, Murray AF, Capp R, et a1. Ultrasound assessment for extravascular lung water in patients undergoing hemodialysis. Time course for resolution. Chest, 2009,135(6):1433-1439.
[10] Cheorghiade M, Follath F, Ponikowski P, et a1. European Society of Cardiology; European Society of Intensive Care Medicine: Assessing and grading congestion in acute heart failure, a scientific statement from the acute heart failure committee of the heart failure association of the European Society of Cardiology and endorsed by the European Society of Intensive Care Medicine. Eur J Heart Fail, 2010,12(5):423-433.
[11] Hasan AA, Makhlouf HA. B-line:Transthoracic chest ultrasound signs useful in assessment of interstitial lung diseases. Ann Thorac Med, 2014,9(2):99-103.
[12] 余鸿进,陈超.新生儿湿肺研究进展.中华实用儿科临床杂志,2014,29(9):713-715.

