不同Sievers分型二叶主动脉瓣超声特征
石 璨,陈 昕,杨 军,梁彗莉,狄贵金
(中国医科大学附属第一医院心血管超声科,辽宁 沈阳 110001)
二叶主动脉瓣(bicuspid aortic valve, BAV)是临床常见先天性心脏瓣膜病,发病率约0.5%~2.0%,男女比例约为3∶1[1-2]。BAV所致瓣膜功能异常主要包括主动脉瓣狭窄(aortic stenosis, AS)、主动脉瓣反流(aortic regurgitation, AR)及感染性心内膜炎等,同时可合并升主动脉扩张、主动脉缩窄及主动脉夹层等,严重时危及患者生命。Sievers等[3]根据主动脉瓣叶上嵴的数量、瓣叶的空间位置及功能对BAV进行分型,即Sievers分型。本研究探讨不同Sievers分型BAV的超声心动图表现特征。
1 资料与方法
1.1 一般资料 回顾性分析2014年4月—2017年4月 121例BAV患者的临床及声心动图检查资料,男88例,女33例,年龄4~74岁,平均(51.1±13.5)岁;均经手术证实或经临床综合确诊为BAV,并排除主动脉根部术后或其他先天性心脏病术后患者。110例接受手术治疗,其中主动脉根部手术94例(主动脉瓣置换术73例、Bentall术4例、Wheat术15例、David术1例、主动脉瓣成形术1例),升主动脉置换术2例,升主动脉+弓部手术3例,主动脉根部+弓部手术8例,其他3例(动脉导管手术2例、二尖瓣置换术1例)。
1.2 仪器与方法 采用Philips Epiq 7、iE 33及GE Vivid E9型彩色多普勒超声诊断仪,S5-1、S5-1及M5S探头,频率1~5 MHz。行胸骨旁、心尖部、剑突下和胸骨上窝切面等多切面多声窗扫查。于胸骨旁左心室长轴切面测量主动脉瓣瓣环、窦部、窦管结合部及升主动脉近端内径,于大动脉短轴切面观察主动脉瓣膜数目、形态、结构及关闭情况,于多切面常规测量心脏各腔室大小。通过频谱及彩色多普勒图像观察血流动力学改变。
1.3 声像图分析 基于超声心动图表现,依据参考文献[3]方法进行Sievers分型:0型,无嵴;1型,有一嵴,包括3种亚型,1(L-R)亚型左冠瓣和右冠瓣融合,1(R-N)亚型右冠瓣和无冠瓣融合,1(N-L)亚型左冠瓣和无冠瓣融合;2型,有双嵴。同时观察BAV患者心脏其他异常改变及先天性畸形。
1.4 统计学分析 采用SPSS 17.0统计分析软件。计量资料以±s表示,计数资料以百分率表示。采用单因素方差分析比较BAV合并AS、合并AR、同时合并AS及AR患者年龄,以χ2检验比较性别;采用单因素方差分析比较不同Sievers分型间患者年龄、超声测量值,以秩和检验比较性别。P<0.05为差异有统计学意义。
2 结果
121例BAV患者中,合并感染性心内膜炎20例(20/121,16.53%),其他先天性心脏病7例(7/121,5.79%),包括动脉导管未闭2例、房间隔缺损2例、卵圆孔未闭2例、降主动脉缩窄1例;36例(36/121,29.75%)出现AS,26例(26/121,21.49%)出现AR,51例(51/121,42.15%)同时出现AS及AR;BAV合并AS、合并AR、同时合并AS及AR患者年龄差异有统计学意义(F=8.06,P<0.01),合并AR[(42.5±14.6)岁]较合并AS[(55.6±11.5)岁,P<0.01]、同时合并AS及AR患者[(52.1±13.1)岁,P<0.01)]更年轻;三者间性别差异无统计学意义(2=4.79,P=0.91)。
Sievers分型为0型3例(3/121,2.47%;图1);1型118例,其中1(L-R)亚型80例(80/121,66.12%;图2),1(R-N)亚型33例(33/121,27.27%;图3),1(N-L)亚型5例(5/121,4.13%);无2型患者。由于Sievers分型为0型患者样本量过小,仅3例(均同时合并AS及AR),不能从现有数据中得出结论,因此未将此型纳入后续统计分析。1型Sievers分型不同亚型BAV患者年龄、性别、合并AS及AR情况见表1,各亚型中合并AS及AR患者年龄、性别见表2。各亚型BAV患者年龄、性别差异均无统计学意义(P均>0.05)。1(L-R)亚型合并AS、合并AR、同时合并AS及AR患者年龄差异有统计学意义(F=7.96,P<0.01),合并AR较合并AS(P<0.01)、同时合并AS及AR患者(P<0.01)更年轻;1(R-N)亚型合并AS、合并AR、同时合并AS及AR患者年龄差异无统计学意义(F=2.00,P=0.16);1(L-R)及1(R-N)亚型中,合并AS、合并AR、同时合并AS及AR患者间性别差异均无统计学意义(P均>0.05);1(N-L)亚型患者中,合并AR、同时合并AS及AR者仅分别为1例和3例,因样本量过小而未进行比较。
1型Sievers分型不同亚型BAV患者主动脉瓣环、窦部、窦管结合部及升主动脉近端内径超声测量值见表3。1(R-N)亚型主动脉瓣环及窦部内径均小于1(L-R)亚型(P=0.01、0.02),其他各亚型间瓣环、窦部、窦管结合部及升主动脉内径差异均无统计学意义(P均>0.05)。
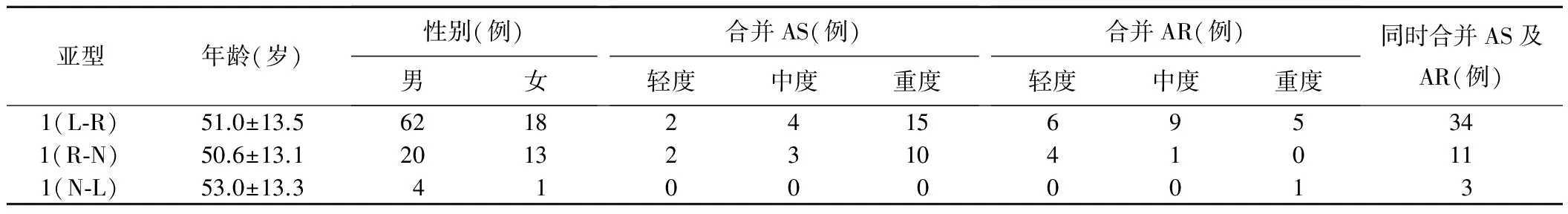
表1 1型Sievers分型不同亚型BAV患者年龄、性别、合并AS及AR情况

表2 1型Sievers分型BAV不同亚型间合并AS、AR患者年龄、性别比较
注:1(N-L)亚型仅1例合并AR及3例同时合并AS及AR患者,由于样本量过小,未进行对比分析
表3 1型Sievers分型不同亚型BAV患者主动脉各部位内径超声测量值比较(mm,±s)
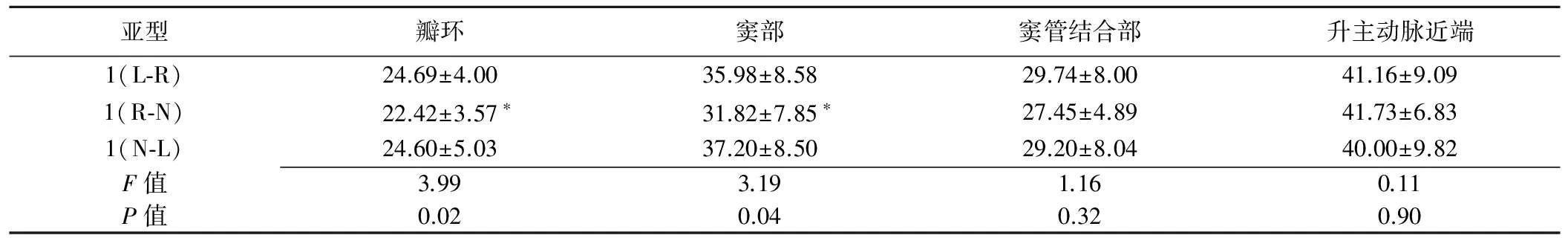
表3 1型Sievers分型不同亚型BAV患者主动脉各部位内径超声测量值比较(mm,±s)
亚型瓣环窦部窦管结合部升主动脉近端1(L⁃R)24.69±4.0035.98±8.5829.74±8.0041.16±9.091(R⁃N)22.42±3.57∗31.82±7.85∗27.45±4.8941.73±6.831(N⁃L)24.60±5.0337.20±8.5029.20±8.0440.00±9.82F值3.993.191.160.11P值0.020.040.320.90
注:*:与1(L-R)亚型比较,P<0.05
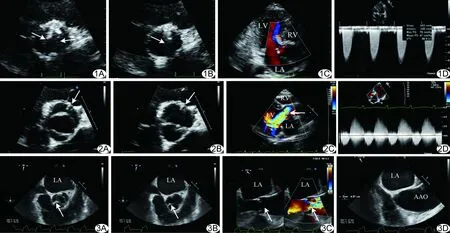
图1 患者男,48岁,Sievers分型为0型BAV A.大动脉短轴切面示收缩期主动脉瓣呈对称的两叶,开放明显受限(箭); B.舒张期主动脉瓣关闭线呈“1”字型(箭); C.心尖三腔心切面彩色多普勒示轻度AR(LV:左心室;RV:右心室;LA:左心房); D.连续多普勒显示主动脉瓣跨瓣血流速度明显加快,为4.40 m/s,跨瓣峰值压差78 mmHg,平均压差47 mmHg 图2 患者男,37岁,Sievers分型为1(L-R)亚型BAV A.大动脉短轴切面示主动脉窦为三窦,收缩期主动脉瓣呈二叶式开放,原左冠瓣、右冠瓣融合处可见嵴回声(箭); B.舒张期主动脉瓣关闭线呈“一”字型,前瓣可见一嵴样回声(箭); C.左心室长轴切面彩色多普勒示重度AR(箭;LV:左心室;RV:右心室;LA:左心房); D.连续多普勒显示主动脉瓣跨瓣血流速度轻度加快,为2.00 m/s,反流频谱形态为重度反流 图3 患者女,45岁,Sievers分型为1(R-N)亚型BAV A.大动脉短轴切面示主动脉窦为三窦,收缩期主动脉瓣呈二叶式开放,原右冠瓣、无冠瓣融合处可见一嵴回声(箭); B.舒张期主动脉瓣关闭线呈“”型(箭); C.左心室长轴切面彩色多普勒对比图像示主动脉瓣开放受限(箭); D.左心室长轴切面示升主动脉内径增宽,为48.70 mm (LA:左心房;AAO:升主动脉)
3 讨论
BAV是胚胎早期主动脉瓣形成过程中出现的以数目异常为主的畸变[4],多为常染色体显性遗传[5]。多数年轻孤立性BAV患者常无临床症状,但涡流冲击异常的瓣叶结构,可逐渐引起瓣叶增厚、钙化、僵硬,导致AS、AR等并发症。通过超声心动图检查可早期发现BAV,并准确评价瓣膜功能及其他合并症,有助于临床合理制定治疗方案。
Sievers分型中,1(L-R)亚型BAV最常见,0型和2型BAV分别仅占7%和5%[3]。本研究中,1(L-R)亚型BAV占66.12%(80/121),无2型BAV患者。0型BAV通常有2个Valsalva窦,主动脉瓣呈对称的两叶而无嵴,瓣叶可呈“纵裂式”或“横裂式”排列,以前者更常见;瓣叶“纵裂式”排列者左心室长轴切面可见主动脉瓣关闭线消失,大动脉短轴切面示2个瓣叶呈左右排列,交界连合呈前后走向,主动脉瓣关闭线呈“1”字形;“横裂式”排列者左心室长轴切面可见主动脉瓣关闭线仍位于中央,而开放受限,大动脉短轴切面示2个瓣呈前后排列,交界连合呈左右走向,主动脉瓣关闭线呈“一”字形。BAV主动脉瓣瓣口开放面积减小,血流冲击可造成瓣叶功能异常,出现AS或AR时,频谱及彩色多普勒超声可见跨瓣血流速度加快或反流信号[1]。本组3例0型BAV中,2例瓣叶为左右排列,1例瓣叶为前后排列,均出现AS及AR。1型BAV瓣叶多呈不对称的两叶,其中较大瓣叶可为任何2个正常瓣叶融合而成,可见嵴,融合方式不同的瓣叶其空间位置不同,左心室长轴切面常显示主动脉瓣关闭线偏心,呈圆顶状开放,大动脉短轴切面收缩期可见瓣口呈椭圆形,常偏向一侧,开放呈鱼口状,主动脉瓣关闭时从“Y”字形变为“一”字形,L-R、R-N、N-L型BAV的嵴分别位于原左冠瓣与右冠瓣、右冠瓣与无冠瓣、左冠瓣与无冠瓣之间[3]。BAV患者常伴主动脉疾病。本组1型BAV患者中,1(L-R)亚型BAV主动脉瓣环及窦部内径较1(R-N)亚型BAV增宽,与Ruzmetov等[6-7]研究结果一致。Barker等[8]关于BAV血流动力学的MRI研究显示,BAV患者主动脉不对称的瓣叶结构可导致射流束方向发生改变,从而引起主动脉各部位血管壁剪切力发生变化。左冠瓣与右冠瓣融合型BAV易引起主动脉根部及管状升主动脉不对称扩张,右冠瓣与无冠瓣融合型BAV易引起主动脉弓部扩张[8-9]。因此,对BAV患者行超声心动图检查时,应尽可能仔细观察升主动脉远端,常规扫查胸骨上窝切面,评价主动脉弓部内径,尤其对1(R-N)亚型BAV患者,应注意观察其远端大动脉是否扩张。此外,本研究分析BAV合并症,发现BAV合并AR者相对于合并AS患者更年轻,与Benedik等[10]研究结果一致。
当主动脉瓣出现钙化时,BAV需与老年性退行性变相鉴别。退行性变钙化多从瓣根及瓣环开始,BAV钙化主要以嵴及瓣体为主,且发病年龄较轻[11]。严重钙化时,重度狭窄的BAV与三叶主动脉瓣鉴别困难,由于钙化和嵴回声的影响,在舒张期,超声易将主动脉瓣误诊为三叶瓣。收缩期主动脉瓣开放时,应仔细观察瓣叶数目及开放形式[1],舒张期则应注意观察关闭线、瓣叶对合及有无脱垂,警惕主动脉瓣畸形存在。此外,由于主动脉瓣口狭窄,血液湍流造成瓣膜损伤,易并发感染性心内膜炎,BAV患者中感染性心内膜炎发生率约为10%~30%[12]。本研究121例BAV中,20例发生感染性心内膜炎,占16.53%(20/121)。对有发热症状的BAV患者,超声检查中应仔细观察主动脉瓣形态,多切面扫查,注意左心室面有无赘生物及探查主动脉瓣周组织[13],排除瓣周并发症。本组7例BAV同时合并其他先天性心脏病,占5.79%(7/121)。
本研究的局限性:①为单中心研究,病例收集难免存在偏倚;②样本量较少,Sievers分型为0型患者过少,且缺乏2型患者,对不同分型BAV的超声特点还需今后扩大样本量进一步研究证实。
[参考文献]
[1] Siu SC, Silversides CK. Bicuspid aortic valve disease. J Am Coll Cardiol, 2010,55(25):2789-2800.
[2] Michelena HI, Prakash SK, Della Corte A, et al. Bicuspid aortic valve identifying knowledge gaps and rising to the challenge from the international bicuspid aortic valve consortium (BAVCon). Circulation, 2016,129(25):2691-2704.
[3] Sievers HH, Schmidtke C. A classification system for the bicuspid aortic valve from 304 surgical specimens. J Thorac Cardiovasc Surg, 2007,133(5):1226-1233.
[4] 任卫东,张玉奇,舒先红,等.心血管畸形胚胎学基础与超声诊断.北京:人民卫生出版社,2015:237.
[5] Cripe L, Andelfinger G, Martin Lg, et al. Bicuspid aortic valve is heritable. J Am Coll Cardiol, 2004,44(1):138-143.
[6] Ruzmetov M, Shah JJ, Fortuna RS, et al. The association between aortic valve leaflet morphology and patterns of aortic dilation in patients with bicuspid aortic valves. Ann Thorac Surg, 2015,99(6):2101-2107.
[7] Khoo C, Cheung C, Jue J. Patterns of aortic dilatation in bicuspid aortic valve-associated aortopathy. J Am Soc Echocardiog, 2013,26(6):600-605.
[8] Barker AJ, Markl M, Lorenz R, et al. Bicuspid aortic valve is associated with altered wall shear stress in the ascending aorta. Circ Cardiovasc Imaging, 2012,5(4):457-466.
[9] Verma S, Siu SC. Aortic dilatation in patients with bicuspid aortic valve. N Engl J Med, 2014,370(20):1920-1929.
[10] Benedik J, Dohle DS, Wendt D, et al. Comparison of ascending aortic cohesion between patients with bicuspid aortic valve stenosis and regurgitation. Eur J Cardiothorac Surg, 2014,46(6):e89-e93.
[11] Baumgartner H, Hung J, Bermejo J, et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: A focused update from the European association of cardiovascular imaging and the American society of echocardiography. J Am Soc Echocardiogr, 2017,30(4):372-392.
[12] Ward C. Clinical significance of the bicuspid aortic valve. Heart. 2000,83(1):81-85.
[13] 杨茹,杨军,白洋.超声诊断主动脉瓣二叶畸形合并心内膜炎伴瓣周脓肿1例.中国医学影像学杂志,2014,8(10):592-593.

