不同处理方法对芜菁游离小孢子出胚率的影响
贾 凯,吴 慧,许 建,高 杰
(新疆农业大学林学与园艺学院,新疆乌鲁木齐830052)
芜菁(Brassica rapa L.)属十字花科芸薹属2年生根菜类蔬菜。在新疆维吾尔语中称恰麻古,是维吾尔族居民食药两用的传统蔬菜[1]。目前,新疆地区所栽培的芜菁品种混杂,多为农户自行留种后育成的农家品种,由于这些农家品种存在提早抽薹现象严重且容易遭受病虫害,因此选育新的杂交品种已成为芜菁育种的主要方向。选育新的杂交品种需要纯合的亲本进行杂交,获得纯合的亲本一般通过常规技术进行多代自交,此方法耗时长、效率低。利用游离小孢子培养方法,可在1~2年内获得稳定的纯合自交系,缩短育种周期,提高育种效率[2]。因此,游离小孢子培养技术是芜菁育种的一条有效途径。
有关游离小孢子培养技术方面前人做了许多研究,其中,Lichter利用小孢子培养技术首次在甘蓝型油菜上成功地获得再生植株[3];Sato等通过大白菜游离小孢子培养形成双单倍体植株用于育种[4];Takahata等对3种花青菜的供体植株进行低温处理,然后再进行小孢子培养获得胚状体[5];蒋武生等对芜菁小孢子热激处理后培养获得胚状体[6];乔丽桃等对芜菁花蕾长度与小孢子单核靠边期的关系进行初步探究,并观察了芜菁小孢子胚胎发生的显微结构[7];王娜等研究了芜菁花蕾大小与小孢子发育时期、小孢子胚胎发生率的对应关系[8],但在试验过程中发现,芜菁胚状体发生率较低,这为后续试验的进行带来不便。因此,本试验对芜菁小孢子胚状体发生过程中的影响因素进行研究,以提高芜菁小孢子出胚率,从而为新疆芜菁的遗传育种研究提供基础条件。
1 材料和方法
1.1 试验材料
供试材料来源于新疆柯坪县当地农家芜菁品种阿恰芜菁。2015年8月于新疆农业大学林学与园艺学院试验田中种植芜菁材料,将收获的芜菁肉质根置于4℃低温下保存。2016年4月21日将已经通过低温春化的肉质根种植于露地,5月8日植株陆续抽薹开花,植株生长环境温度范围为12~26℃。
1.2 试验方法
1.2.1 花蕾的采集与处理 于每日 08:00—10:00(采蕾环境温度范围为15~18℃)随机摘取供试植株的主花序或一级分枝花序放入培养皿中,置于放有冰袋的泡沫箱中及时带回组培实验室。将花序上的花蕾轻轻用镊子取下,选取处于单核靠边期的花蕾[8](约2.0~3.0mm)转移到2%NaClO(含2滴吐温乳化剂)中消毒10 min,再用无菌水冲洗3次,每次5 min。花蕾消毒及小孢子游离与培养的整个试验过程均在无菌条件下完成,且所用试验工具及液体都经灭菌后置于4℃条件预冷。
1.2.2 小孢子的游离与培养 将消毒过的花蕾置于烧杯中,并加入1 mL B5洗涤培养基(pH值5.8),用注射器活塞压榨花蕾,释放小孢子,通过45μm尼龙筛网过滤小孢子悬浮液。将收集的滤液用B5培养基定容至5 mL,4℃、800 r/min离心5 min,之后倒掉上清液,留下沉淀,再倒入5mL B5培养基,重新悬浮小孢子并离心,共离心3次。最后,将收集到的小孢子用1 mLNLN培养基制成悬浮液,调整小孢子密度为10万~20万个/mL,分装至直径为60 mm的培养皿中,每皿约3 mL,用Parafilm膜封口。
1.2.3 不同处理方法对小孢子胚胎发生率的影响 小孢子的高温热激处理:将不添加激素的NLN-13小孢子悬浮液放入恒温箱中黑暗静置培养,分别设置25℃(CK)、33℃、35℃共3种温度和24、48、72 h共3种时间的热激处理,随后转到25℃继续黑暗静置培养。
不同蔗糖浓度的培养基培养:分别用 NLN-9(蔗糖9%)、NLN-13(蔗糖13%)(CK)、NLN-15(蔗糖15%)3种不同蔗糖浓度且不含激素的NLN液体培养基悬浮培养小孢子,随后分装于60 mm培养皿中,每皿3 mL,Parafilm膜封口。经33℃、24 h热激处理后转到25℃黑暗静置培养。
培养基中添加6-BA和NAA培养:将小孢子沉淀物均匀悬浮于含有不同浓度 NAA(0.1、0.2、0.4 mg/L)、6-BA(0.1、0.2、0.4 mg/L)激素含量的 NLN-13培养基中,并分装于60 mm培养皿中,每皿3 mL,Parafilm膜封口。以不添加任何激素的NLN-13培养基作为对照组(CK)。经33℃、24 h热激处理后转到25℃黑暗静置培养。
1.2.4 胚状体的观察 以上试验每个处理均取20个花蕾。培养30 d后统计产胚量,并将形成的小孢子胚转入固体培养基中培养。在培养过程中使用倒置显微镜观察小孢子的变化,采用 Duncans新复极差法进行产胚量间差异显著性比较。
2 结果与分析
2.1 不同热激温度、时间处理对芜菁胚状体发生的影响
由表1可知,在其他培养条件相同的情况下,25℃(CK)条件下恒温培养未出现胚状体;热激温度为33℃、时间为24 h时,出胚率最高,为1.25胚/蕾,48 h后胚诱导率降至0.60胚/蕾,72 h后胚诱导率仅为0.05胚/蕾;当热激35℃、时间为 24 h时,胚诱导率为 0.35胚/蕾,48 h时为 0.20胚/蕾。本研究过程中还发现,33℃培养条件下形成的胚状体中子叶形胚比率最高,达到94.5%;而35℃时,子叶形胚比率仅为63.6%,这可能是由于热激温度过高,不适于小孢子的发育。有研究认为,热激时间以24 h为出胚率最高,小孢子培养的前12 h是小孢子分裂的敏感期,而胚胎发生的敏感期在开始培养的24 h内[9]。由此可见,热激处理对于芜菁的小孢子胚胎发生是必需的,本研究得出33℃、24 h的热激处理适用于芜菁游离小孢子培养。
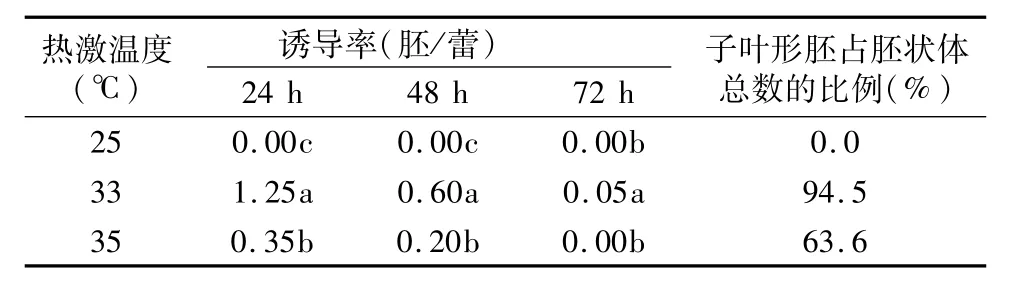
表1 不同热激温度、时间处理对芜菁胚状体发生的影响
2.2 不同蔗糖浓度对芜菁胚状体发生的影响
蔗糖在小孢子培养的过程中调控着培养基的营养成分和渗透压[10]。由表2可知,13%蔗糖浓度(NLN-13)诱导率最高,为1.25胚/蕾;在蔗糖浓度为15%(NLN-15)时,出胚量相对较少,平均为0.85胚/蕾;蔗糖浓度为9%(NLN-9)时,未出现胚状体。结果表明,当蔗糖浓度为13%(NLN-13)和15%(NLN-15)时能够诱导出胚状体,但13%(NLN-13)的蔗糖浓度最适于芜菁小孢子的胚胎发生。

表2 不同蔗糖浓度对芜菁胚状体发生的影响
2.3 不同激素配比对芜菁胚状体发生的影响
由表3可知,NLN-13培养基中单独添加6-BA时,小孢子胚诱导率较CK并无显著提高;添加0.1 mg/L 6-BA时出胚率相对最高,达到2.10胚/蕾;高浓度的6-BA有抑制胚状体的现象发生,当6-BA浓度为0.4 g/L时,出胚率降低到0.6胚/蕾,在所有激素处理中处于最低水平。培养基中单独添加NAA时,出胚率显著高于CK,随NAA浓度增加,出胚率呈先上升后下降的趋势,当NAA浓度为0.2 mg/L时达到最高,为8.60胚/蕾,是 CK的4.7倍,添加0.2 mg/LNAA是所有处理中能最有效提高出胚率的方法。在培养基中同时添加NAA与6-BA时,出胚率有小幅提升;当同时添加0.2 mg/L NAA和0.2 mg/L 6-BA时,芜菁小孢子的胚胎发生率达到最高,为3.15胚/蕾;增大NAA与6-BA浓度分别到0.4 mg/L时,胚诱导率下降到1.10胚/蕾。在培养基中加入激素能有效地提高小孢子胚胎发生的频率,但是加入激素后,胚状体的发育状况也受到影响。单独添加6-BA的处理中,所诱导出的胚状体发育不完全,畸形胚数量相对较少;单独添加0.2 mg/L NAA时,子叶形胚占胚状体总数的比率相对较高,达到72.1%;当NAA浓度为0.4 mg/L时,子叶形胚比率下降到 52.3%。综上所述,在培养基中单独添加0.2 mg/L NAA可以有效提高芜菁小孢子胚诱导率,且子叶形胚比率相对较高。当在培养基中同时添加NAA与6-BA时,并不能使小孢子胚胎发生与发育朝着良好的方向发展。
2.4 小孢子离体发育过程
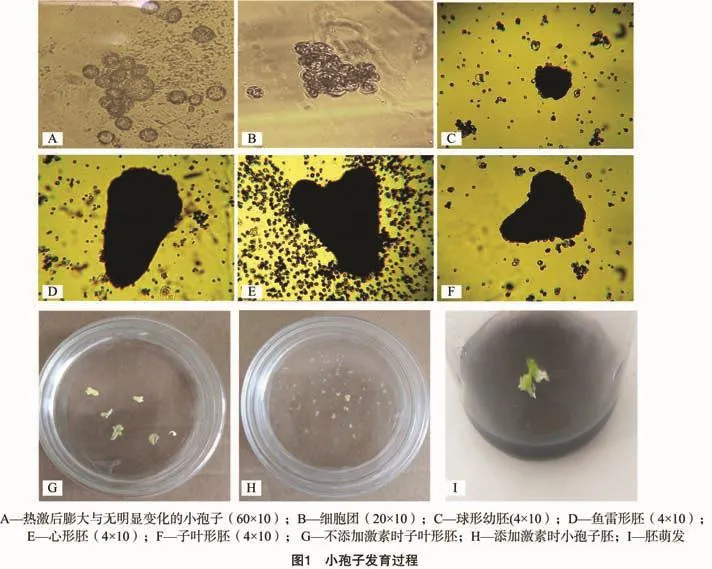
从图1可以看出,小孢子的膨大情况各不相同,同一处理中出现了膨大的小孢子和未有变化的小孢子(图1-A);随着培养时间的增加,小孢子形成细胞团(图1-B);细胞团发育成为胚状体的过程为球形胚-鱼雷形胚-心形胚-子叶形胚(图1-C、图1-D、图1-E、图1-F);未含激素的培养基中产生的小孢子胚发育状况良好(图1-G);添加激素后小孢子胚胎数明显增多,但胚状体发育情况各异,出现较多畸形胚(图1-H);胚状体转接至固体培养基后转绿(图1-I)。将小孢子胚接种于 B5+0.2 mg/L 6-BA +0.05 mg/L NAA固体培养基上,胚状体逐渐转绿并开始萌发,胚状体萌发后形成较多幼芽。然后将幼芽转入B5+0.2 mg/L NAA生根培养基上可以生根,形成完整植株。
3 结论与讨论
目前游离小孢子培养技术在大多数蔬菜的育种工作中都得以运用,本试验在已确定小孢子处于单核靠边期时花蕾大小的对应关系后,主要针对南疆地区主栽农家芜菁品种阿恰芜菁进行诱导,探究小孢子出胚的最适条件以获得更多数量的双单倍体纯合植株。
高温热激处理可以改变小孢子的发育途径,使其不能形成成熟的花粉粒转而向胚胎发育的途径发展,形成小孢子胚[11]。本研究认为,33℃、24 h的高温热激处理对芜菁小孢子胚胎发生是必要的,出胚率为1.25胚/蕾,而且小孢子胚的生长状况良好,多数可发育成子叶形胚。培养基中的蔗糖一方面维持着小孢子生长发育所需要的营养物质,另一方面调节着培养基中的渗透压[12-13]。在诱导油菜、大白菜等小孢子胚状体过程中发现,当NLN培养基中的蔗糖浓度为13%时,小孢子胚的发生与发育状况最好[14],这与本研究所得结论一致。蒋武生等研究发现,不含任何激素的NLN培养基有利于胚状体的发育[15];朱守亮等在 NLN-13培养基中添加0.1 mg/L 6-BA和 0.05 mg/L NAA能够诱导出高胚产量[16];李岩等研究发现,NLN培养基中加入0.05mg/LNAA和0.05mg/L 6-BA的胚诱导率显著高于不加入任何激素的NLN培养基[17];戴希刚等在进行羽衣甘蓝的小孢子培养试验中发现,6-BA对胚胎发生有抑制作用[18]。本试验结果表明,在NLN培养基中单独添加0.2 mg/L NAA可以显著提高小孢子出胚数,单独添加低浓度的6-BA能够促进芜菁小孢子胚的发生,但效果不如NAA明显,混合加入NAA与6-BA对小孢子胚的产生无明显作用。同时研究发现,添加激素后小孢子的胚胎发育受到一定影响,培养过程中出现畸形胚,胚状体到一定时期并不会再向着子叶形胚发展。本试验研究认为,采用33℃热激处理24 h时,在NLN-13中加入0.2 mg/L NAA是芜菁游离小孢子的胚胎发生与发育的最佳条件。
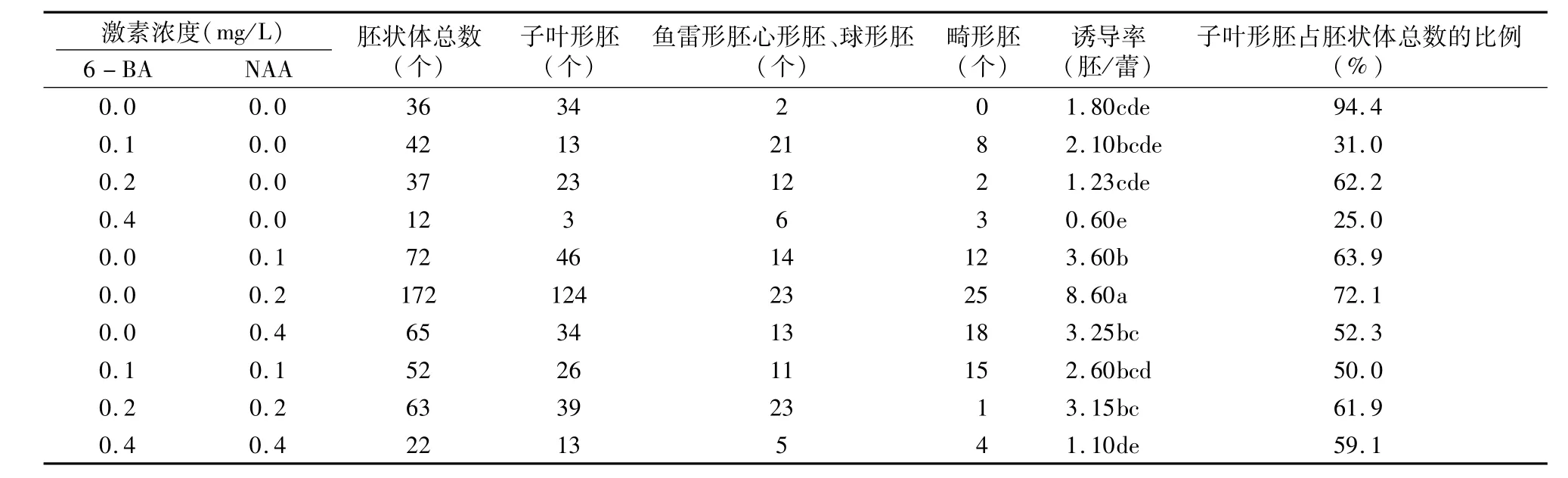
表3 不同激素浓度对芜菁胚状体发生的影响
参考文献:
[1]张 涛,田为真,米世伟,等.恰麻古尔提取物平喘止咳作用的初步探究[J].新疆医科大学学报,2009,32(9):1237-1239.
[2]袁素霞.甘蓝和青花菜小孢子培养及早期胚胎形成相关基因差异表达分析[D].北京:中国农业科学院,2009.
[3]Lichter R.Efficient yield of embryoids by culture of isolated microspores of different Brassicaceae species[J].Plant Breeding,1989,103(2):119-123.
[4]Sato T,Nishio T,Hiraim M.Plant regeneration from isolation microspore cultures of Chinese cabbage(Brassica campestri ssp.pekinensis)[J].Plant Cell Reports,1989,8(8):486-488.
[5]Takahata Y,Brown D CW,KellerW A,etal.Dry artificial seeds and desiccation tolerance induction in microspore-derived embryos of broccoli[J].Plant Cell Tissue and Organ Culture,1993,35(2):121-129.
[6]蒋武生,原玉香,张晓伟,等.芜菁游离小孢子胚和植株的形成[C]//河南省科学技术协会.河南省植物生理学会三十周年庆典暨学术研讨会论文集.郑州:河南省农业科学院园艺研究所,2010:243-245.
[7]乔丽桃,高 杰.芜菁花蕾长度与花粉小孢子单核靠边期关系的研究[J].新疆农业科学,2013,50(4):620-624.
[8]王 娜,贾 凯,妥秀兰,等.芜菁小孢子培养及其胚状体离体发育过程[J].西北农业学报,2016,25(9):1392-1398.
[9]刘公社,李 岩,刘 凡,等.高温对大白菜小孢子培养的影响[J].植物生态学报(英文版),1995,37(2):140-146.
[10]桑玉芳,张恩慧,杨安平,等.甘蓝游离小孢子培养中影响胚状体形成的主要因素[J].西北农业学报,2007,16(2):125-129.
[11]方淑桂,曾小玲,朱朝辉,等.结球甘蓝游离小孢子胚胎发生[J].植物科学学报,2005,23(6):530-534.
[12]韩 阳,叶雪凌,冯 辉.大白菜小孢子培养影响因素研究[J].中国蔬菜,2006(7):16-18.
[13]王玉书.羽衣甘蓝小孢子培养及红叶性状的SRAP标记[D].沈阳:沈阳农业大学,2012.
[14]周 英,冯 辉,王超楠,等.大白菜小孢子胚诱导和植株再生[J].沈阳农业大学学报,2006,37(6):816-820.
[15]蒋武生,原玉香,张晓伟,等.提高大白菜游离小孢子胚诱导率的研究[J].华北农学报,2005,20(6):34-37.
[16]朱守亮,张恩慧,杨安平,等.2个甘蓝F1小孢子培养中高出胚率的诱导技术研究[J].西北农业学报,2009,18(6):237-241.
[17]李 岩,刘 凡,曹鸣庆.通过游离小孢子培养方法获得小白菜三个变种的胚胎和植株[J].华北农学报,1993,8(3):92-97.
[18]戴希刚,施雪萍,包满珠.基因型与培养条件对羽衣甘蓝小孢子胚胎发生的影响[J].植物生理学报,2012,48(11):1113-1119.

