慢性疼痛相关MicroRNA的研究进展
董环 郝冉 宋园园 张鹏 胡洁
1河北医科大学护理学院研究中心(石家庄050017);2航天中心医院护理部(北京100049)
慢性疼痛是一类临床上普遍存在且难治的疾病,严重影响患者的生存质量。据统计,世界上至少有20%人口饱受慢性疼痛折磨[1]。慢性疼痛发生机制复杂,主要包括伤害性感受、外周敏化和中枢敏化[2]。机体接受伤害性刺激后,损伤部位释放致痛物质致敏伤害性感受器,继而背根神经节(dorsal root ganglia,DRG)发放异位冲动增加突触传递,导致低强度的刺激也可引发疼痛,即形成“外周敏化”;在脊髓水平,神经递质受体活化增加,同时神经胶质细胞激活并释放促炎因子,造成背角神经元兴奋性增强,并将伤害信息上传至大脑,引起疼痛反应及下行调制作用,形成“中枢敏化”[2]。
目前研究表明,表观遗传学修饰参与慢性疼痛的发生发展过程,其中DNA甲基化、组蛋白修饰和MicroRNA(miRNA)是3种常见的表观遗传学修饰[3]。miRNA是一类长度约22个核苷酸的非编码RNA,可通过序列互补结合到靶mRNA的3′UTR区,抑制翻译或促进靶mRNA降解,调控细胞表型及功能[4]。研究发现在慢性疼痛中存在大量差异表达的miRNA,对其表达进行调节,可加重或减轻疼痛。miRNA表达调控存在多个水平,包括外周、脊髓和大脑,另外在外周血中也存在部分差异表达的miRNA作为疼痛的潜在标志物[5⁃6]。根据文献的汇总结果,本文将主要从异位神经冲动、神经递质受体活化、炎症反应3个方面探讨慢性疼痛相关miRNA或miRNA簇(表1),并对其参与慢性疼痛机制的研究进展进行概述。
1 异位神经冲动相关miRNA
1.1 miR⁃183簇 miR⁃183簇包括miR⁃183、miR⁃96和miR⁃182。在慢性疼痛中miR⁃183簇在大鼠DRG中低表达,并与离子通道导致的异位神经冲动有关[7⁃8]。PENG 等[7]发现,在SNI模型中,miR⁃183簇通过酪氨酸激酶受体B阳性的低阈值机械感觉神经元控制痛觉敏感性,其靶基因CACNA2D编码电压门控钙通道的辅助亚基α2δ,并在人和小鼠DRG中高度保守。进一步研究发现,miR⁃183簇通过靶向作用于主要的转录调控因子,间接控制超过80%的神经病理性疼痛相关基因的表达。此外,LIN等[8]证实miR⁃183/96与电压门控钠通道有关,在SNL模型中,DRG中miR⁃183/96表达下调,其靶基因Nav1.3表达上调,过表达miR⁃183/96能抑制Nav1.3的表达,并减轻神经病理性疼痛。
1.2 其他miRNA 目前研究发现,慢性疼痛中存在多种miRNA可通过调节离子通道亚基表达影响异位神经冲动的发放。miRNA⁃30b在SNI和SNL的DRG中均表达下调,并分别靶向作用于SCN9A(编码Nav1.7)和SCN3A(编码Nav1.3),从而诱导疼痛[9⁃10]。miR⁃17⁃92 簇是一个高度保守的基因簇,编码6个不同的miRNA。SAKAI等[11]发现,miR⁃17⁃92簇在SNL的DRG中表达上调,并靶向调节电压门控钾通道及其亚基参与疼痛调节,但在CFA模型中表达未发生改变,揭示了miR⁃17⁃92簇在慢性疼痛动物模型中存在不同的表达模式。LU等[12]研究证实,在SNI的DRG中miR⁃449a通过抑制瞬时受体电位阳离子通道亚族A成员1(transient receptor potential A1,TRPA1)和钙激活钾通道亚基α1(编码基因KCNMA1)的表达可减轻疼痛。此外,在癌痛模型中,DRG中miR⁃34c⁃5p和miR⁃1a⁃3p表达上调,并分别靶向 Cav2.3和 Clcn3参与疼痛调节[13⁃14]。
2 神经递质受体活化相关miRNA
2.1 miR⁃183 XIE等[15]证实,在CCI模型中,脊髓背角中miR⁃183表达下调,并靶向作用于哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)调节下游血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,即通过抑制mTOR/VEGF信号通路,抑制AMPA受体表达,从而减轻疼痛。ZHOU等[16]在CCI中发现,脊髓中miR⁃182⁃5p通过靶向抑制酪氨酸激酶Ephb1受体的表达减轻神经元敏感性及痛觉过敏,并证明此过程由NMDA受体调节。总之,在慢性疼痛中miR⁃183簇在脊髓背角中可能与谷氨酸受体调节的背角神经元兴奋性有关。
2.2 miR⁃212/132簇 XIA 等[17]在CCI中证实,环磷腺苷效应元件结合蛋白(cAMP response element binding protein,CREB)和CREB依赖的转录共激活因子(CREB⁃regulated transcription coactivator 1,CRTC1)与miR212/132之间存在正反馈作用,NR2B⁃CRTC1/CREB⁃miR212/132信号通路在CCI中发挥关键作用,鞘内注射CRTC1/CREB腺病毒载体及miR212/132反义锁核酸抑制其表达可减轻痛觉过敏;另外有研究表明,在癌痛模型中,CRTC1/CREB与miR212/132之间亦存在正反馈作用[18⁃19],但 miR⁃212/132 在 CCI和癌痛模型中表达模式不同。LEINDERS等[20]在SNI的脊髓及DRG中均发现miR⁃132⁃3p表达明显上调,并证实其靶向调节脊髓中AMPA受体的GluA1亚基从而加重疼痛。总之,CRTC1/CREB⁃miR⁃132/212通路与NMDA及AMPA受体的表达密切相关,并在慢性疼痛中发挥关键作用。
2.3 其他miRNA HUANG等[21]首次证明,在化疗药物紫杉醇和前根切断诱导的神经病理性疼痛模型中,脊髓背角神经元中的γ⁃氨基丁酸(γ⁃aminobutyric acid,GABA)能突触功能明显受损,敲低或抑制miR⁃500后可通过靶向调节Gad1基因,促进GAD67的表达并改善GABA能突触功能,从而减轻神经病理性疼痛。DING等[22]证实在CCI的对侧前扣带皮层中,miR⁃539表达下调,并靶向调节NR2B亚基从而发挥镇痛作用。进一步研究发现,选择性抑制含有NR2B亚基的NMDA受体后疼痛减轻,揭示miR⁃539通过调节NR2B的表达并影响NMDA受体活性,参与疼痛调节。
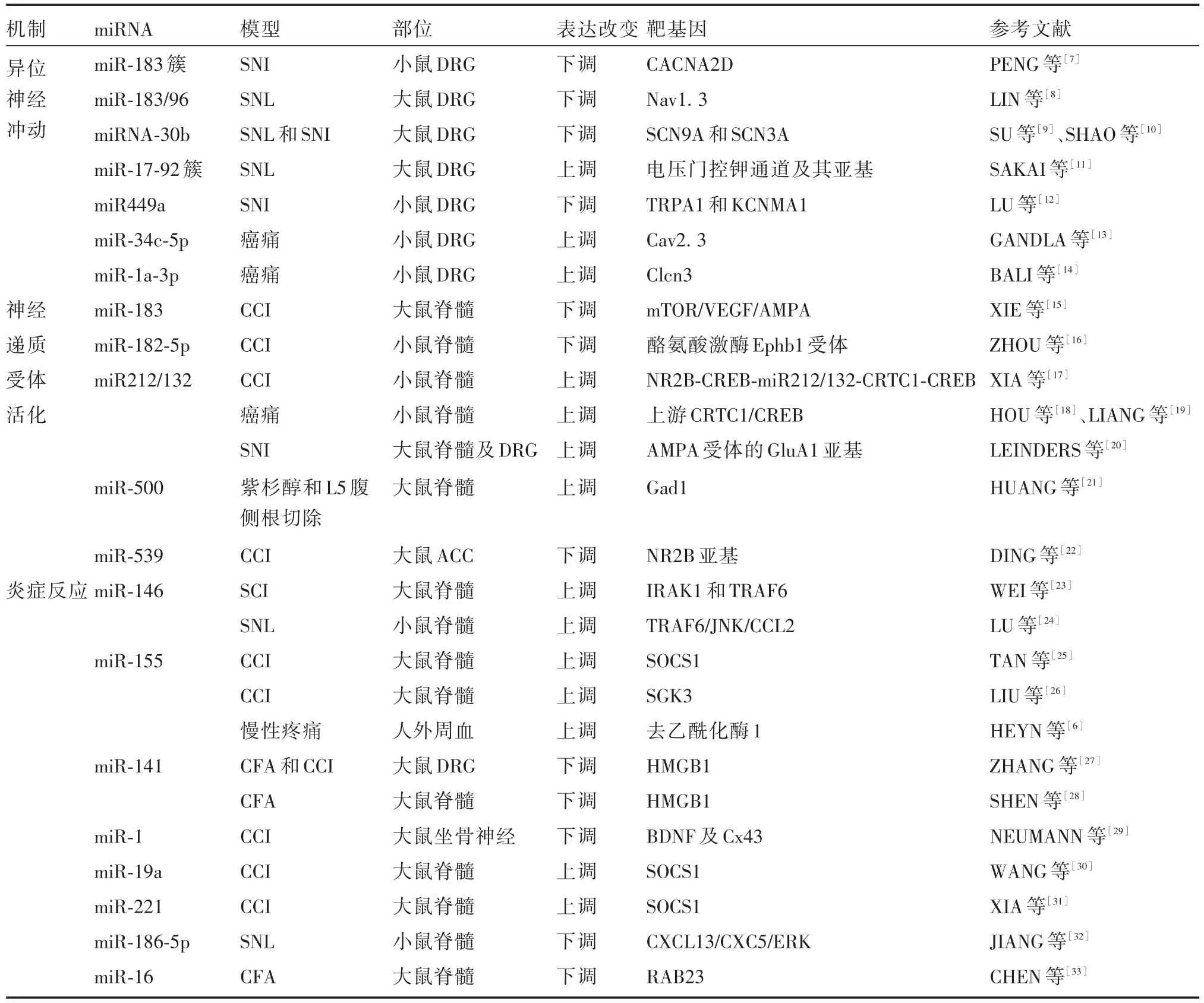
表1 慢性疼痛相关miRNATab.1 miRNA associated with chronic pain
3 炎症反应相关miRNA
3.1 miR⁃146 miR⁃146是目前研究较多的参与炎症信号通路的miRNA。WEI等[23]研究表明,在SCI模型的脊髓中miR⁃146表达上调,并靶向调节白介素⁃1受体相关激酶1(IL⁃1 receptor⁃associated kinase 1,IRAK1)和肿瘤坏死因子受体相关蛋白6(TNF receptor⁃associated factor 6,TRAF6),从而抑制促炎因子释放,发挥抗炎作用。LU等[24]证实,在SNL的星形胶质细胞中miR⁃146a⁃5p表达上调,并负向调节TRAF6及下游通路JNK/CCL2。同时证明激活通路TRAF/JNK能上调miR⁃146a⁃5p的表达水平,提示miR⁃146a⁃5p可能通过炎症通路参与疼痛调节。
3.2 miR⁃155 miR⁃155是一种多功能miRNA,由其下游基因介导,参与多种生理病理过程。研究表明在CCI中脊髓miR⁃155表达上调,通过靶向结合细胞因子信号转导抑制因子1(suppressor of cytokine signalling 1,SOCS1)可促进核转录因子⁃κB(nuclear factor⁃κB,NF⁃κB)和p38丝裂原活化蛋白激酶的活化,促进炎症反应,从而加重痛觉过敏[25]。血清和糖皮质激素调节蛋白激酶(serum and gluco⁃corticoid regulated protein kinase,SGK)在小胶质细胞中负向调节多种炎症因子并抑制NF⁃κB信号通路转导从而发挥抗炎作用[34]。LIU等[26]在CCI的脊髓中证实了miR⁃155的另一个靶基因SGK3,miR⁃155通过靶向调节SGK3促进炎症反应,从而发挥致痛作用。此外,HEYN等[6]发现,在神经病理性疼痛患者外周血中miR⁃155表达上调,并靶向调节去乙酰化酶1,抑制初始CD4+T细胞分化为Treg细胞,促进炎症反应,从而加重痛觉过敏。总之,miR⁃155可能通过发挥促炎作用参与疼痛调节。
3.3 miR⁃141 高迁移率族蛋白1(high⁃mobility group box 1,HMGB1)在神经病理性疼痛中发挥关键作用,抗HMGB1抗体已被证实可减轻神经性疼痛[35]。ZHANG等[27]发现,在CCI的DRG中miR⁃141表达下调,并靶向调节HMGB1,过表达miR⁃141可通过抑制促炎细胞因子释放发挥抗炎作用,从而减轻疼痛。同时,此效应在CFA的脊髓中也得到证实[28]。揭示了miR⁃141在慢性疼痛中可能通过抑制炎症反应参与疼痛调节。
3.4 miR⁃1 在周围神经系统的神经胶质细胞中亦存在疼痛相关miRNA。NEUMANN等[29]研究发现,在CCI的坐骨神经中,miR⁃1表达下调,其靶基因脑源性神经营养因子(brain⁃derived neurotrophic factor,BDNF)及Cx43表达上调,过表达miR⁃1可减轻痛觉过敏;而在DRG和脊髓中miR⁃1表达未改变。之后,该团队证明敲低BDNF也可造成miR⁃1表达下调,提示miR⁃1与BDNF之间可能存在负反馈环路[36]。
3.5 其他miRNA 与miR⁃155类似,在CCI的脊髓中miR⁃19a及miR⁃221均表达上调,并靶向调节SOCS1的表达参与疼痛调节[30⁃31],其中,miR⁃221亦被证实可通过促进NF⁃κB和p38丝裂原活化蛋白激酶信号通路的活化发挥促炎作用[31]。LEINDERS等[20]研究发现,在周围神经病变患者的白细胞中miR⁃132⁃3p表达上调,并进一步在SNI中证实,脊髓及DRG中miR⁃132⁃3p亦表达上调,鞘内注射miR⁃132⁃3p抑制剂后小胶质细胞活化增加且疼痛加重,揭示miR⁃132⁃3p在神经病理性疼痛中的重要作用。在SNL中,脊髓背角神经元中miR⁃186⁃5p表达下调,过表达miR⁃186⁃5p可通过靶向调节CXCL13/CXCR5/ERK通路促进星形胶质细胞活化,从而减轻疼痛[32]。CHEN等[33]发现,在CFA的脊髓中miR⁃16表达下调,其靶基因为Ras相关蛋白23,过表达miR⁃16可通过抑制Ras相关蛋白23及p38/MAPK信号通路活性使疼痛减轻。
总之,miRNA参与慢性疼痛的神经传导和免疫过程,并可能作为“主开关”调节特定的基因表达。尽管目前在不同的慢性疼痛模型中已发现较多疼痛相关miRNA,但由于miRNA在体内存在复杂的网络调控系统,因此,针对疼痛传导通路的不同部位来探究miRNA的作用机制尤为重要,目前研究部位主要集中于DRG和脊髓,很少涉及外周神经和大脑;miRNA的作用机制主要包括DRG中异位冲动发放、脊髓中神经递质受体活化及炎症反应,细胞自噬等其他相关机制研究尚少。此外,目前尚缺乏关于炎性疼痛及癌痛动物模型的研究,这在一定程度上限制了对慢性疼痛相关miRNA的深入研究。因此,进一步研究及阐明miRNA在慢性疼痛中的作用机制有助于理解慢性疼痛的发生发展过程,并为临床治疗提供新策略。
参考文献
[1] GOLDBERG D S,MCGEE S J.Pain as a global public health priority[J].Bmc Public Health,2011,11(1):1⁃5.
[2] WOOLF C J.Pain:moving from symptom control toward mecha⁃nism⁃specific pharmacologic management[J].Ann Intern Med,2004,140(6):441⁃451.
[3] DESCALZI G,IKEGAMI D,USHIJIMA T,et al.Epigenetic mechanisms of chronic pain[J].Trends Neurosci,2015,38(4):237⁃246.
[4] BARTEL D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215⁃233.
[5] 施燕渲,朱涛.miR⁃132在神经病理性疼痛传导通路中的表达[J].实用医学杂志,2017,33(19):3189⁃3192.
[6] HEYN J,LUCHTING B,HINSKE L C,et al.miR⁃124a and miR⁃155 enhance differentiation of regulatory T cells in patients with neuropathic pain[J].J Neuroinflammation,2016,13(1):248.
[7] PENG C,LI L,ZHANG M D,et al.miR⁃183 cluster scales me⁃chanical pain sensitivity by regulating basal and neuropathic pain genes[J].Science,2017,356(6343):1168⁃1171.
[8] LIN C R,CHEN K H,YANG C H,et al.Intrathecal miR⁃183 delivery suppresses mechanical allodynia in mononeuropathic rats.[J].Eur J Neurosci,2014,39(10):1682⁃1689.
[9] SU S,SHAO J,ZHAO Q,et al.MiR⁃30b attenuates neuropath⁃ic pain by regulating voltage⁃gated sodium channel Nav1.3 in rats[J].Front Mol Neurosci,2017,10:126.
[10] SHAO J,CAO J,WANG J,et al.MicroRNA⁃30b regulates ex⁃pression of the sodium channel Nav1.7 in nerve injury⁃induced neuropathic pain in the rat[J].Mol Pain,2016,12:1⁃13.
[11] SAKAI A,SAITOW F,MARUYAMA M,et al.MicroRNA clus⁃ter miR⁃17⁃92 regulates multiple functionally related voltage⁃gat⁃ed potassium channels in chronic neuropathic pain[J].Nat Com⁃mun,2017,8:16079.
[12] LU S,MA S,WANG Y,et al.Mus musculus⁃microRNA⁃449a ameliorates neuropathic pain by decreasing the level of KC⁃NMA1 and TRPA1,and increasing the level of TPTE[J].Mol Med Rep,2017,16(1):353⁃360.
[13] GANDLA J,LOMADA S K,LU J,et al.miR⁃34c⁃5p functions as pronociceptive microRNA in cancer pain by targeting Cav2.3 containing calcium channels[J].Pain,2017,158(9):1765⁃1779.
[14] BALI K K,SELVARAJ D,SATAGOPAM V P,et al.Genome⁃wide identification and functional analyses of microRNA signa⁃tures associated with cancer pain[J].EMBO Mol Med,2013,5(11):1740⁃1758.
[15] XIE X,MA L,XI K,et al.MicroRNA⁃183 suppresses neuro⁃pathic pain and expression of AMPA receptors by targeting mTOR/VEGF signaling pathway[J].Cell Physiol Biochem,2017,41(1):181⁃192.
[16] ZHOU X,ZHANG C,ZHANG C,et al.MicroRNA⁃182⁃5p reg⁃ulates nerve injury⁃induced nociceptive hypersensitivity by tar⁃geting ephrin type⁃b receptor 1[J].Anesthesiol,2017,126(5):967⁃977.
[17] XIA T,CHU S,CUI Y,et al.The role of NR2B⁃CREB⁃miR212/132⁃CRTC1⁃CREB signal network in pain regulation in vitro and in vivo[J].Anesth Analg,2017,124(6):2045⁃2053.
[18] HOU B,CUI X,LIU Y,et al.Positive feedback regulation be⁃tween microRNA⁃132 and CREB in spinal cord contributes to bone cancer pain in mice[J].Eur J Pain,2016,20(8):1299⁃1308.
[19] LIANG Y,LIU Y,HOU B,et al.CREB⁃regulated transcription coactivator 1 enhances CREB⁃dependent gene expression in spi⁃nal cord to maintain the bone cancer pain in mice[J].Mol Pain,2016,12:1⁃11.
[20] LEINDERS M,UCEYLER N,PRITCHARD R A,et al.In⁃creased miR⁃132⁃3p expression is associated with chronic neuro⁃pathic pain[J].Exp Neurol,2016,283:276⁃286.
[21] HUANG Z Z,WEI J Y,OU⁃YANG H D,et al.mir⁃500⁃mediat⁃ed GAD67 downregulation contributes to neuropathic pain[J].J Neurosci,2016,36(23):6321⁃6331.
[22] DING M,SHEN W,HU Y.The role of miR⁃539 in the anterior cingulate cortex in chronic neuropathic pain[J].Pain Med,2017,18(12):2433⁃2442.
[23] WEI J,WANG J,ZHOU Y,et al.MicroRNA⁃146a contributes to SCI recovery via regulating TRAF6 and IRAK1 expression[J].Biomed Res Int,2016,2016:4013487.
[24] LU Y,CAO D L,JIANG B C,et al.MicroRNA⁃146a⁃5p attenu⁃ates neuropathic pain via suppressing TRAF6 signaling in the spinal cord[J].Brain Behav Immun,2015,49:119⁃129.
[25] TAN Y,YANG J,XIANG K,et al.Suppression of microRNA⁃155 attenuates neuropathic pain by regulating SOCS1 signalling pathway[J].Neurochem Res,2015,40(3):550⁃560.
[26] LIU S,ZHU B,SUN Y,et al.MiR⁃155 modulates the progres⁃sion of neuropathic pain through targeting SGK3[J].Int J Clin Exp Pathol,2015,8(11):14374⁃14382.
[27] ZHANG J,ZHANG H,ZI T.Overexpression of microRNA⁃141 relieves chronic constriction injury⁃induced neuropathic pain via targeting high⁃mobility group box 1[J].Int J Mol Med,2015,36(5):1433⁃1439.
[28] SHEN W S,XU X Q,ZHAI N N,et al.Potential mechanisms of microRNA⁃141⁃3p to alleviate chronic inflammatory pain by downregulation of downstream target gene HMGB1:in vitro and in vivo studies[J].Gene Ther,2017,24(6):353⁃360.
[29] NEUMANN E,HERMANNS H,BARTHEL F,et al.Expres⁃sion changes of microRNA⁃1 and its targets Connexin 43 and brain⁃derived neurotrophic factor in the peripheral nervous sys⁃tem of chronic neuropathic rats[J].Mol Pain,2015,11(1):39.
[30] WANG C,JIANG Q,WANG M,et al.MiR⁃19a targets suppres⁃sor of cytokine signaling 1 to modulate the progression of neuro⁃pathic pain[J].Int J Clin Exp Pathol,2015,8(9):10901 ⁃10907.
[31] XIA L,ZHANG Y,DONG T.Inhibition of MicroRNA⁃221 Alle⁃viates Neuropathic Pain Through Targeting Suppressor of Cyto⁃kine Signaling 1[J].J Mol Neurosci,2016,59(3):411⁃420.
[32] JIANG B C,CAO D L,ZHANG X,et al.CXCL13 drives spinal astrocyte activation and neuropathic pain via CXCR5[J].J Clin Invest,2016,126(2):745⁃761.
[33] CHEN W,GUO S,WANG S.MicroRNA⁃16 Alleviates Inflam⁃matory Pain by Targeting Ras⁃Related Protein 23(RAB23)and Inhibiting p38 MAPK Activation[J].Med Sci Monit,2016,22:3894⁃3901.
[34] INOUE K,SAKUMA E,MORIMOTO H,et al.Serum⁃and glu⁃cocorticoid⁃inducible kinases in microglia[J].Biochem Biophys Res Commun,2016,478(1):53⁃59.
[35] SHIBASAKI M,SASAKI M,MIURA M,et al.Induction of high mobility group box⁃1 in dorsal root ganglion contributes to pain hypersensitivity after peripheral nerve injury[J].Pain,2010,149(3):514⁃521.
[36] NEUMANN E,BRANDENBURGER T,SANTANA⁃VARELA S,et al.MicroRNA⁃1⁃associated effects of neuron⁃specific brain⁃derived neurotrophic factor gene deletion in dorsal root ganglia[J].Mol Cell Neurosci,2016,75:36⁃43.

