胀袋火锅调料中腐败微生物的分离和鉴定
郑世超,孟静,翟清燕,郭颖慧,霍胜楠
(山东省食品药品检验研究院,济南 250101)
火锅,是中国独创的美食,历史悠久。火锅调料是以芝麻酱、腐乳、韭菜花、料酒、特制酱油、小磨香油、增鲜剂和一些营养价值较高的当归、人参、大枣、桂圆等,按一定比例混合配制加工制成的,其中富含人体所必需的氨基酸、糖类、维生素等多种营养物质,具有丰富的营养价值[1]。由于火锅调料原料种类繁多,故其生产车间环境中的微生物繁杂,若是杀菌和灌装环境等控制不好,将导致调料遭受二次污染,在货架期内产生“胀袋”现象。此外,在存储运输过程中也容易出现微生物大量滋生而引起的腐败变质问题,这不仅会影响食用的口感,更会威胁人体的健康,同时又带来了不小的经济损失,因此食品的防腐就显得至关重要[2-4]。我们采用形态学、生理生化特征鉴定、16S rDNA序列分子鉴定和系统发育树分析,对某品牌胀袋火锅调料产品的腐败微生物进行初步分析,以期为其质量控制提供参考依据。
1 材料与方法
1.1 材料
某品牌胀袋火锅调料。
1.2 培养基
营养琼脂(NA)培养基:蛋白胨10.0 g/L,牛肉膏粉3.0 g/L,氯化钠5.0 g/L,琼脂20.0 g/L,pH (7.3±0.2),加热融化后于121 ℃灭菌20 min。
淀粉酶检测培养基:蛋白胨10.0 g/L,牛肉膏3.0 g/L,氯化钠5.0 g/L,可溶性淀粉20.0 g/L,琼脂20.0 g/L,pH 7.4~7.6,加热融化后于121 ℃灭菌20 min。
蛋白酶检测培养基:蛋白胨10.0 g/L,牛肉膏3.0 g/L,氯化钠5.0 g/L,干酪素10.0 g/L,琼脂20.0 g/L,pH 7.4 ~7.6,加热融化后于121 ℃灭菌20 min。
1.3 试剂
细菌基因组提取试剂盒:购于杭州博日科技有限公司(BIOER);dNTPs,Taq DNA聚合酶及其缓冲液,DNA Marker,RNase A:均购于大连宝生物有限公司;引物:由上海博尚生物技术有限公司合成。
1.4 仪器
SPL-250生化培养箱 天津莱玻特瑞公司;Base梯度PCR仪 美国ABI公司;NanoDrop 2000c紫外可见分光光度计、ST40 台式离心机 美国赛默飞世尔公司;Comfort恒温混匀器 德国艾本德公司;MS204S 电子天平 梅特勒公司;Qiaxecl Advanced毛细管电泳仪 德国凯杰公司;10009000抑菌圈测量仪 西班牙IUL公司;MLS-3781L高压蒸气灭菌锅 日本三洋公司;BX53F-SZX7显微成像系统 日本奥林巴斯公司。
1.5 实验方法
1.5.1 腐败微生物的分离与纯化
称取25 g样品置于盛有225 mL磷酸盐缓冲液的无菌均质袋内,8000 r/min均质2 min,制成1∶10的样品匀液。用1 mL枪头吸取1∶10样品匀液1 mL,沿管壁缓慢注入盛有9 mL稀释液的无菌试管中,振摇试管使其混合均匀,制成1∶100的样品匀液。上述操作,制备10倍系列稀释样品匀液。每递增稀释1次,换用1次1 mL枪头。选择10-1,10-2,10-33个稀释度的样品匀液,吸取1 mL样品匀液涂布营养琼脂平板,37 ℃培养48 h。同时,分别吸取1 mL空白稀释液涂布于2个营养琼脂平板作空白对照。挑选不同形态的菌落,用营养琼脂平板划线培养,获得单菌落。将涂布培养好的平板,挑取单菌落少许于营养琼脂斜面培养基上,37 ℃培养48 h,待长出菌苔后,进行镜检,且不断进行分离纯化,直至获得纯培养。
1.5.2 形态学观察
将待试验的菌株接种在营养琼脂固体培养基上,37 ℃条件下培养48 h,观察并记录菌落形态、颜色、透明度、边缘是否整齐等。挑取纯培养的单个菌落,进行革兰氏染色、芽孢染色镜检。
1.5.3 产酶活性的检测
采用平板透明圈法。将筛选纯化的菌株分别点种于淀粉酶选择培养基平板和蛋白酶选择培养基平板上,设置3个平行,37 ℃培养24 h,滴加卢戈氏碘液,显色后观察平板透明圈的有无及大小,测定其水解透明圈直径(H)与菌落直径(C),计算H/C值,用来表示菌株产酶活力[5]。
1.5.4 生理生化鉴定
挑取纯培养的单个菌落进行鉴定,分别进行接触酶、葡萄糖利用、甘露醇产酸、阿拉伯糖产酸、柠檬酸盐利用、水解淀粉、明胶液化、吲哚实验、厌氧生长、耐盐实验等生理生化实验鉴定。按《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》进行初步鉴定[6,7]。
1.5.5 基因组DNA的提取和16S rDNA序列扩增
1.5.5.1 基因组DNA的提取
收集细菌,取0.5~4 mL细菌,13.000 g离心1 min,弃上清;加入100 μL EL Buffer,使用枪头吹打均匀,37 ℃温育10~60 min;加入100 μL RS Buffer,随后分别加入10 μL PK Solution,充分混匀,加入2 μL RNase A(20 mg/mL)并混匀;于56 ℃环境中温浴15 min,然后移出;加 200 μL GA Buffer 并混合均匀;于13.000 g 离心1 min;将上清液转移到一个新的1.5 mL离心管中,加 400 μL的Buffer BA,并混合均匀;将混合液体转移至Spin column,于13.000 g离心1 min,并弃去接液管中液体;向 Spin column中加入500 μL的G Binding Buffer,于10.000 g离心1 min,并弃去接液管中液体;向Spin column中加入500 μL的Wash Buffer,于10.000 g 离心1 min,并弃去接液管中液体,重复上述步骤;再次将Spin column于10.000 g离心1 min,并将Spin column转移至一个新的1.5 mL离心管中;向 Spin column 中加入100 μL Elution Buffer,并于室温温育1 min;于10.000 g 离心1 min,并弃去Spin column。
1.5.5.2 16S rDNA序列扩增
16S rDNA PCR扩增的正向引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3',反向引物为1492R:5'-TACGGCTACCTTGTTACGACTT-3'。PCR扩增25 μL反应体系:PCR反应体系为起始引物(10 μmol/L) 1 μL,终止引物(10 μmol/L)1 μL,模板基因组DNA 2 μL,Taq酶12.5 μL,加无菌双蒸水调整反应总体系体积为25 μL。反应条件为95 ℃变性5 min;95 ℃变性30 s,54 ℃退火30 s, 72 ℃延伸2 min,共进行40次循环,72 ℃延伸7 min,4 ℃保温。PCR产物经琼脂糖凝胶电泳检测,将PCR产物送至上海博尚生物技术有限公司测序。测序结果在NCBI网站上进行BLAST比对,确定菌株的种属性质,利于MEGA 6.06构造系统发育树,讨论这3种菌与其他细菌之间的亲缘关系[8]。
2 结果和分析
2.1 菌株分离及形态学观察
通过1.5.1的实验步骤,选取10-2平皿,见图1。通过分离纯化,获得3株腐败微生物菌株,见图2。分别命名为H-1,H-2,H-3,3个菌株在营养琼脂培养基平板上于37 ℃培养48 h,其中,H-1菌落呈白色半透明,光滑湿润,革兰氏染色结果为阳性短杆状细菌,见图3;H-2菌落不透明,干燥,边缘不整齐,扁平,菌落表面有皱褶,革兰氏阳性链杆菌,见图4;H-3菌落较大,圆形,灰白色,表面粗糙不透明,边缘不整齐,革兰氏阳性杆菌,见图5。3株菌通过芽孢染色,均有芽孢。
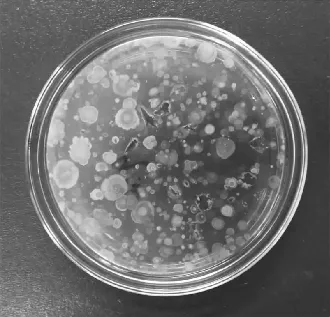
图1 微生物在NA培养基上的特征Fig.1 Characteristics of microorganisms on NA medium

图2 分纯后菌株在NA斜面上的特征Fig.2 Characteristics of pure strains on NA slope
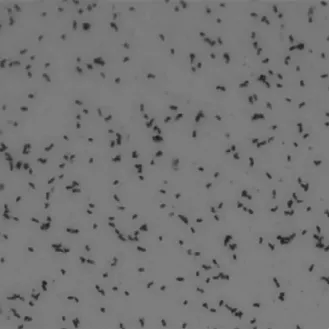
图3 菌株H-1的显微形态特征Fig.3 Microscopic morphological characteristics of strain H-1
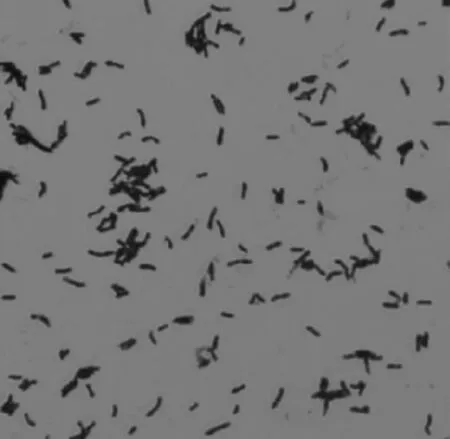
图4 菌株H-2的显微形态特征Fig.4 Microscopic morphological characteristics of strain H-2
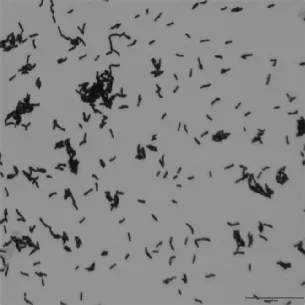
图5 菌株H-3的显微形态特征Fig.5 Microscopic morphological characteristics of strain H-3
2.2 生理生化鉴定
按照芽孢杆菌的生理生化鉴定实验要求[9-12],这3个菌株的生理生化结果见表1。
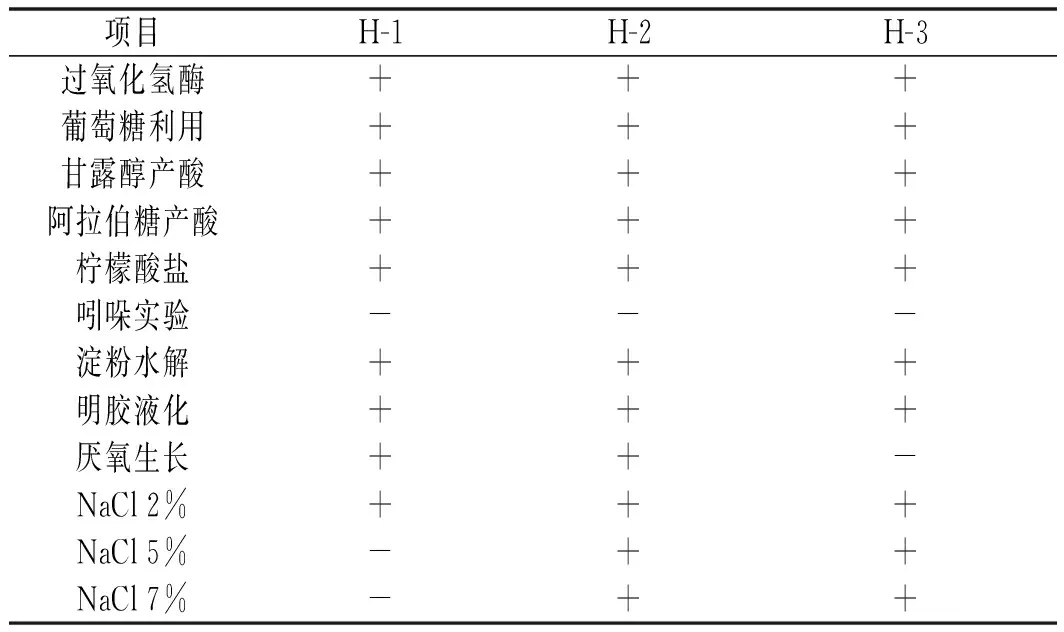
表1 菌株的生理生化实验Table 1 Physiological and biochemical test for the strains
注:“+”为阳性,“-”为阴性。
2.3 16S rDNA鉴定及系统发育树构建
3种菌株经PCR测序获得16S rDNA序列(约1.4 kb),见图6。DNA测序序列见表2~表4,根据表2~表4对H-1的序列进行BLAST分析,得到同源序列,用CLUSTAL×2.0 program对序列进行比对,进一步使用MEGA 6.06软件构建系统发育树,进化树的构建选用Neighbor-Joining(NJ)方法,bootstrap replicates检测值为1000,见图 7。
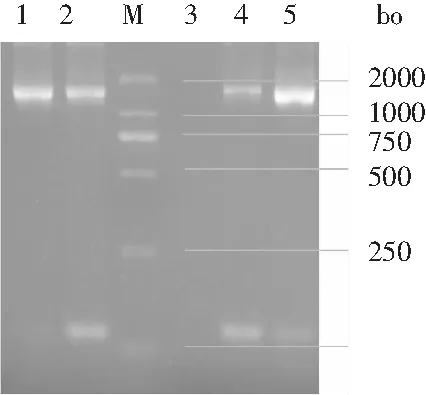
图6 H-1,H-2,H-3 16S rDNA PCR扩增电泳图Fig.6 H-1, H-2, H-3 16S rDNA PCR amplified electrophoresis
注:1为H-1;2为H-2;3为空白对照;4为H-3;5为阳性对照。

图7 基于H-1 16S rDNA序列构建的菌株系统发育树Fig.7 The strain's phylogenetic tree based on H-1 16S rDNA sequence
由图7可知,H-1菌株属于芽孢杆菌分支,与解淀粉酶芽胞杆菌BacillusamyloliquefaciensSRCM101267 最接近,与该菌株的同源性达100%。因此,综合生理生化实验鉴定结果和分子鉴定结果,可鉴定H-1菌株为解淀粉芽孢杆菌。菌株H-1 16S rDNA测序结果见表2。

表2 菌株H-1 16S rDNA测序结果Table 2 Sequencing results of strain H-1 16S rDNA
对H-2的序列进行BLAST分析,得到同源序列,用CLUSTAL×2.0 program对序列进行比对,进一步使用MEGA 6.06软件构建系统发育树,进化树的构建选用 Neighbor-Joining(NJ)方法, bootstrap replicates检测值为1000,见图8。

图8 基于H-2 16S rDNA序列构建的菌株系统发育树Fig.8 The strain's phylogenetic tree based on H-2 16S rDNA sequence
由图8可知,H-2菌株属于地衣芽孢杆菌Bacilluslicheniformis的分支,与该地衣芽孢杆菌中的其他菌株同源性达99%。因此,综合生理生化实验鉴定结果和分子鉴定结果,可鉴定H-2菌株为地衣芽孢杆菌,菌株H-2 16S rDNA测序结果见表3。

表3 菌株H-2 16S rDNA测序结果Table 3 Sequencing results of strain H-2 16S rDNA
对H-3的序列进行BLAST分析,得到同源序列,用CLUSTAL×2.0 program对序列进行比对,进一步使用MEGA 6.06软件构建系统发育树,进化树的构建选用 Neighbor-Joining(NJ)方法, bootstrap replicates检测值为1000,见图9 。

图9 基于H-3 16S rDNA序列构建的菌株系统发育树Fig.9 The strain's phylogenetic tree based on H-3 16S rDNA sequence
由图9可知,H-3菌株属于枯草芽孢杆菌Bacillus的分支,与枯草芽孢杆菌中的Bacillussubtilisstrain 6B8 (KR611046.1)和Bacillussubtilisstrain 2C-62 (KR061403.1)同源性达100%。因此,综合生理生化实验鉴定结果和分子鉴定结果,可鉴定H-3菌株为枯草芽孢杆菌。淀粉酶、蛋白酶活力测定实验结果见表4。
表4 菌株H-3 16S rDNA测序结果Table 4 Sequencing results of strain H-3 16S rDNA
2.4 产酶活性检测
利用平板透明圈法进行产酶实验,3个菌株产淀粉酶、蛋白酶透明圈大小结果,见表5。表明H-1和H-2具有较强的产淀粉酶和蛋白酶活力,H-3产蛋白酶活力较高,而产淀粉酶活力一般。
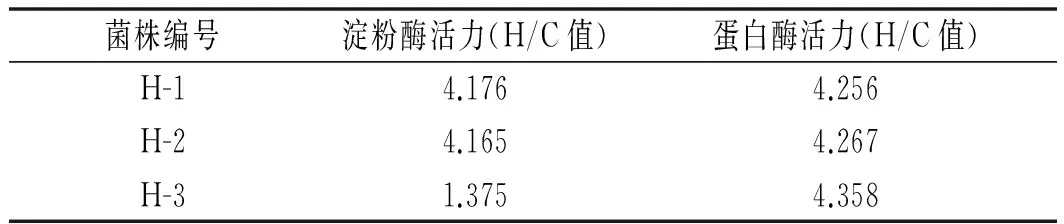
表5 淀粉酶、蛋白酶活力测定实验结果Table 5 The experimental results of amylase and protease activity
3 结果与讨论
该火锅调料在适宜温度下贮存,在保质期内发生鼓胀变质,经形态检验、生理生化反应、16S rDNA序列分子鉴定和系统发育树分析,确定3株腐败微生物分别为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、地衣芽孢杆菌(Bacilluslicheniformis)和枯草芽孢杆菌(Bacillussubtilis)。
芽孢杆菌是一类好氧微生物,具有抗逆性强、营养需求低、复活率高等特点,其生长速度快,可以产多种酶类,但是其耐热性强,若是后期含量很高,会对杀菌带来一定困难。芽孢杆菌的安全性问题一直是人们关注的问题。近年来,芽孢杆菌引起水产动物腐皮病、败血症等病害的相继报道也进一步说明了芽孢杆菌对机体存在致病的威胁[13-18]。
由于调味品中成分复杂,加工工艺中加入了较多的辅料,可能引入不同的细菌,采用80 ℃灭菌10~20 min的方法因传热不均匀,虽能杀死大部分酵母和霉菌,但是一些耐高温的芽孢菌仍能生存,使调味品腐败变质,本文研究的调味品中分离的腐败微生物大多为芽孢杆菌属,说明芽孢杆菌属为优势菌属,这是影响保质期产品质量的主要污染源,导致火锅调料受二次污染及产品质量发生变质后的产品则表现为胀袋,给储存和销售带来不利影响。所以,为保持火锅调料鲜香的风味,在成品调料不灭菌的情况下首先进行生产环境灭菌,即在生产过程中要保证与产品接触的人员、器皿、环境均保持无微生物污染;针对不同微生物,使用不同的灭菌方法[19-21]。此外,把握包装时环境和操作的控制,包装时要保证包装机器和操作都是无菌操作。本研究对胀袋火锅调料进行分析,得到能引起变质的腐败微生物,为灭菌工艺的改善,保质期的延长提供了参考依据。
参考文献:
[1]吴建勤.火锅及其调料与佐料[J].中国调味品,1992(3):8-9.
[2]谢婷婷,王应妮,陈秋骏,等.胀袋鲍汁中腐败菌的分离与鉴定[J].中国调味品,2015,40(5):27-29.
[3]李婷,张小丽,蒋予箭.胀袋酱油中产气微生物来源的调查[J].食品与发酵工业,2016,42(8):97-102.
[4]高鹏,伏毅,陈谦,等.真空包装肘花胀袋微生物的鉴定及验证[J].湖北农业科学,2016,55(13):3434-3438.
[5]张国庆,董晓芳,佟建明,等.一株产淀粉酶、蛋白酶益生芽孢杆菌的分离与鉴定[J].中国饲料,2010(18):13-15.
[6]布坎南 R E,吉本斯 N E.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984:740-772.
[7]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8]曹凤明,杨小红,马鸣超,等.枯草芽孢杆菌近缘种群鉴定方法研究进展[J].微生物学通报,2014,41(5):968-974.
[9]葛文霞,柳旭伟.地衣芽孢杆菌在养殖业中的应用研究进展[J].上海畜牧兽医通讯,2014(1):17-19.
[10]关晓欢,姜华.解淀粉芽孢杆菌研究进展[J].生物技术世界,2013(1):4-9.
[11]车晓曦,李校堃.解淀粉芽孢杆菌(Bacillusamyloliquefaciens)的研究进展[J].北京农业,2010(3):7-10.
[12]惠明,窦丽娜,田青,等.枯草芽孢杆菌的应用研究进展[J].安徽农业科学,2008,36(27):11623-11627.
[13]施伟达,章文敏,周冬仁,等.芽孢杆菌研究进展及其在水产养殖中的应用[J].现代农业科技,2012(2):310-317.
[14]翟继鹏,张金枝.枯草芽孢杆菌在养殖业中的应用研究进展[J].浙江畜牧兽医,2010,35(3):7-9.
[15]黄曦,许兰兰,黄荣韶,等.枯草芽孢杆菌在抑制植物病原菌中的研究进展[J].生物技术通报,2010(1):24-29.
[16]张新雄,彭锋,毛光平,等.饲用芽孢杆菌研究与应用进展[J].应用与环境生物学报,2013,19(5):891-897.
[17]刘国红,林乃铨,林营志,等.芽孢杆菌分类与应用研究进展[J].福建农业学报,2008(1):92-99.
[18]唐娟,张毅,李雷雷,等.地衣芽孢杆菌应用研究进展[J].湖北农业科学,2008(3):351-354.
[19]丁相军.软包装肉类食品胀袋原因分析[J].肉类工业,2010(5):10-11.
[20]刘井权,郑喜群,柴华,等.防止大豆酱胀袋、产白膜、酸度超标的方法[J].中国调味品,2010,35(1):71-73.
[21]王瑞芝.控制大酱胀袋的探讨[J].中国酿造,2008,186(9):110-112.

