一种细菌红色素的稳定性及结构的初步研究
边名鸿,傅彬,左勇,叶碧霞,杨小龙,张晶
(四川理工学院 生物工程学院,四川 自贡 643000)
近年来,食品安全事件频发,消费者的食品安全感也越来越低,甚至导致公众严重的心理恐慌[1]。合成色素的违规添加是造成食品安全问题的重要因素之一,而色调自然、安全性高且具有较高生理及药理作用的天然色素[2-6],正逐渐受到人们的青睐。在欧洲等发达国家的食用色素中,天然色素已占有85%以上的份额,而我国每年生产的食用色素中90%为天然色素[7]。目前,国际市场上天然色素的销售额正在以10%的速度增长,市场需求巨大,且需求量逐年上升,各国争相开发生产,然而目前我国天然食用色素的开发生产远不能满足现代化工业发展的需要[8],研究开发天然色素有着广阔的市场前景。
一直以来,天然色素主要以植物色素为主,但其原料受季节、气候、产地等因素的限制,且成本较高、质量不易控制等因素导致植物色素的产量及市场应用受到制约。而微生物色素能很好地克服植物色素的上述缺点,且已有成功先例[9]。微生物色素的生产将是解决植物色素产量低、成本高的有效途径[10]。
与合成色素相比,大多数天然色素的稳定性较差,容易受到光照、温度、金属离子、氧化剂等因素的影响而导致其褪色,这是天然色素的应用受到阻碍的重要原因之一[11,12]。色素结构及官能团的改变是导致其褪色的主要因素,探究色素结构,对阐明色素褪色原理、指导护色研究有着重要意义。
本文对一种细菌红色素的稳定性及结构进行初步研究,探究pH、温度、光照、金属离子、氧化剂、还原剂、常用食品添加剂等对该红色素稳定性的影响,并对该红色素官能团及分子量等进行研究,以期为该红色素的进一步研究提供一定的理论依据。
1 材料及仪器
1.1 菌株
类芽孢杆菌(PaenibacillusagaridevoransXF-105):保藏于中国典型培养物保藏中心,保藏号为CCTCC M2014644。
1.2 主要仪器
PHS-3C酸度计 奥豪斯仪器(上海)有限公司;HLMJ-250恒温恒湿箱 上海雷韵试验仪器制造有限公司;T6新世纪紫外可见分光光度计 上海分析仪器总厂;TG-16台式高速离心机 四川蜀科仪器有限公司;NICOLET 6700傅立叶变换红外光谱仪 美国Thermo Scientific公司;LC1100/MSD-VL液相色谱-质谱联用仪 美国Agilent公司。
1.3 实验方法
1.3.1 红色素粗品的制备
1.3.1.1 产红色素菌株的培养
种子液的制备:从斜面上挑取2环菌体,接种到装液量为100 mL/250 mL的种子培养基中(12层纱布盖封口),28 ℃,150 r/min条件下摇床培养24 h。
发酵液的制备:按照2%(V/V)的接种量将种子液接种到装液量为100 mL/250 mL的发酵培养基中(12层纱布盖封口),调节初始pH为7.0,28 ℃,150 r/min条件下摇床培养48 h。
1.3.1.2 红色素的提取
移取40 mL发酵液到50 mL离心管中,10000 r/min离心10 min,收集菌体。以固液比为1∶10(W/V)的比例加入95%乙醇,50 ℃水浴2 h,10000 r/min离心,弃沉淀,得到红色素乙醇溶液。
利用旋转蒸发仪浓缩红色素乙醇溶液,自然凉干后即得到红色素粗品。
1.3.2 红色素的溶解性测定
各取10 mL乙酸乙酯、氯仿、二氯甲烷、石油醚、丙酮、乙醇、甲醇、去离子水、正丁醇,分别加入0.01 g的红色素粗品。静置3 h,10000 r/min离心10 min后弃沉淀,观察红色素的溶解情况。
1.3.3 红色素最大吸收波长扫描
取适宜浓度的红色素乙醇溶液,用紫外-可见分光光度计对其进行光谱扫描,以无水乙醇为空白对照,扫描波长范围为200~800 nm,确定其最大吸收波长。
1.3.4 温度对红色素稳定性的影响
各取10 mL适宜浓度的红色素乙醇溶液置于试管中,将试管分别置于4,30,40,60,80,100 ℃水浴,每2 h测定1次吸光度。
1.3.5 pH对红色素稳定性的影响
各取10 mL适宜浓度的红色素乙醇溶液置于试管中,用2 mol/L的HCl和NaOH溶液调节pH分别为3,4,5,6,7,8,9,10,11,12。避光静置3 h后,测定其吸光度并观察颜色变化。
1.3.6 光照对红色素稳定性的影响
各取10 mL适宜浓度的红色素乙醇溶液置于试管中,分别置于室内、室外及紫外光照环境下,每隔一段时间测定样品吸光度。
1.3.7 常用酸对红色素稳定性的影响
各取10 mL适宜浓度的红色素乙醇溶液置于试管中,分别按照浓度为0.5,1.0,1.5,2.0,2.5 g/L的量添加苹果酸和柠檬酸。避光静置3 h后,测定其吸光度。
1.3.8 氧化剂对红色素稳定性的影响
称取一定量红色素粗品,配制成母液,分别移取1 mL母液到10 mL容量瓶中,分别按照浓度为1%,2%,3%,4%,5%的量添加H2O2(浓度为30%),以95%乙醇定容。避光静置3 h后,测定其吸光度。
1.3.9 还原剂对红色素稳定性的影响
各取10 mL适宜浓度的红色素乙醇溶液置于试管中,分别按照浓度为0.5,1.0,1.5,2.0,2.5 g/L的量添加Na2SO3和抗坏血酸。避光静置3 h后,测定其吸光度。
1.3.10 常用食品添加剂对红色素稳定性的影响
各取10 mL适宜浓度的红色素乙醇溶液置于试管中,分别按照浓度为1,2,3,4,5 g/dL的量添加葡萄糖、蔗糖及苯甲酸钠,避光静置24 h后,测定其吸光度。
1.3.11 金属离子对红色素稳定性的影响
各取10 mL适宜浓度的红色素乙醇溶液到试管中,分别加入BaCl2,LiCl,FeSO4,CaCl2,MnCl2,MgSO4,KCl,NaCl,使其浓度分别为0.1,0.2,0.3,0.4,0.5 g/L。避光静置3 h后,测定其吸光度。
1.3.12 红色素的分离及纯化
大孔树脂的预处理(X-5型):称取5 g大孔树脂(X-5型),采用2倍体积95%乙醇浸泡24 h,后用去离子水洗涤至流出液不浑浊且无异味。
利用柱层析对红色素进行分离纯化。以X-5型大孔树脂为固定相,采用乙酸乙酯-乙醇混合溶液洗脱(乙醇∶乙酸乙酯为1∶1),层析柱口径与柱长比为1∶40(V/V),上样条件参照文献[13]进行。洗脱液经旋转蒸发浓缩后,放置在通风橱自然干燥。
1.3.13 硅胶薄层层析
取2块硅胶薄层层析板(5 cm×10 cm),放置在烘箱中105 ℃,活化30 min,取出后放置在干燥皿中自然冷却后,用2B铅笔分别在距离两端1 cm处画2条直线(中间间隔8 cm)。
将1.3.12分离后的得到的红色素溶液点样在活化后的硅胶薄层层析板上(其中一条直线上),以不同层析液展开,观察有色条带情况,分析纯化后的红色素有色组分。
1.3.14 红外光谱扫描
将上述1.3.12分离后得到的红色素溶液干燥后,用无水乙醇重新溶解并送至四川理工学院分析测试中心进行红外光谱扫描,扫描范围为4000~400 cm-1。
1.3.15 红色素质谱检测
将薄层层析(1.3.13中)后的红色素从层析板上刮下,用甲醇溶液溶解,经0.45 μm微孔滤膜过滤后送至四川理工学院分析测试中心经高效液相色谱进一步纯化后进行质谱检测。
分析柱流动相甲醇∶水为4∶1,流速为1 mL/min;进样量为10 μL;柱温为35 ℃。紫外检测波长为503 nm。质谱条件:质谱采用ESI-MS对红色素进行检测,质量数扫描范围110~1000,离子化模式:负态ES,毛细管电压:3.0 kV;离子源温度:120 ℃;锥孔电压:30 V;碰撞能:3 V。
2 结果及分析
2.1 红色素的溶解性
取0.01 g红色素粗品,加入10 mL不同溶剂,静置3 h,观察红色素溶解情况,结果见表1。

表1 红色素溶解情况Table 1 The solubility analysis of the red pigment
注:“+”表示可溶,“-”表示不溶或微溶。
由表1可知,该红色素能溶解在乙酸乙酯、氯仿、二氯甲烷、石油醚、丙酮、甲醇、乙醇中,不溶于水以及正丁醇,说明该红色素为脂溶性色素。
2.2 红色素的全波长扫描
利用紫外分光光度计对红色素乙醇溶液进行全波长扫描,扫描结果见图1。

图1 红色素的全波长扫描Fig.1 The full wavelength scanning map of the red pigment
由图1可知,该红色素乙醇溶液在波长为503 nm处有最大吸收峰且没有其他明显的吸收峰。说明该红色素在乙醇溶液中的最大吸收波长为503 nm。
2.3 温度对红色素稳定性的影响
将相同浓度的红色素乙醇溶液置于不同温度条件下,探究温度对红色素稳定性的影响,试验结果见图2。
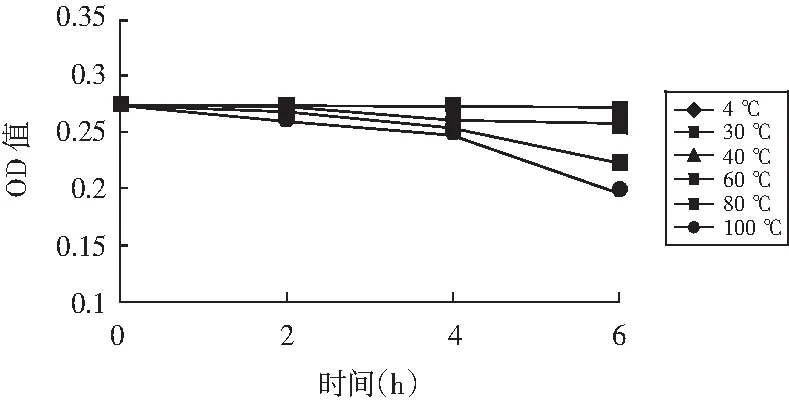
图2 温度对红色素稳定性的影响Fig.2 Effect of the temperature on the stability of the red pigment
由图2可知,在设定温度下4 h内该红色素都表现出较好的稳定性;80,100 ℃温度下,超过4 h后,OD值下降较为明显,但颜色变化较小。说明该红色素在较高的温度环境下,短时间内其稳定性较好,随着时间的延长,红色素稳定性也逐渐降低。
2.4 pH对红色素稳定性的影响
将不同pH的红色素乙醇溶液避光静置3 h后测定其OD503并观察其颜色变化情况,探究pH对红色素稳定性的影响,结果见表2。
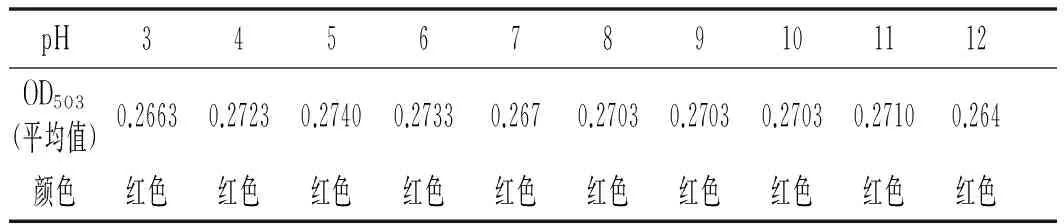
表2 pH对红色素稳定性的影响Table 2 Effect of the pH on the stability of the red pigment
由表2可知,当pH在3~12范围内红色素乙醇溶液的OD503均差异不大,且肉眼观察红色素颜色也无明显变化。说明pH对该红色素稳定性的影响较小,该红色素在酸性、中性及碱性环境下均保持良好的稳定性。
2.5 光照对红色素稳定性的影响
将浓度相同的红色素乙醇溶液放置在室内、室外自然光及紫外光照射环境下处理,以探究不同光照对红色素稳定性的影响,结果见图3。

图3 日光及紫外照射对红色素稳定性的影响Fig.3 Effect of sunshine and UV irradiation on the stabilityof the red pigment
由图3可知,在室外强光照射下红色素的稳定性最差,照射2 h红色素几乎完全褪色。紫外光照射8 h,红色素的损失率达到了62.18%,在室内散射光照射下,该红色素的OD503变化不大。说明该红色素对自然散射光照稳定性较好,而对强自然光及紫外光照稳定性较差,可能是因为短波长光对红色素结构的破坏作用较大,该红色素不适宜在强光环境下使用。
2.6 常用酸对红色素稳定性的影响
将含有不同浓度的苹果酸和柠檬酸的红色素乙醇溶液,避光静置3 h后测定OD503,以探究常用酸对红色素稳定性的影响,试验结果见图4。

图4 常用酸对红色素稳定性的影响Fig.4 Effect of the acid on the stability of the red pigment
由图4可知,随着苹果酸浓度的增加,红色素的OD503逐渐降低,柠檬酸浓度越高,红色素的OD503反而越大,但红色素的OD503变化均不大。说明该红色素对上述2种酸的稳定性较好,且苹果酸对红色素有一定的破坏作用,柠檬酸对该红色素有一定的护色作用。
2.7 氧化剂对红色素稳定性的影响
以H2O2为氧化剂,调节红色素乙醇溶液H2O2浓度,避光静置3 h,测定红色素乙醇溶液的OD503,以研究氧化剂对红色素稳定性的影响,试验结果见图5。
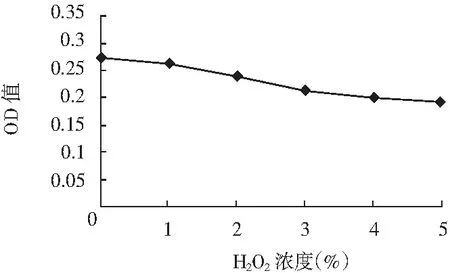
图5 氧化剂对红色素稳定性的影响Fig.5 Effect of the oxidant on the stability of the red pigment
由图5可知,随着H2O2浓度的增加,红色素乙醇溶液的OD503缓慢降低,且肉眼观察红色素溶液颜色差异不大,说明H2O2对红色素稳定性的影响较小,该红色素对氧化剂较稳定。
2.8 还原剂对红色素稳定性的影响
将含有不同浓度抗坏血酸和亚硫酸钠的红色素乙醇溶液避光静置3 h后测定OD503,以探究还原剂对红色素稳定性的影响,试验结果见图6。

图6 还原剂对红色素稳定性的影响Fig.6 Effect of the reducing agent on the stability of the red pigment
由图6可知,与空白比较,还原剂的添加对红色素的稳定性有一定影响,且随着还原剂浓度的增加,红色素的OD503有小幅度的下降,但肉眼观察红色素乙醇溶液的颜色没有明显变化。说明该红色素对抗坏血酸和亚硫酸钠均较稳定。
2.9 常用食品添加剂对红色素稳定性的影响
将含有不同浓度葡萄糖、蔗糖、苯甲酸钠的红色素乙醇溶液避光静置24 h后测定OD503,以探究常有食品添加剂对红色素稳定性的影响,试验结果见图7。

图7 常用食品添加剂对红色素稳定性的影响Fig.7 Effect of the food additives on the stability of the red pigment
由图7可知,随着食品添加剂浓度的增加,红色素OD503均有小幅度的下降趋势,肉眼观察红色素乙醇溶液颜色无明显变化,当苯甲酸钠浓度高于0.4 g/dL时,红色素的OD503变化较明显。说明该红色素对蔗糖、葡萄糖以及苯甲酸钠的稳定性均较好,能够与上述食品添加剂混合使用。
2.10 金属离子对红色素稳定性的影响
将含有不同浓度各金属盐的红色素乙醇溶液避光静置3 h,然后测定其OD503以探究金属离子对红色素稳定性的影响,试验结果见图8。

图8 金属离子对红色素稳定性的影响Fig.8 Effect of the metal ions on the stability of the red pigment
由图8可知,随着金属离子浓度的增加,色素吸光值都有不同程度的下降,其中Mg2+,K+,Na+对红色素吸光值基本没有影响,Mn2+,Ca2+,Ba2+,Fe2+等重金属离子对红色素都有不同程度的消色作用。其中Fe2+离子浓度低于0.3 g/L时,对红色素稳定性的影响不大,但当其浓度高于0.3 g/L时,红色素的OD503下降较快,且肉眼观察红色素乙醇溶液颜色变浅。可能是因为Fe2+有较强的还原性,导致红色素的部分结构被还原,从而导致红色素褪色。
2.11 TLC结果
将红色素乙醇溶液点样在硅胶薄层层析板上,以不同层析液展开,试验结果见表3和图9。

表3 薄层层析部分展开结果Table 3 TLC partially expanded results

图9 红色素的成分分离图Fig.9 Composition separation diagram of red pigment
以二氯甲烷∶乙酸乙酯∶乙醇为1∶1∶1为层析液,展开距离7.6 cm(总距离为8 cm),Rf约为0.95,展开距离较大。以二氯甲烷∶乙酸乙酯为1∶1为层析液,展开距离为5.7 cm,Rf约为0.71,展开距离合适。由图9可知,采用不同的层析液红色素均有一条红色条带,说明经纯化后的红色素成分较单一。
2.12 红外光谱扫描
将纯化后的红色素,用乙醇溶解后,利用红外光谱进行扫描,试验结果见图10。

图10 红色素的红外光谱图Fig.10 Infrared spectrogram of red pigment

2.13 红色素质谱分析
纯化后的红色素甲醇溶液,经高效液相色谱进一步纯化后,采用质谱检测其分子量,试验结果见图11。

图11 红色素的质谱图Fig.11 Mass spectrum of red pigment
细菌红色素的负离子模式质谱图显示[M-H]=339.1的准分子离子峰,确定其相对分子质量为340.1。
3 结论

参考文献:
[1]王静,孙宝国.食品添加剂与食品安全[J].科学通报,2013,58(26):2619-2625.
[2]Chen Deming,Han Yonbin,Gu Zhenxin,et al.Application of statistical methodology to the optimization of fermentative medium for carotenoids production byRhodobactersphaeroides[J].Process Biochemistry,2006,41:1773-1778.
[3]Chih-Hsiang Changa,Chi-Kang Tsaia,Tzu-Tai Leeb,et al.Targeted delivery of biosynthetic lycopene by the bacterial carrier[J].Journal of the Taiwan Institute of Chemical Engineers,2016,59:91-97.
[4]Giovannucci E.Tomatoes,tomato-based products,lycopene,and cancer: review of the epidemiologic literature[J].J Natl Cancer Inst,1999,91:317.
[5]张锐.红曲霉液态发酵生产红曲色素的工艺优化[J].生物技术通报,2015,31(2):187-195.
[6]Rodrigues A L,Trachtmann N,Becker J,et a1.Systems metabolic engineering ofEscherichiacolifor production of the antitumor drugs violacein and deoxyviolacein[J].Metabolic Engineering,2013,20(5):493-498.
[7]苗璇.食用天然色素研究应用现状及其发展前景展望[J].化工管理,2013(5):5-9.
[8]吕帮玉,杨新河,毛清黎,等.我国天然食用色素的开发现状与前景[J].江西农业学报,2007,19(10):108-110.
[9]Feng Yanli,Shao Yanchun,Chen Fusheng,et al.Monascuspigments[J].Appl Microbiol Biotechnol,2012,96:1421-1440.
[10]Dufossé L.Microbial production of food grade pigments[J].Food Technology and Biotechnology,2006,44:313-321.
[11]Onur Güneser.Pigment and color stability of beetroot betalains in cow milk during thermal treatment[J].Food Chemistry,2016,196:220-227.
[12]牛世全,韩彩虹,胡蛟龙,等.一株产蓝色素放线菌的分离、鉴定及其色素稳定性初步研究[J].食品工业科技,2016,37(1):134-137.
[13]范碧琴,杜静君,赵桃,等.大孔树脂分离纯化洛神花花色苷的研究[J].食品工业科技,2015(1):220-225.
[14]王昌禄,郑传宝,陈勉华,等.产粉红色素红曲霉M4菌株发酵培养基的优化[J].氨基酸和生物资源,2010,32(2):26-29.

