水分胁迫对不同基因型苦荞苗期根系生理特性及产量的影响
路之娟,张永清,2,张 楚,刘丽琴
(1.山西师范大学生命科学学院, 山西 临汾 041004; 2.山西师范大学城市与环境科学学院, 山西 临汾 041004)
随着人们生活需求由温饱型向营养型乃至保健型的转化,苦荞的“三降一疗两通”食疗营养功能日益受到消费者的青睐[1-2]。苦荞为蓼科(Polygonaceae)双子叶植物,起源于我国西南部,是我国一种古老的杂粮作物。其含有丰富的矿物质、维生素、脂肪、蛋白质和人体所需的微量元素[3-5],更具备其他植物所不具有的黄酮类化合物,使其药食兼用的作用更为突出,因此常被称为“五谷之王”、“三降食品”。苦荞生育期短,耐冷凉、耐瘠薄、适应性强,在黄土高原地区具有明显的区位优势和生产优势,是当地特色农业发展的重要杂粮作物。
相关研究表明,全球因水源匮乏而导致的减产超过了其他自然灾害造成减产数量的总和[6]。山西素有“十年九旱”之说,干旱是影响该省农业高产稳产的逆境因素[7]。根系是作物感受土壤干旱的原初部位与敏感部位,其数量大小、分布和生理状况等直接影响着作物抗旱性的强弱,因而研究根系对干旱胁迫的生理生态反应对揭示作物抗旱的本质更有意义[8]。综上可见,研究苦荞根系对水分胁迫的响应,探明其抗旱机理与调控对策,对实现山西黄土高原丘陵区旱地农业可持续发展及保障粮食安全具有重要的理论与实践意义。然而, 由于历史原因, 对苦荞的研究并没有达到其他大宗作物的深度, 现有关于苦荞的研究多集中于种质资源[9-10]、农艺性状[11-12]、药用与营养价值[13-15]、栽培技术[16-17]、养分吸收与施肥的增产作用[18-20]、逆境胁迫对苦荞化学成分及生理方面的影响等方面[21-25],对苦荞的抗逆性机理则研究较少,尤其是关于逆境胁迫对苦荞根系生理特性及产量的影响更是鲜有报道。为此,本试验拟通过研究各基因型苦荞在不同水分条件下的形态生理指标和产量变化规律,比较不同抗旱性品种间的变化差异,探讨不同品种在干旱胁迫下的根系生理响应及产量情况,旨在为黄土高原苦荞抗旱品种的引种、选育及抗旱机制等方面的研究提供理论依据。
1 材料与方法
1.1 试验材料
供试苦荞材料为前期沙培试验筛选的对干旱胁迫敏感程度不同的3个品种:迪庆苦荞(耐旱性品种)、云荞1号(中间型品种)、多元苦荞(敏感型品种)作为试验供试品种,由山西省农业科学院作物科学研究所提供。供试土壤为褐土,地表3 m以下养分含量较低的生土,其养分含量为:有机质2.37 g·kg-1,全氮0.04 g·kg-1,速效磷2.37 mg·kg-1,速效钾92.46 mg·kg-1。供试肥料为分析纯试剂尿素(含N 46%)、过磷酸钙(含P2O515%)和氯化钾(含K2O 52%)。
1.2 试验设计
试验于2016年7—11月在山西师范大学生命科学学院农场防雨棚和实验室内进行。采用上口径29.5 cm、下口径20.5 cm、高26.5 cm的聚乙烯花盆进行盆栽试验,每盆装风干土14 kg。为了保证试验期间幼苗生长不受养分限制,每公斤土壤分别施N 0.2 g、P2O50.3 g、K2O 0.17 g作为肥底,所有肥料均作为基肥一次性施入。试验采用两因素完全随机设计, 因素A为3个不同抗旱性苦荞品种:迪庆苦荞、云荞1号和多元苦荞;因素B为不同水分处理:正常供水(土壤含水量为田间持水量的65%~75% CK) 、中度干旱(土壤含水量为田间持水量的45%~55% MS)和重度干旱(土壤含水量为田间持水量的25%~35% SS),共9个处理组合,且每个处理重复8次。试验实施时,选取籽粒饱满、大小一致、无病虫害的苦荞种子,经0.1%的HgCl2消毒5 min,蒸馏水反复冲洗干净,分别置于呈有清水的小烧杯中浸泡24 h,浸好后按常规方法适时播种,每盆播种15粒,所有盆土等量浇水以保证种子顺利出苗。待两叶一心(2016年7月20日)时间苗,每盆留苗7株,三叶一心(2016年8月5号)时开始分梯度控水。采用称重法控制水分,每天称重1次,对下降到水分指标下限的盆进行定量灌水,使每盆都维持在对应处理的土壤含水量水平。控水期间,如遇雨天加盖塑料薄膜防雨,避免自然降水对试验造成影响。分别于苗期和成熟期各取3次重复测定相应指标。收获取样时,用水浸润盆土,将土壤和苦荞幼苗尽可能完整取出并在水管下冲洗干净,将植株带回实验室测定各指标。
1.3 项目测定方法
1.3.1 形态指标 叶面积用叶面积仪法;株高、最大根长用直接测量法;生物量用烘干后称重法;根系的总长、根总表面积、根体积用英国产Delta-T SCAN根系分析系统测定;叶片相对含水量(RWC)用称重法测定[26];叶绿素含量用分光光度计法测定[26];叶绿素荧光参数用美国Opti2science公司生产的OS52FL调制式叶绿素荧光仪,于取样前一天早上(5∶00—8∶00,弱光环境下)测定第2片三出复叶的叶绿素荧光参数(初始荧光Fo、最大荧光产量Fm)。
1.3.2 生理指标 超氧化物歧化酶(SOD)活性用蓝四唑法测定[26],过氧化物酶(POD)活性用愈创木酚比色法测定[26],丙二醛(MDA)含量用硫代巴比妥酸法测定[26],可溶性糖含量用蒽酮比色法测定[26],可溶性蛋白质含量用考马斯亮蓝G-250染色法测定[26],取平均值,以上指标均重复3次。
1.4 数据分析
用Microsoft Excel 2003和SPSS 19.0软件对试验数据进行处理分析,采用Duncan’s法进行多重比较,用SigmaPlot 10.0作图。
2 结果与分析
2.1 干旱胁迫对苦荞幼苗生理、形态指标的影响
2.1.1 对植株地上部的影响 由表1可知,与正常供水相比,干旱胁迫处理下3 个品种的株高、叶面积、茎粗及地上部干重均有所降低。中度胁迫下,迪庆苦荞、云荞1号、多元苦荞株高分别下降了15%、18%和16%,云荞1号降幅最大;而重度胁迫则分别下降了21%、24%和40%。比较不同品种下降的幅度可以看出,迪庆苦荞降幅最小,多元苦荞降幅最大,各品种不同水分处理间差异均达到显著水平(P<0.05)。在重度胁迫下各品种叶面积间差异也达显著水平(P<0.05)。
不同品种苦荞茎粗的研究表明,在中度和重度胁迫下,迪庆苦荞降低了6%和14%,降幅最小;多元苦荞降幅最大,下降了10%和23%。3个品种在2种胁迫下与正常水分处理相比均达显著差异水平(P<0.05)。中度胁迫下,云荞1号地上部干重降低最大(26%),但重度胁迫下,达到最大降幅的依旧是多元苦荞(55%)。综上可见,水分胁迫对多元苦荞的形态指标影响最大,其次是云荞1号,迪庆苦荞影响最小,表明,迪庆苦荞干旱逆境下,具有更强的适应性,长势更强。

表1 水分胁迫对苦荞苗期地上部植株生长的影响
注:CK,对照;W1,中度胁迫;W2,重度胁迫;DQ,迪庆苦荞;YQ1,云荞1号;DY,多元苦荞;表内数据为平均值±标准误;同列数据后不同字母表示处理间差异达显著水平(P<0.05)。
Notes: CK, Normal irrigation; W1, Moderate water stress; W2, heavy water stress. DQ, Diqing; YQ1, Yunqiao 1; DY, Duoyuan; Values are mean±SE. Different letters in the same column indicate significant difference among treatments at 0.05 level.
2.1.2 对最大根长、根体积、根面积、根冠比的影响 表2显示,在中度胁迫下,各品种主根长呈现不同程度增长,其中迪庆苦荞根为最大值(20.11 cm)。重度胁迫条件下,三个品种显著下降,与对照比较,多元下降了25%,降幅最大。总根体积和总根面积随水分胁迫程度加剧,均呈下降趋势,参试品种在重度胁迫下差异达显著水平(P<0.05),不同干旱胁迫下,迪庆苦荞的总根体积和总根面积的降幅均小于其他2个品种,如在重度干旱下,3个品种的总根体积分别下降了32%、40%和47%。可见,在干旱环境下,迪庆苦荞的根系在土壤中的接触面积是最大,从而获取水分的能力也更强,为植株能正常生长尽量提供了最大的保障,增强了其耐旱能力。
表2中还可以看出,各参试品种在中度和重度胁迫下根冠比差异均达显著水平(P<0.05),且随水分胁迫程度的加剧,呈上升趋势,重度胁迫下,迪庆苦荞增幅最大(25%)其次为云荞1号(17% ),最小为多元苦荞仅增加了13%。
2.2 干旱胁迫对苦荞幼苗叶绿素含量、叶片相对含水量和叶片荧光参数的影响
由表3可知,叶绿素含量随水分胁迫的加剧,呈现减少趋势。重度胁迫下迪庆苦荞、云荞1号、多元苦荞的叶绿素含量分别是各对照的0.152、0.221、0.385倍。叶片相对含水量同叶绿素含量的变化趋势相似。与对照相比,中度胁迫下各品种分别下降4.3%、3.6%和5.6%;重度胁迫下各品种分别降低了8.1%、10.6%和12.1%。说明在同等程度干旱胁迫下多元苦荞的叶片含水量下降幅度较大,使得苦荞得不到正常的水分供应来维持体内生理代谢活动的正常运行,抗旱性较弱。
干旱胁迫下3个品种Fv/Fo出现不同幅度下降,说明PSII反应中心受破坏程度不同。各水分胁迫程度下,迪庆苦荞降低了12.4%和3.0%,云荞1号降低了18.5%和38.3%,多元苦荞降低了27.4%和47.8%。随着干旱胁迫加深,Fv/Fm的降幅表现为迪庆苦荞<云荞1号<多元苦荞,多元苦荞在中度和中度胁迫时分别降低7.4%、16%,降幅最大。Fv/Fo、Fv/Fm表现一致,充分说明抗旱性越弱的品种水分对其叶绿素荧光的影响程度越大。与此同时,可看出当苦荞处于水分胁迫的状态下,PSII活性中心受到伤害,光合作用能力下降,抑制了其生长。
2.3 干旱胁迫对不同基因型苦荞幼苗根系生理特性的影响
2.3.1 对根系活力、SOD、POD活性及MDA含量的影响 表4结果表明,3个品种苦荞的根系活力在中度和重度胁迫下的降幅均为迪庆苦荞最小(9%、20%)、多元苦荞品种最大(18%、31%),云荞1号品种居中(10%、27%)。统计分析结果表明,不同处理下根系活力差异均达显著水平(P<0.05),干旱胁迫导致了苦荞根系活力显著下降,且表现为多元苦荞对根系水分胁迫最为敏感,调节能力差,迪庆苦荞抗旱能力强,云荞1号次之。

表2 水分胁迫对苦荞苗期根系生长的影响
注:CK,对照;W1,中度胁迫;W2,重度胁迫,DQ,迪庆苦荞;YQ1,云荞1号;DY,多元苦荞;表内数据为平均值±标准误;同列数据后不同字母表示处理间差异达显著水平(P<0.05)。
Notes: CK, Normal irrigation; W1, Moderate water stress; W2, heavy water stress. PQ2, Diqing; YQ1, Yunqiao1; DY, Duoyuan;Values are mean±SE. Different letters in the same column indicate significant difference among treatments at 0.05 level.

表3 水分胁迫对苦荞苗期叶片叶绿素含量、叶片水相对含水量、Fv/Fo、Fv/Fm的影响
注:CK,对照;W1,中度胁迫;W2,重度胁迫,DQ,迪庆苦荞;YQ1,云荞1号;DY,多元苦荞;表内数据为平均值±标准误;同列数据后不同字母表示处理间差异达显著水平(P<0.05)。
Notes: CK, Normal irrigation; W1, Moderate water stress; W2, heavy water stress. PQ2, Diqing; YQ1, Yunqiao1; DY, Duoyuan;Values are mean±SE. Different letters in the same column indicate significant difference among treatments at 0.05 level.
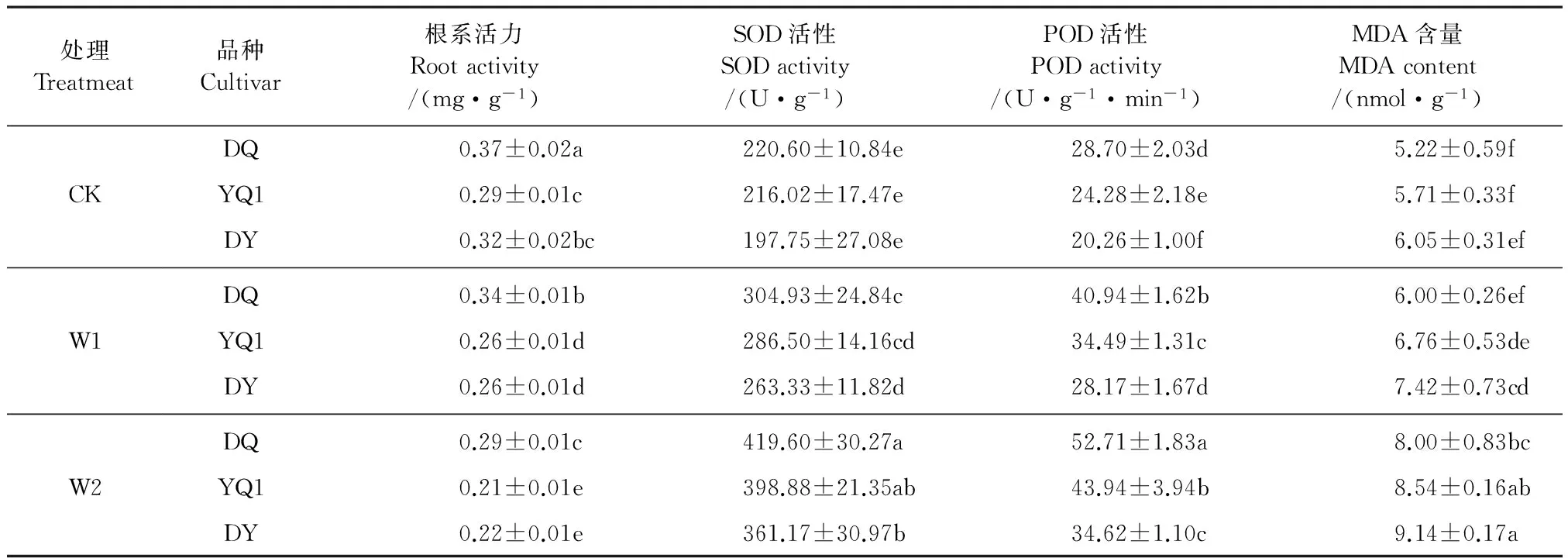
表4 干旱胁迫对不同苦荞苗期根系活力、SOD和POD活性及MDA含量的影响
注:CK,对照;W1,中度胁迫;W2,重度胁迫,DQ,迪庆苦荞;YQ1,云荞1号;DY,多元苦荞;表内数据为平均值±标准误;同列数据后不同字母表示处理间差异达显著水平(P<0.05)。
Notes: CK, Normal irrigation; W1, Moderate water stress; W2, heavy water stress. PQ2, Diqing; YQ1, Yunqiao1; DY, Duoyuan;Values are mean±SE. Different letters in the same column indicate significant difference among treatments at 0.05 level.
SOD、POD是极重要的抗氧化酶,可消除作物因逆境产生的O-和H2O2,缓解胁迫危害,减缓细胞衰老[8]。由表4可以看出,干旱胁迫下,3个苦荞品种根系SOD、POD活性均表现为增高的趋势。比较不同干旱环境下SOD、POD的增幅,可发现中度胁迫下,迪庆苦荞SOD增幅表现为最高(38%),且POD活性的增幅也明显高于其他两个品种(43%)。重度胁迫下迪庆苦荞的SOD、POD增幅均是最大,分别增加了87%和84%,表明迪庆苦荞清除活性氧的能力较好,耐旱性较强。
MDA是反映植物在逆境环境下所受伤害程度的一个积累量。表4中,同一品种的MDA含量在不同处理下差异均达显著水平(P<0.05),重度胁迫下MDA含量明显高于中度胁迫。迪庆苦荞在两种胁迫下增幅最小(84%、261%),多元苦荞增幅最大(183%、309%),表明,迪庆苦荞在干旱胁迫下减轻膜脂过氧化作用的能力较强,受害程度小,而多元苦荞膜脂受害程度大,抗旱性差。
2.3.2 对渗透物质的影响 水分胁迫下,植株通过积累渗透物质,降低渗透势,从而可以继续从外界吸水[27]。表5结果表明,苦荞根系脯氨酸、可溶性糖含量随干旱胁迫加剧而增加,其中脯氨酸最明显。各参试品种在两种胁迫逆境下可溶性糖含量差异均达显著水平(P<0.05)。但由于积累能力不同,中度胁迫下,迪庆苦荞、云荞1号、多元苦荞的脯氨酸含量和可溶性糖含量分别增加了81%、64%、42%和26%、34%、23%;重度胁迫增加了108%、93%、81%和82%、80%、62%,迪庆苦荞增加幅度远大于其他两个品种,说明迪庆苦荞在干旱胁迫下能够积累更多的脯氨酸和可溶性糖物质,来增强其渗透调节能力,缓解逆境压力,抗旱能力较强。
从表5中还可得出,可溶性蛋白含量随胁迫程度加深发展趋势与脯氨酸含量和可溶性糖含量的趋势相反为下降趋势,统计分析结果表明,各处理间差异均达显著水平(P<0.05),中度和重度胁迫下,迪庆苦荞、云荞1号、多元苦荞分别下降16%、12%、21%和38%、44%、48%,多元苦荞降幅最大,表明其不能维持较低的渗透势来对抗逆境,抗旱性最弱。
2.4 干旱胁迫对不同基因型苦荞产量的影响
如表6所示,主茎分枝数、单株粒数、百粒重随着水分胁迫程度加深呈不同下降趋势,但其中只有百粒重各处理间达显著差异水平(P<0.05)。主茎分枝数在中度、重度胁迫下下降最多的是多元苦荞(16%、26%)。迪庆苦荞在两种胁迫环境下单株粒数降低48%和70%,百粒重降低了12%和20%,均明显小于其他两个品种。可见干旱胁迫对迪庆苦荞产量的影响较小。
3 讨 论
水是植物发生的最初环境,也是植物生长发育的必要条件。前人的研究表明,水分胁迫会影响形态指标,影响明显或降低最多的品种往往抗旱性最差[28-29]。本研究中,3个供试品种苦荞的株高、茎粗、叶面积等均随干旱胁迫加深而呈现不同幅度的下降。各指标中,叶面积变化最明显,叶面积的变小正是植株在干旱环境下用来保证体内正常水分含量的适应性反应,降低蒸发面积,有利于减少体内水分散失。各参试品种的根表面积、根体积随干旱程度加深也呈下降趋势,但是中度胁迫却刺激了主根长的生长,迪庆苦荞最长。说明迪庆苦荞在水分胁迫环境下通过不断伸长根去吸收深层土壤水分来满足自身生长所需水分的能力较强,同时也证明根系长短对抗旱性的重要性[30]。通过根冠比随干旱胁迫呈上升趋势可看出,干旱胁迫抑制了地上部生长,但也刺激了根部的生长,植株通过增大根系与土壤的接触面积来获取水分和养分,这与张永清[31]等几种谷类作物根土系统的研究相似。

表5 干旱胁迫对不同苦荞脯氨酸、可溶性糖和可溶性蛋白含量的影响
注:CK,对照;W1,中度胁迫;W2,重度胁迫,DQ,迪庆苦荞;YQ1,云荞1号;DY,多元苦荞;表内数据为平均值±标准误;同列数据后不同字母表示处理间差异达显著水平(P<0.05)。
Notes: CK, Normal irrigation; W1, Moderate water stress; W2, heavy water stress. PQ2, Diqing; YQ1, Yunqiao1; DY, Duoyuan;Values are mean±SE. Different letters in the same column indicate significant difference among treatments at 0.05 level.

表6 水分胁迫苦荞成熟期产量构成的变化
注:CK,对照;W1,中度胁迫;W2,重度胁迫,DQ,迪庆苦荞;YQ1,云荞1号;DY,多元苦荞;表内数据为平均值±标准误;同列数据后不同字母表示处理间差异达显著水平(P<0.05)。
Notes: CK, Normal irrigation; W1, Moderate water stress; W2, heavy water stress. PQ2, Diqing; YQ1, Yunqiao1; DY, Duoyuan;Values are mean±SE. Different letters in the same column indicate significant difference among treatments at 0.05 level.
叶片光合作用是植物物质积累与生理代谢的基础环节,也是探究植物生长和代谢受环境影响的重要部分[32-33]。干旱胁迫会导致其光合系统发生异常,本试验中,各参试品种在重度干旱环境下,Fv/Fo、Fv/Fm降幅明显,说明PSII反应中心在干旱逆境下捕获激发能的效率和光合作用原初反应下降,与冯晓敏等[34]研究结果基本一致。有研究表明[27],当植株体内水分亏缺到一定程度,会造成叶片内叶绿体结构的损坏,相应的其叶绿素含量也会下降。本研究中,干旱胁迫严重影响了多元苦荞叶绿素的生物合成,且促使原有叶绿素加速分解,导致了光合作用降低,逆境生存能力较差。叶片内含水量多的植物代谢旺盛,抗干旱能力强。经比较,迪庆苦荞在同等干旱胁迫下能以较高的相对含水量保持活跃的代谢能力,抗旱性强。
在干旱环境下,作物体内产生了大量的毒性O-和H2O2,而为了清除活性氧,作物本能的产生了大量过氧化酶,来降低细胞膜受伤程度,增强抗性,确保其正常生长。本研究中,迪庆苦荞在中度和重度干旱胁迫下SOD、POD增量均最大,MDA积累量最小,多元苦荞反之,表明干旱逆境下迪庆苦荞提高保护酶的能力较强,可快速清除有害成分,缓减膜脂过氧化作用,从而降低MDA含量[24,35]。
许多高等植物在受到逆境胁迫时,会对外界产生防御反应,能迅速合成并积累大量渗透调节物质[36]。试验结果表明,三个苦荞品种在干旱环境下,游离的脯氨酸和可溶性糖大量积累,两种渗透物质均表现为迪庆苦荞增幅最大。但可溶性糖呈下降趋势,多元苦荞降幅最大。可看出,在干旱逆境下,迪庆苦荞可积累大量渗透物质,维持较低渗透势来抵抗干旱。
产量是检验作物抗旱性强弱最切合实际的指标,而充足的水分是保证籽粒饱满,粒数较高的重要条件。本次研究表明在两种干旱胁迫下,迪庆苦荞的百粒重、单株粒数、主茎分枝数均大于另外两个品种,优势突出,较适合土壤含水量及降水较少的地区。
4 结 论
不同基因型苦荞在水分胁迫时存在明显差异,从生理、生态及产量指标上可看出,迪庆苦荞在干旱环境下通过改变根性构型和生理反应来提高吸收水分的能力强于其他两个品种,优势显著。对于黄土高原水分匮乏的种植环境是最佳的选择。从各指标分析可看出:苦荞苗期叶面积、地上部干重、总根面积、PSII潜在活性Fv/Fo,根系SOD活性、游离脯氨酸等形态与生理指标变化幅度较大,对干旱胁迫反应较为敏感,所以均可作为苦荞抗旱品种筛选的参考指标。
参考文献:
[1] 张 雄.黄土高原小杂粮生产可持续发展研究[D].陕西杨凌:西北农林科技大学,2003.
[2] 万 燕,韦 爽,贾晓凤,等.荞麦抗旱性研究进展[J].作物杂志,2015(2):23-26.
[3] Zhou X, Hao T, Zhou Y, et al. Relationships between antioxidant compounds and antioxidant activities of tartary buckwheat during germination[J]. Journal of Food Science and Technology,2015,52(4):2458-2463.
[4] Huang XY, Zeller FJ, Huang KF. Variation of major minerals and trace elements in seeds of tartary buckwheat (fagopyrum tataricum gaertn.)[J]. Genetic Resources and Crop Evolution,2014,61(3):567-577.
[5] Wang Q, Ogura T, Wang L. Research and development of new products from bitter-buckwheat[C]//Proc. 6th Intl. Symp. Buckwheat at Shinshu Japan, 1995:873-879.
[6] 汤章城.植物对水分胁迫的反应和适应性__抗逆性的一般概念和植物的抗涝性[J].植物生理学通讯,1983(3):24-29.
[7] 李 鑫,张永清,王大勇,等.水氮耦合对红小豆根系生理生态及产量的影响[J].中国生态农业学报,2015,23(12):1511-1519.
[8] 张永清,苗果园.水分胁迫条件下有机肥对小麦根苗生长的影响[J].作物学报,2006,32(6):811-816.
[9] Deng LQ, Zhang K, Huang KF, et al. Rapd analysis for genetic diversity of nineteen common and tartary buckwheat varieties[J]. 农业科学与技术(英文版),2011,12(1):65-69.
[10] 徐笑宇,方正武,杨 璞,等.苦荞遗传多样性分析与核心种质筛选[J].干旱地区农业研究,2015,33(1):268-277.
[11] 汪 灿,胡 丹,杨 浩,等.苦荞主要农艺性状与产量关系的多重分析[J].作物杂志,2013,(6):18-22.
[12] 李瑞国,高冬丽,柴 岩,等.苦荞资源农艺性状因子聚类分析[J].干旱地区农业研究,2007,25(6):80-84.
[13] Huang KF, Shi Z, Song YX, et al. Research on variation in sucrose content among different tartary buckwheat genotypes[J]. 农业科学与技术(英文版),2011,12(2):211-213.
[14] 刘 琴,张薇娜,朱媛媛,等.不同产地苦荞籽粒中多酚的组成、分布及抗氧化性比较[J].中国农业科学,2014,47(14):2840-2852.
[15] Peiyou Qin, Qiang Wang, Fang Shan, et al. Nutritional composition and flavonoids content of flour from different buckwheat cultivars[J]. International Journal of Food Science & Technology,2010,45(5):951-958.
[16] 葛维德,赵 阳,刘冠求,等.播种期对苦荞主要农艺性状及产量的影响[J].园艺与种苗,2009,29(1):36-37.
[17] 万丽英.播种密度对高海拔地区苦荞产量与品质的影响[J].作物研究,2008,22(1):42-44.
[18] 田秀英,李会合,王正银.施硒对苦荞N,P,K营养元素和土壤有效养分含量的影响[J].水土保持学报,2009,23(3):112-115.
[19] 宋毓雪,郭 肖,杨龙云,等.不同氮磷钾肥料处理对苦荞籽粒充实度及产量的影响[J].浙江农业学报,2014,26(6):1568-1572.
[20] 张 强,李艳琴.基于矿质元素的苦荞产地判别研究[J].中国农业科学,2011,44(22):4653-4659.
[21] Lim JH, Park KJ, Kim BK, et al. Effect of salinity stress on phenolic compounds and carotenoids in buckwheat (fagopyrum Esculentum M.) sprout[J]. Food Chemistry,2012,135(3):1065.
[22] 胡丽雪.苦荞幼苗对铅铝胁迫的生理生化反应及其矫治[D].贵阳:贵州师范大学,2014.
[23] 董新纯,赵世杰,郭珊珊,等.增强UV-B条件下类黄酮与苦荞逆境伤害和抗氧化酶的关系[J].山东农业大学学报(自然科学版),2006,37(2):157-162.
[24] 陈 鹏,张德玖,李玉红,等.水分胁迫对苦荞幼苗生理生化特性的影响[J].西北农业学报,2008,17(5):204-207.
[25] Yao Y, Xuan Z, Li Y, et al. Effects of ultraviolet-b radiation on crop growth, development, yield and leaf pigment concentration of tartary buckwheat (fagopyrum tataricum) under field conditions[J]. European Journal of Agronomy,2006,25(3):215-222.
[26] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].第4版.北京:高等教育出版社,2009:32-227.
[27] 王晓琴.玉米幼苗对水分胁迫的生理反应及其与品种抗旱性的关系研究[D].成都:四川农业大学,2002.
[28] 郑盛华,严昌荣.水分胁迫对玉米苗期生理和形态特性的影响[J].生态学报,2006,26(4):1138-1143.
[29] 王贺正,李 艳,马 均,等.水稻苗期抗旱性指标的筛选[J].作物学报,2007,33(9):1523-1529.
[30] Garcia A, Gonzalez M C. Morphological markers for the early selection of drought-tolerant rice varieties[J]. Cultivate Tropical,1997,18(2):47-50.
[31] 张永清.几种谷类作物根土系统的研究[D].太谷:山西农业大学,2005.
[32] Liu G S, Guo A H, Ren S X, et al. Effects of different mulching methods on diurnal variation of leaf photosynthesis and water use efficiency for summer maize[J]. Journal of Soil Water Conservation,2004,18(2):152-155.
[33] Wang Z, Liang Y. The effects of nitrogen and phosphorus on the water sensitivity and physiological parameters of summer maize[J]. Acta Ecologica Sinica,2003,23(4):751-757.
[34] 冯晓敏,张永清.水分胁迫对糜子植株苗期生长和光合特性的影响[J].作物学报,2012,38(8):1513-1521.
[35] 徐 芦.荞麦抗旱指标鉴选与利用[D].陕西杨凌:西北农林科技大学,2010.
[36] 刘志玲,程 丹.植物抗旱生理研究进展与育种[J].中国农学通报,2011,27(24):249-252.

