生物质炭输入对盐胁迫下玉米植株生物学性状的影响
刘 易,孟阿静,黄 建,祁 通,冯耀祖,唐光木,葛春晖,王新勇
(新疆农科院土壤肥料与农业节水研究所, 新疆 乌鲁木齐 830091)
新疆盐渍土总面积达到8.476×106hm2[1],31.1%的耕地面积受到盐碱危害[2]。盐渍化导致的环境问题成为限制农作物产量提升和品质改良的重要因素之一。盐胁迫可以通过抑制光合作用,打破植物营养平衡;可以抑制植物离子吸收和转运,改变植物细胞内渗透压、破坏细胞膜的完整性和降低酶活性。同时,盐胁迫也可以通过改变土壤理化性质间接对植物生长产生影响。且盐度越大,作用时间越长越明显[3-6]。盐碱地的改良利用,特别是土壤盐分-植物生长-改良剂之间的关系研究一直是国内外活跃的研究领域。研究成果也对提高农作物产量和改善盐碱地区生态环境起到了重要作用[7]。生物质炭是一种新型技术产品,能快速增加土壤有机炭含量、改善土壤理化性质、增加土壤持水性能[8],并长时间保持粒状结构,改善土壤结构[9-10]。研究表明生物质炭应用在酸性土壤中无论是单独施入还是和化肥、厩肥混合施用,土壤pH均会有不同程度的上升,进而改善酸性土壤环境[11-13]。而关于生物质炭应用于盐渍化土壤改良,对植物的生长、生理影响的研究较少。本研究拟通过生物质炭输入新疆氯化物-硫酸盐盐化灰漠土壤,以其为基质栽培玉米,研究生物质炭输入对玉米生物学性状的影响,为生物质炭应用于盐渍化耕地的改良利用提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 供试土壤 供试土壤采自玛纳斯北五岔,土壤类型为灰漠土,取土深度0~30 cm,经碾压、粉碎、风干、过筛(2 mm),测定土壤基本理化性质见表1。重度盐渍化耕地土壤含盐量为16.3 g·kg-1;中度盐渍化土壤含盐量为10.2 g·kg-1;轻度盐渍化土壤含盐量为4.0 g·kg-1;依据Cl-/SO42-离子毫克当量比例在0.2~1.0之间为氯化物-硫酸盐盐渍化土壤的分类方法[14],该供试土壤盐渍化类型为氯化物-硫酸盐。

表1 供试土壤基本理化性质
1.1.2 生物质炭的制备 生物质炭取自国家灰漠土土壤肥力与肥料效益检测基地(N43°56′30″,E87°28′16″),原材料为棉花秸秆,温度是500℃~700℃,烧制时间8个小时,测定生物质炭基本理化性质:pH 9.93,EC3.7 mS·cm-1,有机碳434.18 g·kg-1,全氮26.71 g·kg-1,全磷11.85 g·kg-1,全钾22.54 g·kg-1,碱解氮5.83 mg·kg-1,速效磷200.49 mg·kg-1,速效钾108.2 mg·kg-1,CEC 12.65 cmol(+)·kg-1。
1.2 试验设计
供试土壤处理为轻、中、重3种程度盐渍化土壤(理化性质见表1),土壤容重为1.5 g·cm-3,过2 mm筛备用;生物质炭输入量按照土壤质量的0%(BC0,空白对照)、1%(BC1)、2%(BC2)、4%(BC4)、8%(BC8),与土壤混合均匀。换算为田间施入量分别为0、22.5、45、90、180 t·hm-2。2016年5月17日装盆、播种,每个处理3次重复,共15个处理。
供试作物为玉米,品种为郑单958,播种10 粒·盆-1,6月2日定苗,3 株·盆-1。灌水定量:每天50~100 ml·盆-1(土壤含水量达到田间持水量的60%~70%)。分别于苗期(6月3日),拔节期(6月23日)测定玉米生物学性状,6月27日测定叶片酶活性。
1.3 观测指标测定及方法
土壤pH值用电位法(土水比1∶5测定);
发芽率=(发芽种子数/供试种子数)×100;
发芽势=(第t天的种子发芽数/供试种子数)×100,t=7;
发芽指数=∑(在t天的发芽数/相应发芽日数);
玉米幼苗干物质测定:每个处理选取3株有代表性的植株,用抖根法去除玉米根际土壤。将玉米根、茎、叶分开,在105℃杀青15 min,60 ℃烘干,分别称重;
生理指标测定:过氧化氢酶采用KMnO4滴定法[15];过氧化物酶采用愈创木酚法[15];细胞膜脂的损伤程度用脂质过氧化产物丙二醛(MDA)生成量反映[15];超氧化物歧化酶(SOD)活性用NBT还原抑制法测定[16]。
1.4 数据统计
数据采用Microsoft Excel 2007和SPSS17.0进行数据统计分析和显著性检验,用最小显著性差异表示(LSD0.05)。
2 结果与分析
2.1 生物质炭输入对盐渍化土壤pH和总盐的影响
轻、中度盐渍化土壤输入生物质炭,与BC0处理相比,BC1、BC2、BC4处理土壤pH降低0.27%~1.91%,差异不显著(P>0.05);BC8处理土壤pH 较BC0增加2.93%~5.49%,差异显著(P<0.05)。重度盐渍化土壤pH随生物质炭输入量增加而增大,BC8处理最高,较对照增加8.16%。生物质炭输入盐渍化土壤对pH的影响如图1所示。

注:相同程度盐渍化土壤各处理间不同字母表示差异达5%显著水平,下同。
Note: Different small letters within the same Saliferous level of soil mean significant difference between treatments at 0.05 level,The same below.
图1生物质炭输入对盐渍化土壤pH的影响
Fig.1 Effects of biochar additions on saliferous soil pH
生物质炭输入条件下,三种盐渍化程度土壤BC1、BC2、BC4处理总盐均低于BC0处理,差异显著(P<0.05);但BC8处理总盐均高于其余处理,较CK增加31.76%、9.17%、11.13%,差异显著(P<0.05),见图2。说明输入一定量生物质炭可降低土壤总盐;但超量施入,将提高土壤总盐含量。

图2生物质炭输入对盐渍化土壤总盐的影响
Fig.2 Effects of biochar additions on saliferous soil total salt
2.2 生物质炭输入对玉米生长的影响
2.2.1 生物质炭输入对玉米种子发芽率的影响 由表2可知,未输入生物质炭,玉米种子发芽率与土壤盐胁迫程度呈负相关,土壤盐分对种子萌发的抑制大小顺序依次为:重度盐胁迫>中度盐胁迫>轻度盐胁迫。输入生物质炭条件下,玉米种子发芽率高于空白对照(BC0)。以三个盐胁迫水平为基础,不同生物质炭输入量各处理的玉米种子发芽率:BC8>BC4>BC2>BC1>BC0,BC8处理发芽率较BC0增加145.43%、174.57%、73.72%。表明生物质炭对玉米种子萌发的促进作用随输入量增大而增强;但与4%生物质炭输入量相比,8%生物质炭输入量对中、重度盐渍化土壤种子发芽率促进作用不显著(P>0.05),说明在中、重度盐渍化土壤中,生物质炭促进种子萌发的最佳输入量为4%~8%。
玉米种子发芽势、发芽指数均随土壤盐渍化程度增大而降低,说明盐胁迫可导致玉米种子活力降低。生物质炭输入能显著提高盐渍化土壤中种子发芽势和发芽指数,且提高幅度与生物质炭输入量呈正相关。在不同盐渍化程度的处理中增幅不同,重度盐渍化处理玉米种子发芽势和发芽力的增幅最大。
2.2.2 生物质炭输入对玉米茎粗和株高的影响 株高和茎粗是直接反映作物生长状况的重要指标。由表2可看出,未输入生物质炭,玉米苗期茎粗随土壤盐渍化程度增加而降低,重度盐渍化土壤BC0处理最低,仅4.58 cm。玉米苗期株高表现:中度盐渍化处理>轻度盐渍化处理>重度盐渍化处理,中度盐胁迫促进了玉米幼苗株高生长,株高达37.28 cm,但与轻度盐渍化土壤BC0处理差异不显著(P>0.05)。重度盐渍化土壤BC0处理株高仅25.75 cm,受盐胁迫抑制最显著(P<0.05)。

表2 生物质炭输入盐渍化土壤对玉米种子萌发和生长的影响
注:同列不同小写字母表示处理间差异达5%显著水平。
Note: Different small letters within a column mean significant difference between treatments at 0.05 level.
生物质炭输入促进了玉米茎粗和株高生长。轻度、中度盐渍化土壤输入2%生物质炭处理对茎粗、株高的生长促进效应均达到最大,较BC0处理茎粗分别增加32.73%和15.19%,株高分别增加61.78%和36.50%,差异显著(P<0.05);但不同生物质炭输入水平下茎粗差异不显著(P>0.05)。重度盐渍化土壤BC4处理茎粗、株高均最高,较BC0处理分别增加44.76%、63.96%,差异显著(P<0.05)。
2.2.3 生物质炭输入对玉米干物质积累量的影响 干物质累积量是衡量作物生长发育的重要指标。由图3、图4可知玉米地上部干重和地下部干重均随土壤盐渍化程度增强而降低。与BC0相比,输入生物质炭后玉米的地上、地下干物质质量均显著增大,差异显著(P<0.05)。轻度盐渍化处理玉米地上、地下干物质累积量与生物质炭输入量呈正相关,BC8处理最大,各处理间差异显著(P<0.05);中度盐渍化处理地上、地下干物质累积量均随生物质炭输入量的增加呈现先升后降的趋势,BC2处理最高,较BC0增幅分别为151.2%、91.7%,差异显著(P<0.05)。重度盐渍化土壤处理玉米地上、地下干物质量在BC8处理中最高,较BC0处理高648%、241%,差异显著(P<0.05)。

图3生物质炭输入盐渍化土壤对玉米地上干物质累积量的影响
Fig.3 Effects of biochar iuputs to Saliferous soil during corn overground dry matter accumulation
2.3 生物质炭输入对玉米幼苗叶片酶活性的影响
2.3.1 生物质炭输入对玉米幼苗叶片超氧化物歧化酶活性的影响 超氧化物歧化酶(SOD)是植物细胞中普遍存在的一种含金属离子的抗氧化酶,是植物抗氧化剂系统中主要组分之一。由图5可知,未添加生物质炭条件下,土壤盐分抑制植株叶片SOD酶活性,重度盐渍化土壤处理玉米叶片SOD酶活性最低,仅为10.17 U·g-1·min-1,较轻度BC0处理降低19.35%,差异显著(P<0.05),表明SOD酶活性受到外界胁迫而降低,对逆境的抵抗力降低。


图4 生物质炭输入盐渍化土壤对玉米地下干物质累积量的影响
图5生物质炭输入盐渍化土壤对玉米幼苗叶片SOD活性的影响
Fig.5 Effects of biochar additions on saliferous soil to corn SOD activity
生物质炭输入显著促进玉米叶片SOD酶活性,随生物质炭输入量增加呈现先增高后降低趋势。轻、中、重度盐渍化土壤BC2处理叶片SOD酶活性均最高,分别达17.33、19.44、17.31 U·g-1·min-1,分别较轻、中、重BC0处理增加37.43%、55.41%、70.22%,差异显著(P<0.05);随生物质炭输入量继续增大,叶片SOD酶活性降低,但均高于对照。表明生物质炭输入能显著缓解盐渍化土壤对植株的胁迫。
2.3.2 生物质炭输入对玉米幼苗叶片丙二醛含量的影响 丙二醛是膜脂过氧化的产物,它的含量可反映膜损伤程度的大小。由图6可知,空白对照中玉米叶片MDA含量随盐胁迫程度增加而升高,重度盐渍化土壤BC0处理达10.29 U·g-1·min-1,较轻度BC0处理增高64.91%,差异较显著(P<0.05)。表明盐渍化土壤在一定程度上诱导了玉米体内活性氧自由基的累积,脂质过氧化加剧,使MDA含量显著增加。输入生物质炭后,玉米幼苗叶片MDA含量随生物质炭输入量增加而降低,轻、中、重度盐渍化土壤BC8处理均降至最低,分别为3.89、4.83、4.41 U·g-1·min-1,表明输入生物质炭有效缓解了脂质过氧化,MDA含量显著降低。

图6生物质炭输入盐渍化土壤对玉米幼苗叶片MDA活性的影响
Fig.6 Effects of biochar additions on saliferous soil to corn MDA activity
2.3.3 生物质炭输入对玉米幼苗叶片过氧化氢酶活性的影响 由图7可以看出,添加生物质炭前,玉米幼苗叶片CAT酶活性随土壤盐渍化程度增加而降低,重度盐渍化土壤BC0处理CAT酶活性29.04 U·g-1·min-1,较轻度盐渍化土壤BC0处理降低47.51%。
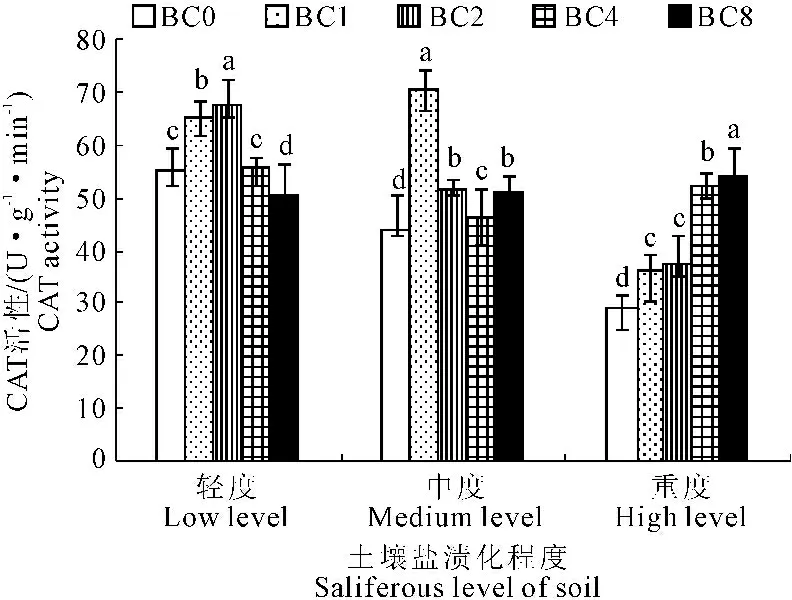
图7生物质炭输入盐渍化土壤对玉米幼苗叶片CAT活性的影响
Fig.7 Effects of biochar additions on saliferous soil to corn CAT activity
生物质炭输入轻、中程度盐渍化土壤,玉米叶片CAT活性随生物质炭输入量增加呈现先升高再降低的趋势。其中轻度盐渍化土壤BC2处理最高,达67.85 U·g-1·min-1。随后逐渐降低,BC8处理降至50.37 U·g-1·min-1;中度盐渍化土壤BC1处理CAT活性最高,达70.52 U·g-1·min-1,较BC0高59.73%;重度盐渍化土壤中玉米叶片CAT活性随生物质炭输入量增加显著增高,BC8处理CAT活性最高,达54.22 U·g-1·min-1,较BC0高86.73%。
2.3.4 生物质炭输入对玉米幼苗叶片过氧化物酶活性的影响 过氧化物酶(POD)是植物内源自由基消除剂,逆境中植物过氧化物酶活性增强或保持较高水平,可使植物减轻由自由基造成的伤害。图8可以表明,空白对照中玉米幼苗叶片POD酶活性随土壤盐胁迫程度增加而降低,重度盐渍化土壤BC0处理POD活性较轻度BC0处理降低37.37%,差异显著(P<0.05)。说明盐分胁迫致使玉米幼苗叶片内自由基降低,生长受到抑制。

图8生物质炭输入盐渍化土壤对玉米幼苗叶片POD活性的影响
Fig.8 Effects of biochar additions on saliferous soil to corn POD activity
生物质炭输入不同水平的盐渍化土壤,玉米叶片POD活性均呈现先增高后降低的趋势。轻度盐渍化土壤输入生物质炭各处理均低于BC0处理,差异显著(P<0.05);中度盐渍化土壤中BC4处理最高,为391.1 U·g-1·min-1;重度盐渍化土壤输入生物质炭各处理均高于BC0处理,差异显著(P<0.05),BC2处理最高,达479.4 U·g-1·min-1。
3 讨 论
本试验三种程度盐渍化土壤输入生物质炭后,生物质炭输入量小于8%有效降低了土壤总盐含量,但对土壤pH没有显著影响。8%生物质炭输入量均显著提高了土壤pH和总盐含量。推测一定量生物质炭输入增加了土壤总孔隙度和大孔隙,增强盐渍化土壤中盐分离子的淋洗作用,改善了土壤物理性质,进而降低了土壤总盐;而大量生物质炭输入导致生物质炭自身所含有的盐基离子在水土交融作用下释放,提高了土壤总盐含量。
盐渍化危害对农业生产造成的危害主要是影响种子萌发、作物吸收水分、作物对养分的利用及离子毒害,并导致土壤结构不良,物理性状差,供肥力弱[17]。刘世杰等[18]研究表明生物炭能够促进玉米苗期生长,株高和茎粗分别比对照增加4.31~13.13 cm和0.04~0.18 cm。Chidumayo[19]研究表明施用生物炭可提高紫荆树发芽率30%,生物量提高13%;Masahide等[20]发现生物炭与肥料混合施用能增加玉米和花生的产量。张瑞等[21]在生物质炭对滩涂盐碱影响研究表明生物竹炭显著提高土壤有效磷和速效钾含量,促进小白菜生长;本试验中盐分胁迫对玉米种子萌发、株高、茎粗、干物质累积量等生长均有抑制作用。生物质炭输入提高了玉米种子发芽率、发芽势和发芽指数,并促进了玉米茎粗、株高生长,以及地上、地下干物质累积量增加,重度盐渍化土壤处理地上、地下干物质量在8%生物质输入量条件下提高了648%、241%。以上结果与前人研究结果相符。推测促进效应源于生物炭能增强作物对氮、磷、钾的吸收,减少铵和钙等养分离子的淋失;也可能与生物炭增加土壤有效养分,提高土壤阳离子交换量,减少交换性有害离子含量,促进作物生长有关。如张雯等[22]采用盆栽种植试验方法,研究生物质炭不同施入量对盐土中基础养分含量、pH值、阳离子交换量、水溶性盐等变化,结果表明生物炭施入显著提高盐土中有机碳含量,阳离子交换量大幅增加,改良效果较好;岳燕[23]研究表明向盐渍化表层土壤加入生物质炭,显著促进盐分淋洗,加快盐渍化土壤脱盐进程;唐光木[24]研究显示棉杆炭能够提高灰漠土电导率、CEC、有机碳和全氮含量,并随增加量的增加而增加。但也有研究表明施入生物炭会造成作物减产。如Kishinmoto等[25]研究显示生物质炭施入量过大对大豆、玉米等对pH敏感的作物减产明显;Glaser B[26]发现生物炭施用量在0.5 t·hm-2,作物产量降低。生物质炭对作物学效应正负不一与土质类型、栽培技术措施、气候环境、生物质炭制备原料、施用量等复杂因素有关。
盐胁迫使植物产生活性氧,启动膜脂过氧化作用,破坏细胞膜细胞,对植物造成伤害。POD、CAT、SOD是植物体内的保护酶系统,它们相互协调,共同作用清除膜脂过氧化作用产生的MDA,从而保护膜系统不受破坏[27-31]。本研究玉米幼苗在盐胁迫下,随胁迫程度的增加,MDA含量相应增加,高盐渍化程度MDA含量增至最高。说明盐胁迫条件下,玉米幼苗的膜脂过氧化作用明显增大,作物细胞受损伤程度明显加大细胞膜内外的物质无法达到动态平衡。输入生物质炭后MDA含量均逐渐降低,且降低幅度与生物质炭输入量呈正比。说明生物质炭能有效缓解盐胁迫对幼苗细胞损伤程度。在植物体生长过程中,为抵制膜脂过氧化对细胞膜造成伤害,在体内会形成一套抵御体系。CAT、POD、SOD等组成的细胞酶防御系统,起着消除细胞内活性氧和维持活性氧的动态平衡等重要作用。本试验玉米叶片CAT、POD、SOD等抗氧化酶活性与盐胁迫水平呈负相关。输入生物质炭后玉米幼苗叶片CAT、SOD酶活性均高于不添加处理,但在不同盐渍化水平的处理中,玉米CAT、SOD酶活性增加幅度与生物质炭输入量之间无规律;输入生物质炭增强重度盐胁迫条件下幼苗叶片POD酶活性,但轻度盐胁迫条件下输入生物质炭会引起POD酶活性降低,轻度盐胁迫条件下输入生物质炭POD酶活性仅BC4处理高于对照,这可能与轻、中度胁迫水平低于POD的自我调节阈值有关。
4 结 论
不同生物质炭输入量对盐渍化土壤pH和总盐的影响有差异。1%、2%、4%生物质炭输入轻、中度盐渍化土壤,pH和总盐降低;重度盐渍化土壤pH、总盐随生物质炭输入量增加呈增大趋势。输入8%生物质炭,轻、中、重度盐渍化土壤pH和总盐含量均达到最高;
盐胁迫严重抑制玉米种子萌发、幼苗生长,以及干物质累积,且抑制效果随盐渍化程度增高而增大。输入生物质炭可以显著提高玉米种子发芽率、发芽势、发芽指数,提高幅度与生物质炭输入量呈正相关;轻度、中度、重度盐渍化土壤分别输入2%、2%、4%生物质炭量对玉米茎粗、株高的生长促进作用最强;轻度、中度、重度盐渍化土壤分别输入8%、2%、8%生物质炭量对玉米地上、地下干物质累积量的促进作用最大。通过以上生物学性状,表明生物质炭对盐胁迫下作物生长有促进作用。
随胁迫程度的增加,玉米的MDA含量均增加,CAT、SOD、POD酶活性降低,膜脂过氧化对细胞膜造成伤害。生物质炭输入影响了盐胁迫下玉米幼苗叶片的生理指标:MDA含量降低,CAT、SOD酶活性增强,表明生物质炭输入对盐渍化土壤中生长的玉米体内保护酶系统的启动有促进作用。
参考文献:
[1] 文振旺.新疆土壤地理[M].北京:科学出版社,1965.
[2] 新疆维吾尔自治区农业厅.新疆土壤[M].北京:科学出版社,1996:304-336.
[3] Lucm, Qiu N W, LU Q T. Does salt stress leadto increased susceptibility of photosystem II to photoinhibition and changes in photosynthetic pigment composition in halophyte Suaeda salsa grownoutdoors[J]. Plant Sci, 2002,163:1063-1068.
[4] Walker R R, Blackmore D H, Sun Q. Carbon dioxide assimilation and foliar ion concentration in leaves of lemon (Citrus limon L.) trees irrigated with NaCl or Na2SO4[J]. Aust J Plant Physiol,1993,20:173-185.
[5] Munns R. Physiological processes limiting plant growth in saline soils:some Dogmas and hypotheses[J]. Plant Cell Environ, 1993,16:15-24.
[6] Sultana N, Ikeda T, Itoh R. Effect of NaCl salinity on photosynthesis and dry matter accumulation in developing rice grains[J]. Environ Exp Bot, 1999,42:211-220.
[7] 王志春,梁正伟.植物耐盐研究概况与展望[J].生态环境,2003,12(1):106-109.
[8] Lehmann J. A handful of carbon. Nature, 2007,447(10):143-144.
[9] Atkinson CJ, Fitzgerald JD, HIPPS NA. Potential meehanisms for aehieving Agricultural Benefits form biochar applieation to temperate soll:a review[J]. Plant and soll, 2010,337:1-18.
[10] Glaser B, Haumaier L, Guggenbergerqetal. Blaekearbonin50115:The use of benzene arboxylic aeids as speeific markers[J]. Organie Geoehemistry, 1998,29:811-819.
[11] Lehmann J, Silva Jr J P, Steiner C, et al. Nutrient availability and leaching in an archaeological anthrosol and a ferralsol of the central amazon basin: fertilizer, manure and charcoal amendments[J]. Plant Soil, 2003,249:343-357.
[12] Steiner C, Teixeira W G, Lehmann J, et al. Long term effects of manure,charcoal and mineral fertilization on crop production and fertility on a highly weathered Central Amazonian upland soil[J]. Plant Soil, 2007,291:275-290.
[13] Topoliantz S, Ponge J F, Ballof S. Manioc peel and charcoal: apotential organic amendment for sustainable soil fertility in the tropics[J]. Biol Fert.Soils, 2005,41:15-21.
[14] 王遵亲.中国盐渍土[M].北京:科学出版社,1993.
[15] 李合生,孙 群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[16] 张宪政.作物生理研究法[M].北京:农业出版社,1992:200-211.
[17] 新疆灌区土壤盐渍化及改良治理模式[J].新疆科学技术出版社,2008:22-23.
[18] 刘世杰,窦 森.黑碳对玉米生长和土壤养分吸收与淋失的影响[J].水土保持学报,2009,23(1):79-82.
[19] Chidumayo E N. Effects of wood carbonization on soil and initial developments of seedlings in miombo woodland[J]. Zambia. Forest Ecology Management, 1994,70:353-357.
[20] Masahide Y, Yasuyuki O, Irhas F W, et al. Effects of the application of charred bark of Acacia manguum on the yield of maize, cowpea and peanut, and soil chemical properties in South Sumatra, Indones[J]. Soil Science and Plant Nutrition, 2006,52:489-495.
[21] 张 瑞,杨 昊,张芙蓉,等.生物竹炭改良崇明滩涂盐渍化土壤的试验研究[J].农业环境科学学报,2014,33(12):2404-2411.
[22] 张 雯,耿增超,陈心想,等.生物炭对盐土改良效应研究[J].干旱地区农业研究,2013,31(3):73-77.
[23] 岳 燕,郭维娜,林启美,等.加入不同量生物质炭盐渍化土壤盐分淋洗的差异与特征[J].土壤学报,2014,51(4):914-919.
[24] 唐光木,姚红宇,蒲胜海,等.棉杆炭对灰漠土性质的影响[J].新疆农业科学,2015,52(9):1680-1686.
[25] Kishinmoto S, Sugiura G. Chareoal as a soil conditioner[J]. Int Achieve Future, 1985,5:12-23.
[26] Glaser B, Lehmann J, Zech W. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal-a review[J]. Bioligy Fertility of Soils, 2002,35:219-230.
[27] 舒卫国,陈受宜.植物在渗透胁迫下基因表达及信号传递[J].生物工程进展,2000,20(3):3-6.
[28] 马焕成,王沙生.胡杨膜系统的盐稳定性及盐胁迫下的代谢调节[J].西南林学院学报,1998,18(1):15-23.
[29] 陈贻竹,帕特森.低温对植物叶片中超氧物歧化酶、过氧化氧酶和过氧化物酶水平的影响[J].植物生理学报,1988,14(4):323-328.
[30] 颐红雅.植物基因与分子操作[M].北京:北京大学出版社,1995.
[31] 罗广华,王爱国,邵从本,等.超氧物歧化酶在植物细胞内的分布[J].植物生理学报,1985,(2):53-60.

