艾迪注射液联合肠内营养混悬液(TPF)治疗晚期胃癌的疗效观察
潘 放,邓 毅(1.重庆市合川区人民医院肿瘤科,重庆 40150;.重庆市合川区人民医院重症医学科,重庆 40150)
我国胃癌的发病率居恶性肿瘤的首位,多发于年龄>50岁者,且男性发病率显著高于女性[1]。目前,医学界对胃癌的发生原因存在较大争议,其中地域环境及生活习惯的影响突出[2];我国西北和东部沿海区域的胃癌发生率显著高于南方地区[2];长期食用腌制类食物的人群胃癌发病率较高[3]。此外,幽门螺杆菌感染、遗传基因等均为引发胃癌的重要因素[4]。胃癌发病初期无明显特征,待确诊时多已是晚期,无法有效开展手术和放化疗措施。晚期胃癌患者通常伴有营养不良及严重的并发症,随着疾病的进展,患者生活质量下降,生命安全受到严重威胁[5]。本研究探讨了艾迪注射液联合肠内营养混悬液(TPF)治疗晚期胃癌的临床疗效,现报告如下。
1 资料与方法
1.1 资料来源
选取2014年1月—2017年6月重庆市合川区人民医院收治的晚期胃癌患者80例。纳入标准:经影像学及病理学确诊为晚期胃癌;存在营养风险;3个月内未接受免疫治疗。排除标准:存在严重心脑血管疾病及精神类疾病者。以随机数字表法分为观察组和对照组,每组40例。观察组患者中,年龄38~87岁,平均(72.35±6.5)岁;临床分期:Ⅲ期12例,Ⅳ期28例。对照组患者中,年龄39~88岁,平均(72.41±6.8)岁;临床分期:Ⅲ期13例,Ⅳ期27例。两组患者一般资料的均衡性较高,具有可比性。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书。
1.2 方法
对照组患者给予艾迪注射液(规格:每支10 ml)60 ml+0.9%氯化钠注射液400 ml,静脉滴注,1日1次,20 d为1个疗程,共治疗3个疗程。观察组患者在对照组的基础上,根据患者需要的基本能量、进食状况,口服或经鼻饲管输入肠内营养混悬液(TPF)(规格:500 ml),1日2~3瓶,20 d为1个疗程,共治疗3个疗程。
1.3 观察指标
观察两组患者的卡氏评分(karnofsky performance status,KPS),采用全自动生化分析设备检测血清人免疫球蛋白G(IgG)、CD3+水平,并比较两组患者脏器感染情况、临床疗效及不良反应发生情况的差异。
1.4 疗效评定标准
根据实体瘤评定标准评估临床疗效:完全缓解,肿瘤完全消失,持续时间≥4周;部分缓解,肿瘤2个最大垂直直径乘积减少≥50%,未发现新病灶,持续时间≥4周;无变化,肿瘤的2个最大垂直直径乘积减少<50%,扩大≤25%,未发现新病灶,持续时间≥8周;进展,肿瘤2个最大垂直直径乘积增大>25%,或发现新病灶。总有效率=(完全缓解病例数+部分缓解病例数)/总病例数×100%。
1.5 统计学方法
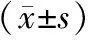
2 结果
2.1 两组患者治疗前后KPS评分比较
治疗前,观察组、对照组患者平均KPS评分分别为(41.15±5.48)、(41.19±5.50)分;治疗后,观察组患者平均KPS评分为(63.35±5.21)分,明显高于对照组的(54.57±7.56)分,差异有统计学意义(P<0.05)。
2.2 两组患者治疗前后血清IgG、CD3+水平比较
治疗前,两组患者血清IgG、CD3+水平的差异均无统计学意义(P>0.05);治疗后,观察组患者血清IgG、CD3+水平明显高于对照组,差异均有统计学意义(P<0.05),见表1。
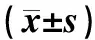
表1 两组患者治疗前后血清IgG、CD3+水平比较Tab 1 Comparison of serum IgG and CD3+ levels between two groups before and after treatment
2.3 两组患者脏器感染情况比较
治疗前,观察组患者脏器感染率为65.00%(26/40),对照组为67.50%(27/40),两组的差异无统计学意义(P>0.05)。治疗后,观察组患者脏器感染率为22.50%(9/40),明显低于对照组的60.00%(24/40),差异有统计学意义(P<0.05)。
2.4 两组患者临床疗效比较
观察组患者的总有效率明显高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组患者临床疗效比较[例(%)]Tab 2 Comparison of clinical efficacy between two groups[cases (%)]
2.5 两组患者不良反应情况比较
观察组患者中发生1例腹胀,1例腹泻,不良反应发生率为5.00%;对照组患者中发生3例腹胀,2例腹泻,2例胸闷,1例心率加快,不良反应发生率为20.00%。观察组患者不良反应发生率明显低于对照组,差异有统计学意义(P<0.05)。
3 讨论
目前,主要采用手术或放化疗的方式治疗胃癌,但大部分患者发现时已经无手术或放化疗指征,或为复发/转移后无法耐受再次手术或放化疗,特别是老年患者,故临床上常采用中成药进行抗肿瘤治疗。
中医学认为,肿瘤是由于正气不足、邪毒侵入及人体脏腑功能失调引起的,通过驱邪扶正可在一定程度上改善病情。一旦正气得到有效补充,肿块可见缩小,并可帮助患者承受小剂量的放化疗[6-8]。艾迪注射液由斑蝥、人参、刺五加及黄芪等药材制成,能够驱邪扶正、清热消毒。其中人参有促进肝肾功能恢复及蛋白质合成的功能,有助于机体恢复;黄芪中的黄芪多糖则能够有效增强淋巴细胞的免疫功能[9]。现代医学证明,人参等能显著提升T淋巴细胞和B淋巴细胞的功能,促进细胞膜糖蛋白、白细胞介素的合成分泌,提高淋巴因子激活的杀伤细胞活性表达。另外,斑蝥素可抗肿瘤却不会引起骨髓抑制。研究结果显示,尽管艾迪注射液对晚期恶性肿瘤无明显临床作用,但可作为辅助药物降低放化疗的毒副作用,提高患者的生活质量。随着医学观念的变化,临床逐渐开始重视晚期胃癌患者的营养问题[10]。由营养不良引起的免疫功能下降、耐受性差等问题严重影响了患者的生活质量[11]。因此,给予晚期胃癌患者营养支持已成为多学科综合治疗的重要部分[12]。现阶段,胃癌患者的营养支持治疗包括肠内营养及肠外营养两种方式,其中肠内营养是指经胃肠道提供代谢需要的营养物质及其他各种营养素的营养支持方式[13]。而营养液与胃肠道黏膜直接接触有助于维持黏膜的屏障作用和完整性[14]。本研究结果显示,治疗后,观察组患者KPS评分、血清IgG及CD3+水平明显高于对照组;观察组患者的总有效率明显高于对照组;观察组患者脏器感染率、不良反应发生率明显低于对照组,上述差异均有统计学意义(P<0.05)。
综上所述,艾迪注射液联合肠内营养混悬液(TPF)治疗晚期胃癌的疗效显著,可降低患者脏器感染率,改善营养状况,且不良反应少。
参考文献
[1]戚姝娅,李国辉,樊冬鹤,等.艾迪注射液临床应用的适宜性研究[J].中国医院用药评价与分析,2017,17(6):738-741.
[2]王红永,周发祥.艾迪注射液联合替吉奥治疗晚期胃癌的临床疗效观察[J].中医临床研究,2015,15(14):21-22.
[3]罗继红.艾迪注射液联合替吉奥治疗晚期胃癌的临床疗效分析[J].基层医学论坛,2016,20(27):3788-3790.
[4]段锋.艾迪注射液联合化疗方案治疗晚期胃癌疗效观察[J].临床合理用药杂志,2016,9(2):55-56.
[5]张春宇.艾迪注射液联合替吉奥治疗晚期胃癌的临床效果观察[J].世界最新医学信息文摘:连续型电子期刊,2015,15(47):21-22.
[6]王永领,林王美,杨平.艾迪注射液联合化疗方案治疗晚期胃癌的临床效果[J].中国当代医药,2016,23(11):51-53.
[7]林斌.艾迪注射液联合中药对胃癌晚期患者的临床效果观察[J].中国当代医药,2016,23(34):139-141.
[8]刘君,温福刚,李彬.艾迪注射液联合化疗治疗晚期卵巢恶性肿瘤的临床效果[J].中国当代医药,2015,22(32):66-68.
[9]吴亭,李日彩.FOLFOX7方案联合艾迪注射液治疗晚期胃癌的效果及毒副反应[J].广东医学,2016,37(3):438-440.
[10] Silveira FL,Pacheco MT,Bodanese B,et al.Discrimination of non-melanoma skin lesions from non-tumor human skin tissues in vivo using Raman spectroscopy and multivariate statistics[J].Lasers Surg Med,2015,47(1):6-16.
[11] 房栋,蒋丽萍,顾敏,等.艾迪注射液联合化疗治疗老年进展期胃癌疗效及对免疫功能影响[J].现代中西医结合杂志,2016,25(36):4036-4038.
[12] de Almeida ML,Saatkamp CJ,Fernandes AB,et al.Estimating the concentration of urea and creatinine in the human serum of normal and dialysis patients through Raman spectroscopy[J].Lasers Med Sci,2016,31(7):1415-1423.
[13] 李永浩.加味异功散方联合艾迪注射液治疗中晚期胃癌临床研究[J].中国中医药信息杂志,2016,23(6):35-38.
[14] Saatkamp CJ,de Almeida ML,Bispo JA,et al.Quantifying crea-tinine and urea in human urine through Raman spectroscopy aiming at diagnosis of kidney disease[J].J Biomed Opt,2016,21(3):37001.

