MSCT在脓毒性肺栓塞诊治中的价值
刘庆旭,王唯伟,陈月芹
(济宁医学院附属医院影像中心,山东 济宁 272029)
脓毒性肺栓塞(septic pulmonary embolism,SPE)是指源于肺外感染引起的脓毒性栓子通过血液循环迁徙入肺组织,从而导致肺栓塞(或梗死)和局灶性肺脓肿的一种严重疾病,是肺栓塞中的少见类型[1],临床上极易误诊或延误诊断。国内外关于SPE的文献报道较少,现收集2012年1月至2015年12月我院收治的9例SPE的临床及相关影像资料进行分析总结,以明确MSCT在SPE诊治中的价值,提高对该病的认识。
1 资料与方法
1.1 一般资料 9例中,男6例,女3例;年龄15~85岁,平均(50.2±2.0)岁。原发灶为肝脓肿、肾周脓肿并肾衰竭各1例;颌面部感染导致血栓性颈静脉炎、左下肢深静脉炎合并血栓形成各1例;糖尿病并外伤后感染1例,食管癌、乳腺癌各1例,均行上腔静脉置管;急性髓细胞性白血病免疫抑制剂治疗后1例;细菌性心内膜炎1例。
1.2 SPE诊断标准 参考Cook等[2]采用的 SPE诊断标准:①影像学表现为局灶或多发性肺浸润;②存在可作为脓毒性栓子来源的活动性肺外感染灶;③排除其他可引起肺浸润影的疾病;④经有效的抗感染治疗,肺浸润影吸收。
1.3 仪器与方法 采用Simense Somatom Definition双源64层CT扫描仪。9例均行胸部CT平扫,范围自肺尖至肺底,扫描参数:120 kV,200~250 mAs,层厚、层距均为6mm,螺距0.875;其中2例加行HRCT,层厚、层距均为1mm。2例行增强扫描,层厚6mm,注射碘海醇(300 mgI/mL),剂量 85 mL,流率 3.5 mL/s;其中1例加行肺动脉CT血管成像(CTpulmonaryangiography,CTPA),层厚 1mm,注射碘海醇(300 mgI/mL),剂量 85 mL,流率 5 mL/s,在 Syngo.via 工作站进行后处理。
分析9例SPE的临床表现、血培养、MSCT征象及治疗过程,并由2名具有5年以上经验的影像诊断医师分别评价以下主要影像征象:①双肺病灶的分布、数目、形态、大小;②病灶的密度、边缘,有无“空气支气管征”、空洞、气囊,有无“滋养血管征”;③伴随改变,如胸腔积液、心包积液等。
2 结果
2.1 临床表现及血培养 临床表现为发热9例、咳嗽5例、呼吸困难4例、胸痛4例、咯血或痰中带血3例、低蛋白血症及贫血6例。经多次、反复血培养,1例白血病真菌培养阳性,病原体为曲霉菌;1例肾周脓肿血培养为金黄色葡萄球菌阳性,真菌培养为念珠菌阳性;1例肝脓肿血培养为克雷伯杆菌阳性;1例颌面部感染所致血栓性颈静脉炎血培养为星座链球菌阳性;糖尿病外伤后感染、食管癌、乳腺癌各1例,均行上腔静脉置管术后,血培养金黄色葡萄球菌阳性;1例细菌性心内膜炎及1例下肢深静脉炎并血栓形成患者血培养为阴性。
2.2 CT表现 9例均为2种以上病变共存,呈散在、多发分布,未见融合征象。①结节影:9例均可见双肺多发、大小不等的结节影(图1~3),共104个,90个位于胸膜下区,14个位于肺内;各叶均有分布,双肺上叶44个,右肺中叶15个,双肺下叶45个,最大直径31mm;结节边界尚清晰,未见毛刺征及胸膜凹陷征,其中14个结节内见空洞(图1a),较大者直径18mm,壁厚5~15mm,7个结节内见肺气囊,较大者直径7mm(图1b);33个结节灶见滋养血管与结节相连,多方向MIP显示部分滋养血管环绕结节灶(图2a,2b)。②楔形灶:9例均有楔形阴影,共47个,右肺上叶13个,右肺中叶6个,右肺下叶11个,左肺上叶11个,左肺下叶6个;病变尖端朝向肺门,以宽基底贴近胸膜,其中4个病灶内见空洞影,较大者直径9mm,20个楔形病变见滋养血管与其相连。③斑片状模糊影:7例可见肺内斑片状模糊阴影,共33个,其中16个病灶内见“空气支气管征”。④2例增强扫描示结节及部分楔形灶轻度强化。⑤4例见双侧胸腔积液,3例见心包积液。初次CT诊断时,9例中5例诊断为脓毒性肺栓塞,2例误诊为普通肺炎,1例误诊为乳腺癌肺转移,1例误诊为Wegener肉芽肿,误诊率约44.4%。
2.3 治疗及转归 所有患者均静脉使用抗生素,疗程2~4周。2例入院后给予青霉素类抗生素单药治疗4周;其余7例初始采用单一头孢菌素类或其他抗生素治疗方案,效果不佳,更换为万古霉素联合头孢菌素或青霉素类抗生素治疗,其中2例真菌感染联合氟康唑抗真菌药治疗。
除静脉使用抗生素外,所有患者均对原发感染灶进行积极治疗。4例及时拔出静脉内置管。1例先天性室间隔缺损患者采用室间隔缺损修补术,强心利尿,适时拔出心包纵隔引流管。1例肝脓肿及肾周脓肿患者及时行超声引导下穿刺引流术。
9例中7例行2次及以上MSCT随诊观察,7~14 d后复查5例肺内病灶减少,2例病灶增多,14~30 d复查,病灶数量减少(图3),而斑片灶增多、胸腔积液出现。综合治疗3~4周后所有患者出院,临床症状减轻或消失,5例出院后复查,2例病变基本消失,2例病变减少,炎症吸收后纤维索条形成,1例白血病患者双肺病变复发,较前片略增多。
3 讨论
SPE发病率较低,起病隐匿,早期若未有效控制,常导致快速进展、病情危重,甚至引发死亡。主要临床表现为发热、贫血、低蛋白血症等脓毒血症症状和呼吸困难、胸痛、咯血、咳嗽等血源性肺部感染症状及肺外感染等症状[3],但肺外感染与肺内病灶的因果关系在MSCT诊断前常被忽视,导致诊治延误。SPE常见病因包括感染性心内膜炎、牙源性感染、颌面部感染所致血栓静脉炎及中央静脉置管后感染、Lemierre综合征、肝脓肿、肾周脓肿、静脉应用毒品成瘾者或白血病、淋巴瘤等血液系统恶性病变免疫抑制剂治疗后改变等[4]。原发灶不同,SPE的病原菌也不同,感染性心内膜炎易出现草绿色链球菌感染,Lemierre综合征主要为厌氧菌,有静脉置管者则易出现葡萄球菌、革兰阴性菌感染。Chang等[5]报道肝脓肿所致SPE最常见的病原体为肺炎克雷伯杆菌,Sakuma等[6]报道90%以上白血病或淋巴瘤的SPE患者发现真菌栓子,其中曲霉菌最多见(20.8%),与本组血培养及真菌培养结果相近。SPE的早期发现和及时治疗对患者预后非常重要,若控制不良,可引发脑膜炎等疾病,威胁生命,仅依靠临床表现进行诊断作用有限,血培养常难以提供阳性结果,尤其在疾病早期;影像学表现具有一定的特征性,可为临床积极寻找原发灶,并维持有效治疗提供依据。
SPE患者胸部MSCT表现具有多发性、多形性及易变性,其以楔形灶、结节影为主,并主要分布于胸膜下区是其特征性表现。SPE病情反复、迁延,这与其发病机制及病理基础密切相关。①多发性。肺外原发感染灶内感染性栓子反复脱落,并随血流肺内播散,间断性栓塞不同节段的细小动脉分支,造成肺内病灶多发、反复[7]。本组分布于双侧上肺、右肺中叶及双下肺,与Lee等[8]研究相符,肺叶体积越大,病灶分布越多,本组病灶多集中分布在双肺上叶,右肺中下叶病灶数量较少;但因各肺叶体积大小不同,各叶间分布的差异并无统计学意义。②多形性。双肺多为2种以上形态的病灶共存,病灶内可见炎性坏死空洞,或因气管内黏液活瓣作用形成肺气囊[9];肺内血管进入病灶内部或环绕病灶周围形成“滋养血管征”[10],本组6例结节或楔形病灶周围见滋养血管影,MIP示其均与左心房相连,提示滋养血管为细小静脉,与Dodd等[10]研究结果一致。③易变性。SPE患者肺内病灶存在“先变大、变多,后缩小、减少”的特点,病情进展较快,早期肺内感染性栓塞灶局部血运障碍,导致血药浓度较难达到治疗标准,且炎症性栓子不断播散,肺内病灶进展较快,甚至呈进行性加重,此时极易引起临床医师对用药的正确性产生怀疑。SPE需坚持有效抗菌治疗至少4周以上,才能显示出治疗效果,且积极祛除原发感染灶也是治疗的关键[11-12]。本组2例治疗早期病灶未缓解,肺内病灶增多、增大,经足量、足疗程用药后得以改善。④周边性分布。SPE患者肺内病灶多以双肺外周区分布为主,这是由于炎症栓子数量多、体积小,多栓塞于末梢血管;本组86.5%(90/104)的结节及所有楔形灶分布于胸膜下区,与 Iwasaki等[13]研究相符,而斑片状渗出灶以肺野内中带分布为主,其数目较少,考虑为合并的肺炎,尚未形成脓毒栓子。⑤少融合。本组肺内病灶呈散在、局灶性分布,未见明显融合趋势。此外,本组亦可见感染所致的伴随症状,如胸水、心包积液,无特异性。值得注意的是,因栓子体积小,普通CT平扫及增强扫描很难发现,仅能通过上述间接征象对SPE进行诊断,缺乏直观依据;CT肺动脉成像能够很好地显示小血管栓塞的位置和程度,对临床怀疑SPE的患者发现小栓子有潜在的临床应用价值,值得进一步探究。
因SPE起病隐匿且多合并其他疾病,易造成误诊。本组4例初次CT诊断误诊,其中2例误诊为肺炎,回顾性分析发现双肺除具有炎症特征性的片状、团片状高密度影外,还有胸膜下散在分布的结节、楔形灶及滋养血管影,有助于两者鉴别。1例误诊为乳腺癌肺转移,但转移瘤双肺多不表现为楔形灶,且患者感染症状不显著,可与SPE鉴别。1例误诊为Wegener肉芽肿,也可表现为胸膜下多发结节、楔形灶,可见“滋养血管征”,但其结节灶边缘的“毛刺征”及“胸膜凹陷征”是与SPE鉴别的要点。
SPE的临床治疗策略主要包括抗感染、控制肺外原发感染灶、呼吸支持和防治并发症。控制或解除肺外感染灶是本病治疗的关键,包括及时拔出颈静脉置管,引流肝脓肿、肾周脓肿感染灶,矫治先天性心脏结构及赘生物清除术等。本组1例因牙周疼痛未引起重视,导致肺内病变快速进展,后经CT诊断后有效治疗原发灶,使病情得到控制。此外,抗菌药物的早期、有效使用对SPE的转归及预后至关重要,早期经验性治疗应采用以抗葡萄球菌属细菌为主的联合抗生素治疗方案,如青霉素类联合糖肽类(万古霉素)抗感染治疗,并依据痰涂片、痰培养、血培养及药敏试验等病原学检查结果进一步调整治疗方案;如抗生素治疗效果欠佳,应注意是否合并真菌感染,必要时可行经验性抗真菌治疗;因SPE具有反复感染、病程长、病情复杂的特点,故有效抗菌治疗应至少持续4周以上[12,14]。本组2例采用青霉素类抗生素单药治疗;7例采用青霉素或头孢菌素联合万古霉素,其中2例真菌感染采用抗生素与抗真菌药(氟康唑)联合治疗;9例治疗时间2~4周。SPE常合并糖尿病或高血压,有效控制伴发疾病有利于SPE的治疗;呼吸功能衰竭患者应及时给予机械通气治疗。溶栓治疗极有可能造成感染进一步播散及出血[8],除非严重影响血流动力学的大面积感染性肺栓塞,否则不主张采用溶栓治疗。
综上所述,SPE临床少见但并不罕见,MSCT提示双肺多发结节、楔形灶伴不同程度空洞形成,并以胸膜下区分布为主的特点,对其早期诊断并提示临床积极寻找原发灶具有重要价值;临床表现结合特征性影像表现对SPE的早期确诊有重要意义。此外,积极治疗肺外原发感染灶,足量、足疗程的抗生素治疗及有效的呼吸支持,可使多数患者预后良好[1]。

图1 男,80岁,肾周脓肿,上腔静脉置管后,脓毒性肺栓塞 图1a 右肺下叶结节灶,其内见空洞影图1b 右肺上叶楔形病灶,并见滋养血管进入其内,其内见气囊影

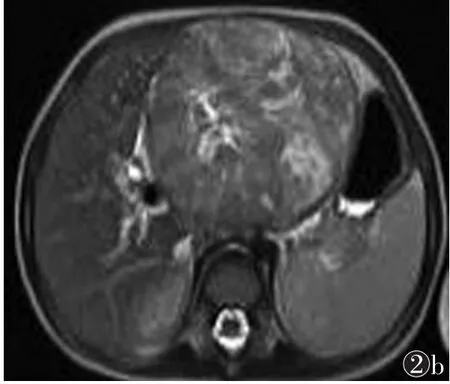
图2 男,38岁,糖尿病,外伤后感染,上腔静脉置管后,诊断为脓毒性肺栓塞 图2a,2b CT增强扫描后,MIP示滋养血管进入结节,滋养血管为肺静脉
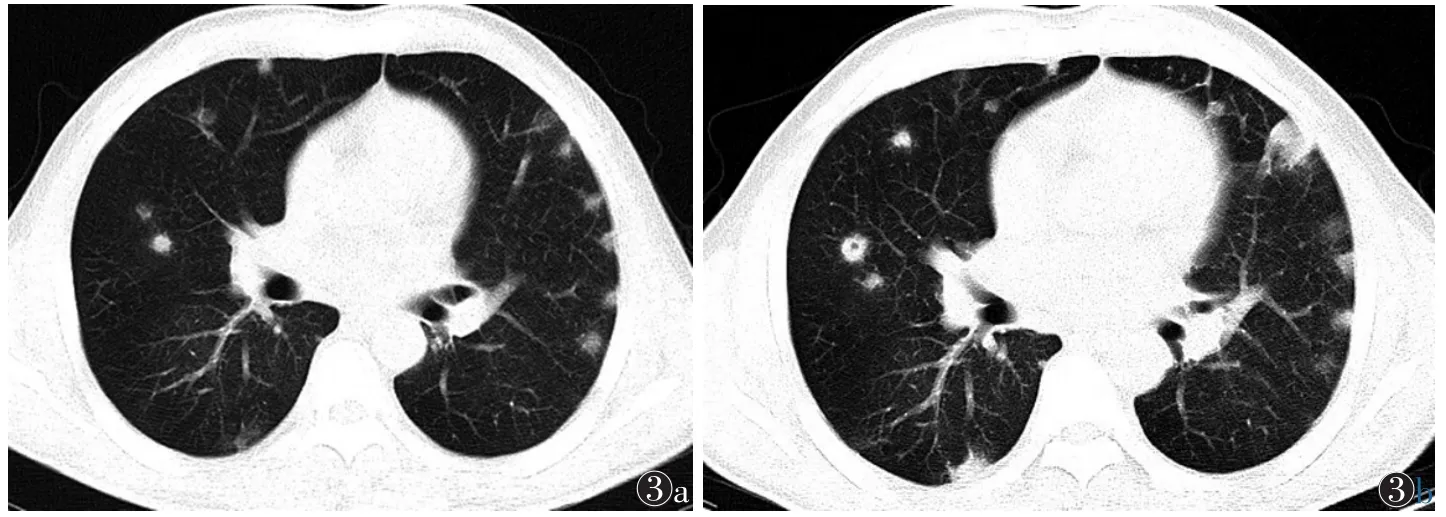
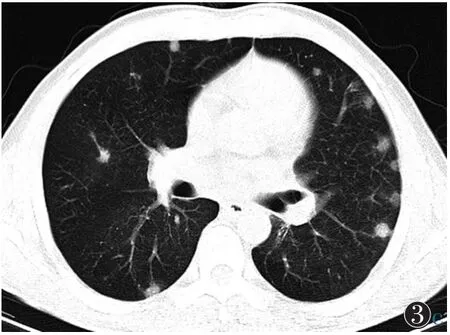
图3 女,51岁,颌面部感染,菌血症,诊断为脓毒性肺栓塞 图3a 双肺多发胸膜下及肺内结节,结节周围无毛刺及胸膜牵拉征 图3b 15 d后复查,结节增大、增多,部分呈胸膜下楔形灶 图3c 1个月后复查,双肺结节及楔形灶数量减少、体积减小

