不同生境下空心莲子草响应模拟昆虫采食的生长和化学防御策略
高芳磊,郭素民,闫 明,李钧敏,于飞海,*
1 北京林业大学自然保护区学院,北京 100083 2 浙江省植物进化生态学与保护重点实验室,台州学院,台州 318000 3 山西师范大学生命科学学院,临汾 041004
植物和昆虫是生态系统的重要组分[1- 2],深刻地影响生态系统的结构和功能[3- 4]。昆虫采食能够调节植物群落的结构、组成和功能[5],而植物在受到昆虫采食后可通过改变自身的形态、结构及生理生化反应进行一系列的防御[6- 8]。植物与昆虫的互作关系及其演化反映了许多重要的生态和进化生物学问题,其中的规律对生物多样性保护[9]、入侵植物防控[10]、害虫有效控制[11]及农林牧业的可持续发展有重要的参考价值[1]。
随着全球经济的发展、人类活动的增加和对环境干扰的加剧,外来生物入侵已经成为一个全球性的问题[12]。植物入侵严重影响入侵地的生物多样性及环境、经济和人类健康[13- 14]。外来植物进入入侵地后,虽然可能逃离了原产地专性天敌的控制,但是仍需要面对入侵地广食性天敌的采食[15- 16]。一般而言,植物响应昆虫取食主要有两种策略:(1)耐受性策略(生长策略),即植物在被昆虫取食伤害后,为了维持自身的适合度而进行补偿性生长[17- 19];(2)抗性策略(防御策略),即植物在被昆虫取食伤害后,通过改变形态和结构的物理防御和/或产生有毒物质的化学防御等来降低昆虫对它的取食偏好,甚至在昆虫采食后导致其发育延缓和降低,从而影响昆虫的种群数量[20- 21]。许多研究表明,植物的生长和防御之间常存在着权衡,即植物增加对昆虫采食防御的投入会降低其生长速率[15,22- 25]。
植物所处的环境是异质性的,同一种植物的不同种群往往生长在不同的生境中[16,26- 27]。例如,在我国造成严重危害的外来克隆植物——空心莲子草(Alternantheraphiloxeroides(Mart.) Griseb.)既可以在水生生境中快速生长,也可以在陆生生境和水陆两栖生境健康生长[28- 29]。马瑞燕等[30]研究发现引入中国的原产地专性天敌对水生生境的空心莲子草种群有显著的抑制作用,但对陆生生境空心莲子草种群影响却不显著。由于不同生境下的植物种群面临的昆虫采食压力可能不同,那么植物对昆虫采食的生长-防御权衡关系可能会不同。例如,Zou等[31]研究了乌桕原产地和入侵地种群生长和防御的关系,发现存在显著的权衡关系,即乌桕原产地种群具有较高的防御能力和较低的生长速率,而入侵地种群具有较低的防御能力和较高的生长速率。耿旭等[32]通过同质园种植实验研究了空心莲子草原产地(阿根廷)种群和入侵地(美国)种群生长和防御变化,发现入侵地种群生物量和三萜皂苷含量均显著增加,说明生长和防御不存在权衡关系。然而,到目前为止,国内外有关生境,尤其是同一入侵地的不同生境对入侵植物生长-防御权衡关系影响的研究仍相对较少。
本研究以入侵我国的外来克隆植物——空心莲子草为研究对象,分别选择生长在水生生境、水陆两栖生境和陆生生境中的无性个体(分株),通过去叶处理模拟昆虫采食,分析不同生境下空心莲子草对模拟昆虫采食处理的生长及化学防御响应的差异。本文拟回答以下科学问题:1)不同生境下模拟昆虫采食对空心莲子草生长的影响是否存在差异?2)不同生境下模拟昆虫采食对空心莲子草化学防御物质含量的影响是否存在差异?3)生境是否影响昆虫采食介导的空心莲子草生长-化学防御权衡关系?
1 材料与方法
1.1 研究物种
空心莲子草又名喜旱莲子草,是多年生草本植物,茎基部匍匐,上部伸展,中空,节部常有不定根,叶对生,原产于南美洲,现在广泛的分布于美国、澳大利亚、中国等国家[33- 34]。空心莲子草在20世纪30年代最早作为饲料引入中国,80年代以后大面积扩散蔓延。目前,黄河流域以南地区已广泛分布[35]。空心莲子草被我国环保局列为最具危害性的16种杂草之一[36]。在我国空心莲子草很少产生种子,主要通过无性繁殖进行扩散[37],其可以生长在水生环境、陆生环境和水陆过渡区(水陆两栖)环境,比如:灌溉沟渠、河岸和稻田等[29]。空心莲子草在入侵地受到全寄生植物南方菟丝子寄生时会改变自身的生长-防御策略,减少营养生长而将更多的资源投向克隆繁殖,同时增强防御投入,以有利于后代的生存与繁衍[23]。
1.2 温室控制实验
实验材料于2013年5月初采集自浙江省临海市郊外水沟(水生生境)、农田里(陆生生境)和河道消落带(水陆两栖生境),每个生境分别采集20株个体,个体间间距在3m以上。土壤基质是由泥炭土、干净的河沙以及蛭石按照6∶3∶1的比例均匀混合而成。我们将土壤基质装入体积为 100mL的容器中,然后在每个容器内添加0.08g的缓释肥(Scotts Osmocote, N∶P∶K=20∶20∶20, The Scotts Miracle-Gro Company, Marysville, OH, USA)。
2013 年5月15日,将上述采集的水生、水陆两栖和陆生3种生境下的空心莲子草分别剪取若干粗细长度一致的茎段作为营养繁殖体,扦插于上述装有基质的容器内中;每个容器内种植一个茎段,每一生境共扦插40盆,3种生境共120盆。将所有扦插植物个体放置在蓝框内(40cm×30cm×15cm),并放入步入式人工智能气候室内(宁波江南仪器厂制造,浙江宁波)进行培养。对于采集自水生生境中的植物个体,将其培养于水中。对于采集自陆生环境中的植株,维持其正常浇水。对于采集自水陆两栖生境的个体,在第一天将其置于水中培养,第二天正常浇水,第三天再放入水中,第四天再正常浇水,以此类推,直到实验结束。培养15d后,开始进行模拟昆虫采食处理。对每个生境的空心莲子草植株,随机选择20株,去除50%的叶子,而对剩余的20株个体不进行去叶处理(对照)。以后,每隔10d对空心莲子草进行人工去叶,总计去叶处理6次。实验持续60d后,对植物进行测量和收获。
1.3 数据收集
实验过程中三株植物发生死亡,因此最终收获了117株植物。将每株植物分为根、茎和叶,放入纸袋,105℃杀青0.5h后,于70℃烘箱烘干至恒重,分别称量每部分的生物量。将烘干后的空心莲子草茎和叶用高速研磨仪磨成粉末混合均匀,过0.25mm的筛,用于生理指标的测定。单宁含量的测定参考Mole等[38]的方法,总酚含量的测定采用Folin-Denis法[39],木质素含量的测定采用浓硫酸法[40]。
1.4 数据分析
利用双因素方差分析,分析生境和模拟昆虫采食处理对空心莲子草根、茎、叶、总生物量、根生物量分配、茎生物量分配、叶生物量分配、根冠比、单宁含量、总酚含量和木质素含量的影响。然后,利用Tukey HSD对不同生境下各指标进行多重比较。运用回归分析,分析在模拟采食和不采食情况下空心莲子草总生物量与单宁、总酚以及木质素的关系。所有数据处理均采用PASW Statistics 20.0完成。
2 结果
2.1 模拟昆虫采食处理和生境对空心莲子草生长的影响
模拟昆虫采食和生境对空心莲子草的根、茎、叶和总生物量有显著影响(表1)。与对照相比,模拟昆虫采食处理显著降低了空心莲子草的根、茎、叶和总生物量。空心莲子草根、茎和总生物量在陆生生境下显著高于水陆两栖生境和水生生境,茎生物量在水生环境下显著高于水陆两栖生境,而根生物量、叶生物量和总生物量在水陆两栖生境和水生生境下差异不显著(图1)。
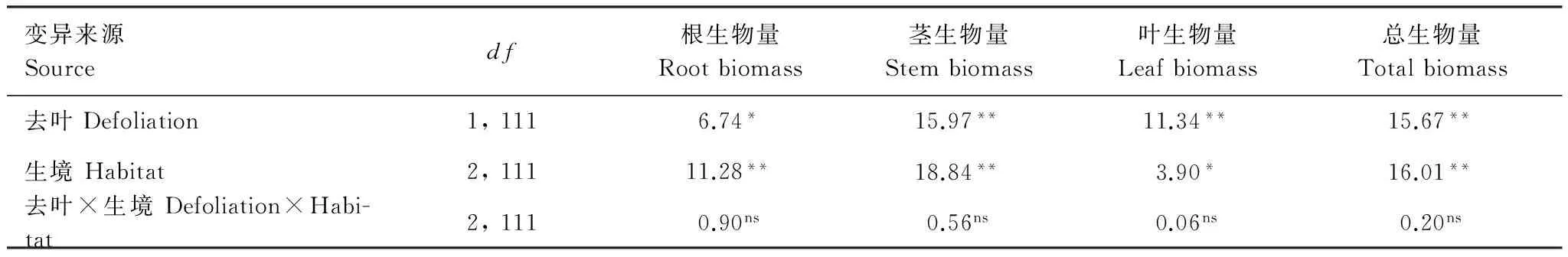
表1 模拟昆虫采食(去叶)处理和生境对空心莲子草生物量影响的双因素方差分析结果
显著水平:**P<0.01;*P<0.05; nsP> 0.05
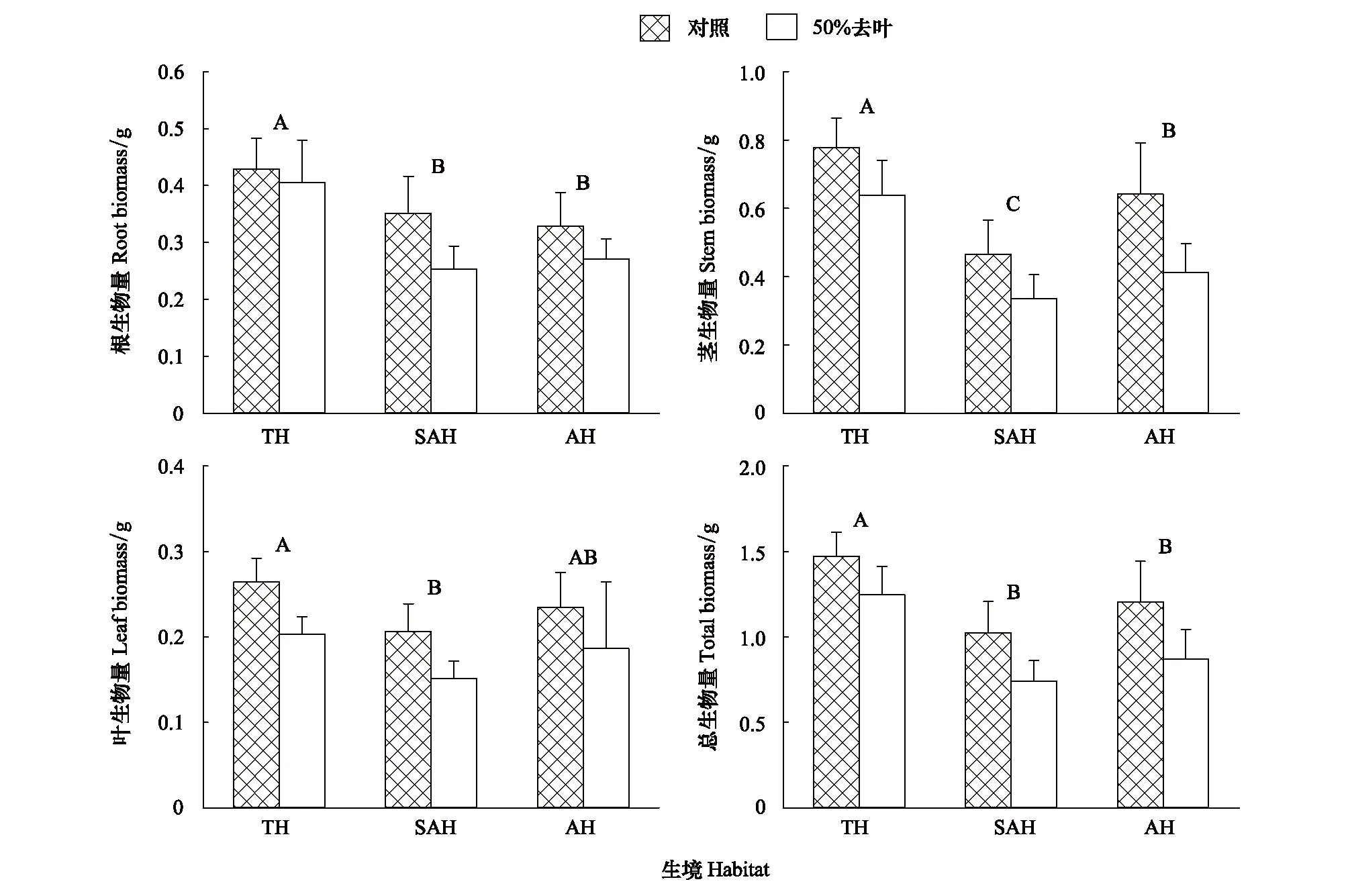
图1 不同生境下模拟采食对空心莲子草生物量的影响Fig.1 Effects of defoliation on biomass of Alternanthera philoxeroides under different habitats图中数据为均值+标准误,相同大写字母代表在P = 0.05无显著差异。TH: 陆生生境,Terrestrial habitats; SAH: 水陆两栖生境,Semi-aquatic habitats; AH: 水生生境,Aquatic habitats
2.2 模拟昆虫采食处理和生境对空心莲子草生物量分配的影响
模拟昆虫采食对根冠比、根、茎和叶生物量分配影响均不显著,但生境对这些变量均有显著的效应(表2)。陆生生境空心莲子草根冠比显著低于水陆两栖生境下,而与水生生境下根冠比差异不显著。陆生生境和水生生境下根生物量分配显著低于水陆两栖生境,而陆生生境和水生生境空心莲子草茎生物量分配显著高于水陆两栖生境。陆生生境空心莲子草叶生物量分配显著低于水生生境和水陆两栖生境(图2)。
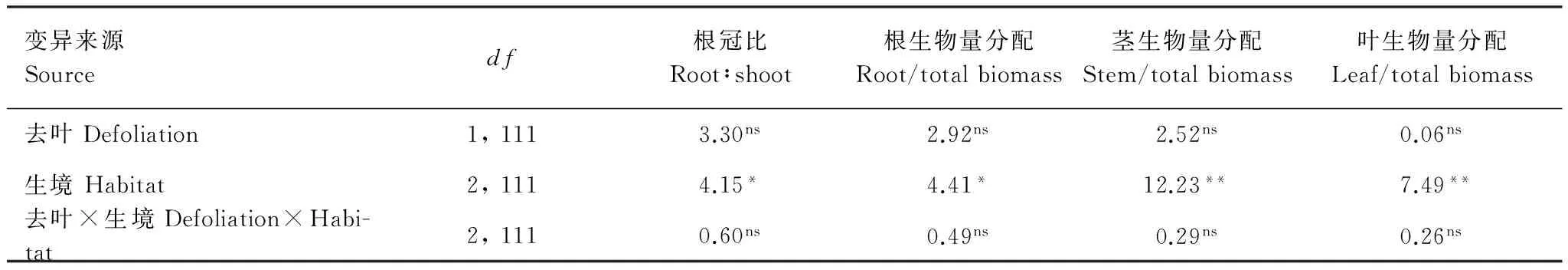
表2 模拟昆虫采食(去叶)处理和生境对空心莲子草生物量分配影响的双因素方差分析结果
显著水平:**P<0.01;*P<0.05; nsP> 0.05
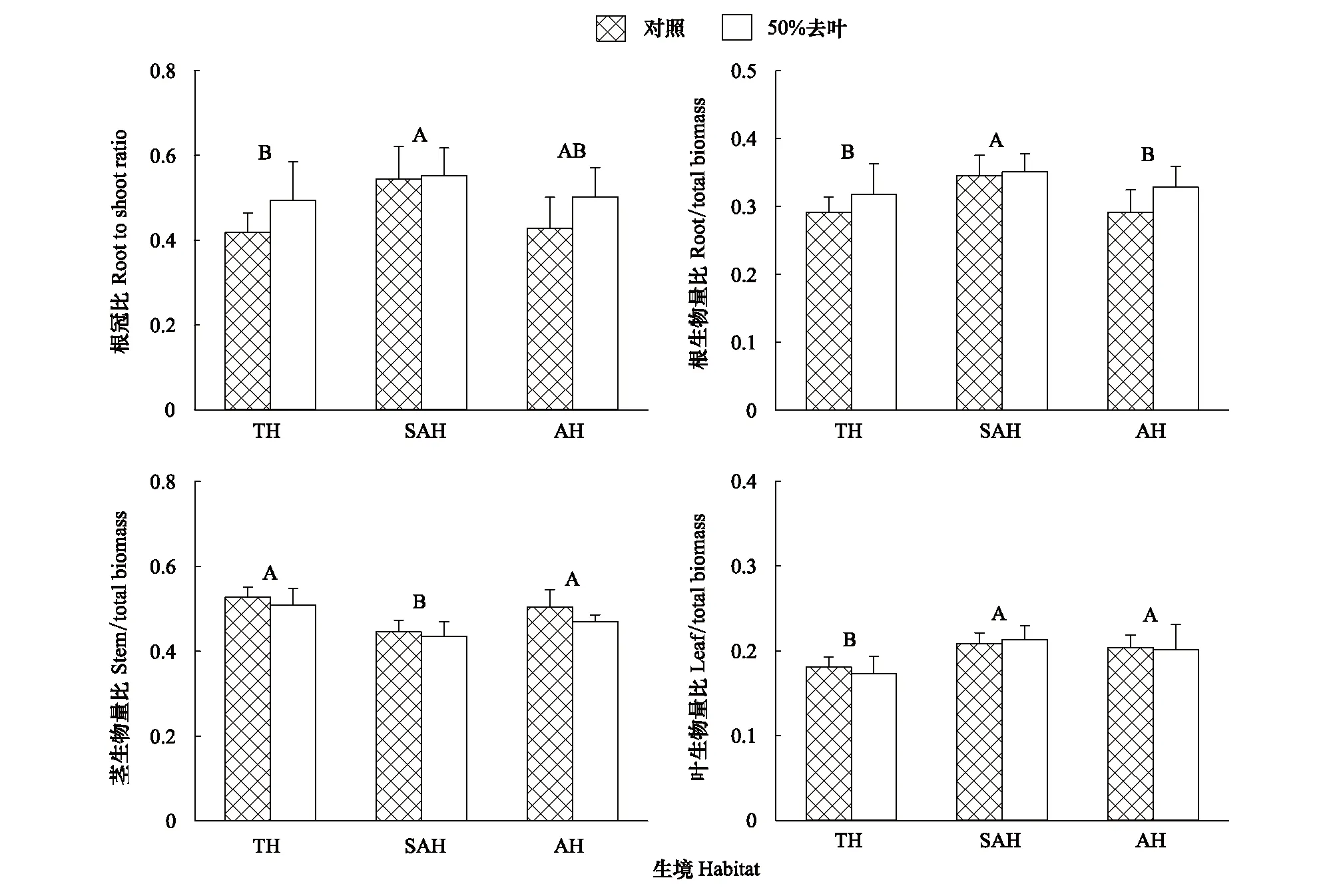
图2 不同生境空心莲子草响应模拟昆虫采食处理生物量分配的变化Fig.2 Effects of defoliation on biomass allocation of Alternanthera philoxeroides under different habitats图中数据为均值+标准误,相同字母代表在P=0.05无显著差异
2.3 模拟昆虫采食和生境对空心莲子草化学防御物质的影响
模拟昆虫采食对空心莲子草单宁和总酚含量影响不显著,但却显著降低了木质素含量。生境不影响空心莲子草木质素含量,但显著影响单宁含量和总酚含量。在陆生生境下空心莲子草单宁含量显著高于水陆两栖生境和水生生境,总酚含量显著高于水陆两栖生境(表3,图3)。
2.4 空心莲子草总生物量与次生代谢产物含量的关系
在对照(不去叶)和去叶处理下,空心莲子草单宁含量与总生物均存在显著正相关。在去叶处理下,空心莲子草总酚含量与总生物量之间存在显著者性负相关,而在对照下总酚含量与总生物量之间无显著相关关系。空心莲子草木质素含量与总生物量无显著相关关系(图4)
表3模拟昆虫采食处理和生境对空心莲子单宁、总酚和木质素含量影响的双因素方差分析结果
Table3Two-wayANOVAresultsofeffectsofdefoliationandhabitatonconcentrationoftannin,phenolandligninofAlternantheraphiloxeroides

变异来源Sourcedf单宁含量Tanninconcentration总酚含量Totalphenolconcentration木质素含量Ligninconcentration去叶Defoliation1,1111.64ns0.43ns9.00**生境Habitat2,11128.30**3.48*0.82ns去叶×生境Defoliation×Habitat2,1110.11ns1.07ns2.74ns
显著水平:**P<0.01;*P<0.05; nsP> 0.05
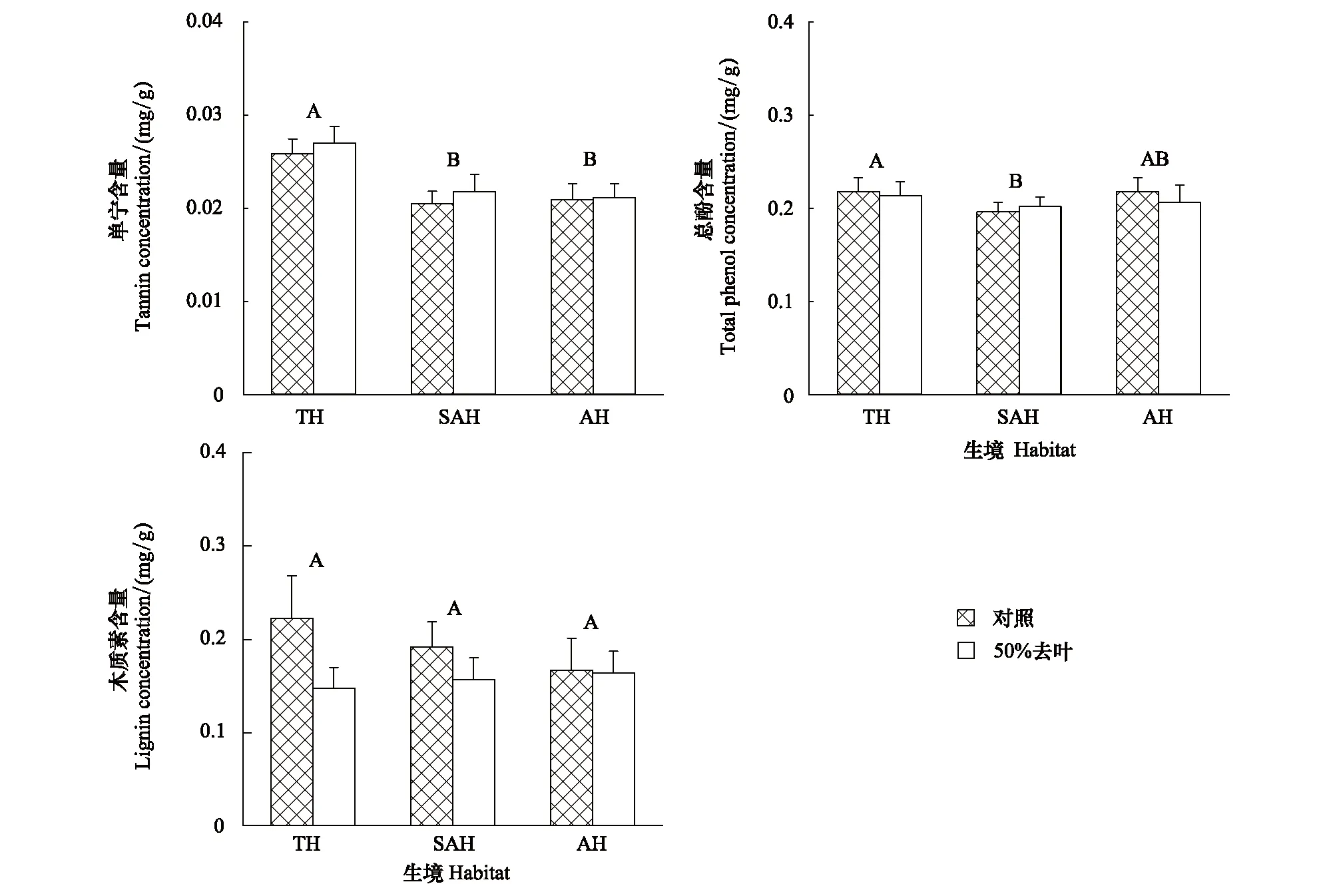
图3 不同生境空心莲子草响应模拟昆虫采食处理的化学防御物质变化Fig.3 Effects of defoliation on concentrations of tannin, phenols and lignin of Alternanthera philoxeroides under different habitats图中数据为均值+标准误,相同字母代表在P=0.05无显著差异
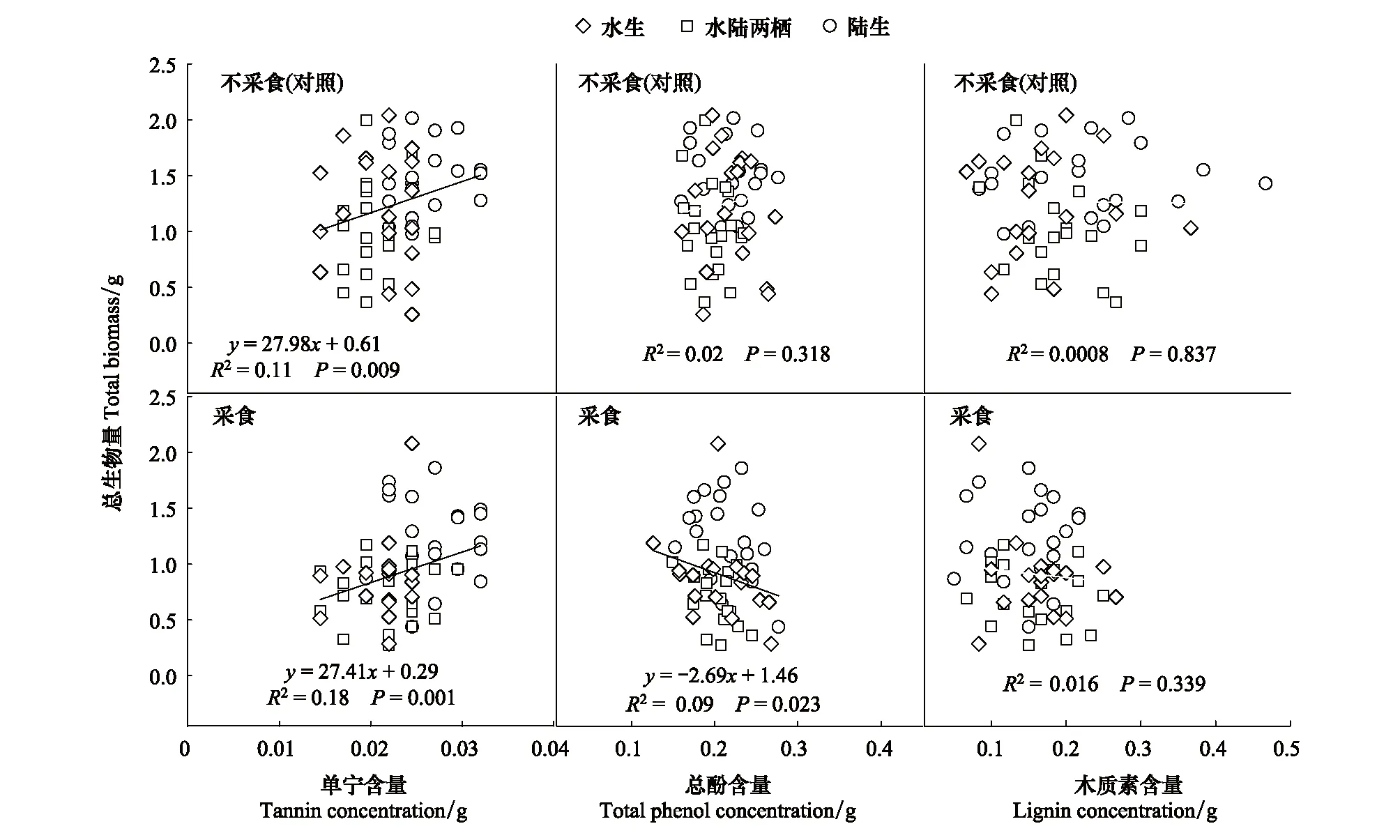
图4 对照和采食情况下空心莲子草生物量和单宁含量、总酚含量和木质素含量的关系Fig.4 Relationships between total biomass and concentrations of tannin, phenols and lignin of Alternanthera philoxeroides. Under the control and defoliation
3 讨论
3.1 不同生境下空心莲子草生长对模拟昆虫采食处理的响应
生物量是植物适合度的重要指标之一,高生物量和相对生长率将有利于入侵植物快速占领生境空间,进而成功入侵[41]。模拟昆虫采食处理均显著抑制了空心莲子草根、茎、叶和总生物量,这与郭伟等[42]的研究结果相似,表明昆虫取食可以显著抑制空心莲子草的生长,减弱其入侵性。生物量分配是植物适应不同环境胁迫的重要生活史对策,植物可通过改变地上部分(茎、叶)和地下部分(根)光合产物的分配,来提高自身的竞争能力,获得更多的土壤养分或光资源以适应多样化的生境[43]。研究发现,尽管不同生境下空心莲子草的生物量分配存在一定的差异,但模拟昆虫采食处理对空心莲子草生物量分配影响不显著。Sun等[44]采通过控制土壤含水量来模拟陆生生境、水陆两栖生境和水生生境,并对空心莲子草进行不同强度的模拟昆虫采食处理,发现水分与模拟昆虫采食处理对空心莲子草的生物量分配产生了显著影响。然而,该研究中的空心莲子草均来自同一生境(武汉阅马场),此外,并未考虑长期环境的效应。
3.2 不同生境下空心莲子草防御物质对模拟昆虫采食处理的响应
次生代谢产物是植物体内重要的防御物质[16]。比如,单宁作为植物体内的一种有效的化学防御物质,不仅可以抵御病原体的侵害而且可使植物具有苦涩的味道降低草食动物与昆虫的采食[45]。酚类也是植物体内重要的化学防御物质,酚类在植物体内的积累有利于促进植物之间的相互交流,有助于植物进行主动防御[46]。本研究表明,模拟昆虫采食显著降低了木质素含量,而对单宁和总酚的含量影响均不显著。研究表明,空心莲子草在响应南方菟丝子寄生时,其体内的单宁、总酚和三萜皂苷含量显著升高[23],而乌桕入侵地种群防御专食性昆虫的抗性物质(单宁)含量显著低于原产地种群,而入侵地种群和原产地种群防御广食性昆虫的抗性物质(类黄酮)含量无显著差异[47]。本研究与以上研究不同的原因可能是本研究采用的是去叶处理,而真实的昆虫采食可能是一个缓慢的持续的伤害过程,这种持续过程才有利于诱发植物的茉莉酸防御途径,激发次生代谢产物的生成和积累;因此,人工去叶处理后,应立即喷洒一定浓度的茉莉酸溶液,诱导植物的防御反应,确保和真实昆虫采食的一致性。本研究结果显示陆生生境下空心莲子草单宁含量显著高于水陆两栖生境和水生生境;陆生生境空心莲子草总酚含量显著高于水陆两栖生境,与水生生境差异不显著;木质素在各生境下差异均不显著。耿旭彦[32]也发现入侵地空心莲子草相比于原产地三萜皂苷含量显著提高。陆生生境相对于水生生境环境条件更为复杂,空心莲子草在陆生生境下可能面对更多的采食者,可能采取增加单宁和总酚含量的策略来适应陆地生境。因此,空心莲子草在陆生生境下对昆虫采食的抵抗性可能强于水生生境和水陆两栖生境。但本研究还发现不同生境与人工去叶的交互作用对单宁、总酚和木质素含量均没有显著影响,表明空心莲子草响应人工去叶的防御物质的变化受生境的影响不大。这可能与空心莲子草对生境的适应时间长短有关。
3.3 不同生境下空心莲子草生长-防御权衡对模拟昆虫采食处理的响应
植物的生长与防御之间往往存在着权衡[48]。在逆境环境下,如受到食草动物和病原体等生物因子的攻击,或是受到寒冷、干旱等非生物因子的胁迫时,可以通过减少对生长的投资,增加次生代谢产物的积累来增强对生物与非生物因子胁迫的防御[49- 50]。酚类是植物体内促进植物之间的相互交流,增强主动防御的次生代谢产物[46]。在对照下,空心莲子草总酚含量与总生物量之间不存在显著者性相关,但在模拟昆虫采食处理条件下,空心莲子草总酚含量与总生物量之间存在显著者性负相关,表明人工去叶条件下,空心莲子草减少生长,增加总酚含量,增强防御能力。这一结果与郭素民等[23]发现的空心莲子草响应南方菟丝子寄生的生长-防御权衡策略是相似的:南方菟丝子寄生后,空心莲子草可改变生长-防御权衡策略,使总生物量下降,次生代谢产物含量增加,重新将更多的资源投入到防御,减少对生长的投资。另外,空心莲子草总生物量与单宁含量存在显著正相关。耿旭彦[32]通过同质园种植的方式研究了空心莲子草入侵地种群和原产地种群防御策略的进化,发现入侵地空心莲子草个体生物量增加,且对泛化天敌的防御投入增加。本研究与该研究结果类似,表明不同物种不同次生代谢物其防御功能可能不同,从而对不同处理的响应也存在不同。进一步的研究需更加准确定量化学防御物质的含量,并且要区分防御性化学物质的种类,以更深入探讨入侵植物的生长-防御的权衡策略的普遍性。另外,不同生境下,基于单宁、总酚和木质素的空心莲子草的生长-防御权衡虽存在相似的趋势,但生物量与其含量之间的相关性并不存在显著性意义(结果略),这也反映了空心莲子草响应人工去叶的影响受到生境的影响较小。
参考文献(References):
[1] 王琛柱, 钦俊德. 昆虫与植物的协同进化: 寄主植物-铃夜蛾-寄生蜂相互作用. 昆虫知识, 2007, 44(3): 311- 319.
[2] Erwin A C, Züst T, Ali J G, Agrawal A A. Above-ground herbivory by red milkweed beetles facilitates above-and below-ground conspecific insects and reduces fruit production in common milkweed. Journal of Ecology, 2014, 102(4): 1038- 1047.
[3] Post E, Pedersen C. Opposing plant community responses to warming with and without herbivores. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(34): 12353- 12358.
[4] Johnson S N, Mitchell C, McNicol J W, Thompson J, Karley A J. Downstairs drivers-root herbivores shape communities of above-ground herbivores and natural enemies via changes in plant nutrients. Journal of Animal Ecology, 2013, 82(5): 1021- 1030.
[5] 李倬锴, 王煜, 金涛, 何俊, 王磊, 董慧琴, 蔡星星, 潘晓云. 入侵地喜旱莲子草的昆虫群落特征与天敌种类. 陕西林业科技, 2008, (4): 6- 10.
[6] 张泽彬, 马青, 黄金才, 梁育兴. 昆虫与植物协同进化的研究进展. 湖南林业科技, 2010, 37(5): 60- 62, 66- 66.
[7] Wang M G, Biere A, Van der Putten W H, Bezemer T M. Sequential effects of root and foliar herbivory on aboveground and belowground induced plant defense responses and insect performance. Oecologia, 2014, 175(1): 187- 198.
[8] Huang W, Siemann E, Xiao L, Yang X F, Ding J Q. Species-specific defence responses facilitate conspecifics and inhibit heterospecifics in above-belowground herbivore interactions. Nature Communications, 2014, 5: 4851.
[9] Zhong Z W, Wang D L, Zhu H, Wang L, Feng C, Wang Z N. Positive interactions between large herbivores and grasshoppers, and their consequences for grassland plant diversity. Ecology, 2014, 95(4): 1055- 1064.
[10] Tito R, de la Torre-Mayorga F. Effects of an aphid pest on an invasive plant in the Peruvian Andes. Plant Ecology, 2016, 217(7): 817- 823.
[11] Mathur V, Wagenaar R, Caissard J C, Reddy A S, Vet L E M, Cortesero A M, van Dam N M. A novel indirect defence in Brassicaceae: Structure and function of extrafloral nectaries inBrassicajuncea. Plant, Cell & Environment, 2013, 36(3): 528- 541.
[12] Gallien L, Altermatt F, Wiemers M, Schweiger O, Zimmermann N E. Invasive plants threaten the least mobile butterflies in Switzerland. Diversity and Distributions, 2017, 23(2): 185- 195.
[13] 冯玉龙, 廖志勇, 张茹, 郑玉龙, 李扬苹, 类延宝. 外来入侵植物对环境梯度和天敌逃逸的适应进化. 生物多样性, 2009, 17(4): 340- 352.
[14] Yu H, Yu F H, Miao S L, Dong M. HoloparasiticCuscutacampestrissuppresses invasiveMikaniamicranthaand contributes to native community recovery. Biological Conservation, 2008, 141(10): 2653- 2661.
[15] Wang Y, Huang W, Siemann E, Zou J W, Wheeler G S, Carrillo J, Ding J Q. Lower resistance and higher tolerance of invasive host plants: biocontrol agents reach high densities but exert weak control. Ecological Applications, 2011, 21(3): 729- 738.
[16] Wang Y, Siemann E, Wheeler G S, Zhu L, Gu X, Ding J Q. Genetic variation in anti-herbivore chemical defences in an invasive plant. Journal of Ecology, 2012, 100(4): 894- 904.
[17] Fornoni J. Ecological and evolutionary implications of plant tolerance to herbivory. Functional Ecology, 2011, 25(2): 399- 407.
[18] Wang P, Li H, Pang X Y, Wang A, Dong B C, Lei J P, Yu F H, Li M H. Clonal integration increases tolerance of a phalanx clonal plant to defoliation. Science of the Total Environment, 2017, 593- 594: 236- 241.
[19] Liu H D, Yu F H, He W M, Chu Y, Dong M. Clonal integration improves compensatory growth in heavily grazed ramet populations of two inland-dune grasses. Flora-Morphology, Distribution, Functional Ecology of Plants, 2009, 204(4): 298- 305.
[20] Orians C M, Ward D. Evolution of plant defenses in nonindigenous environments. Annual Review of Entomology, 2010, 55: 439- 459.
[21] Gadd M E, Young T P, Palmer T M. Effects of simulated shoot and leaf herbivory on vegetative growth and plant defense inAcaciadrepanolobium. Oikos, 2001, 92(3): 515- 521.
[22] Strauss S Y, Rudgers J A, Lau J A, Irwin R E. Direct and ecological costs of resistance to herbivory. Trends in Ecology & Evolution, 2002, 17(6): 278- 285.
[23] 郭素民, 李钧敏, 李永慧, 闫明. 空心莲子草响应南方菟丝子寄生的生长-防御权衡. 生态学报, 2014, 34(17): 4866- 4873.
[24] Fineblum W L, Rausher M D. Tradeoff between resistance and tolerance to herbivore damage in a morning glory. Nature, 1995, 377(6549): 517- 520.
[25] Leimu R, Koricheva J, Larsson S. A meta-analysis of tradeoffs between plant tolerance and resistance to herbivores: combining the evidence from ecological and agricultural studies. Oikos, 2006, 112(1): 1- 9.
[26] Luo F L, Chen Y, Huang L, Wang A, Zhang M X, Yu F H. Shifting effects of physiological integration on performance of a clonal plant during submergence and de-submergence. Annals of Botany, 2014, 113(7): 1265- 1274.
[27] Lu H Z, Liu W Y, Yu F H, Song L, Xu X L, Wu C S, Zheng Y L, Li Y P, Gong H D, Chen K, Li Su, Chen X, Qi J H, Lu S G. Higher clonal integration in the facultative epiphytic fernSelligueagriffithianagrowing in the forest canopy compared with the forest understorey. Annals of Botany, 2015, 116(1): 113- 122.
[28] Wang N, Yu F H, Li P X, He W M, Liu J, Yu G L, Song Y B, Dong M. Clonal integration supports the expansion from terrestrial to aquatic environments of the amphibious stoloniferous herbAlternantheraphiloxeroides. Plant Biology, 2009, 11(3): 483- 489.
[29] Dong B C, Alpert P, Zhang Q, Yu F H. Clonal integration in homogeneous environments increases performance ofAlternantheraphiloxeroides. Oecologia, 2015, 179(2): 393- 403.
[30] 马瑞燕, 王韧. 喜旱莲子草在中国的入侵机理及其生物防治. 应用与环境生物学报, 2005, 11(2): 246- 250.
[31] Zou J W, Siemann E, Rogers W E, Dewalt S J. Decreased resistance and increased tolerance to native herbivores of the invasive plantSapiumsebiferum. Ecography, 2008, 31(5): 663- 671.
[32] 耿旭彦. 入侵种喜旱莲子草防御策略及资源利用效率的进化[D]. 上海: 复旦大学, 2013.
[33] Julien M H, Skarratt B, Maywald G F. Potential geographical distribution of alligator weed and its biological control byAgasicleshygrophila. Journal of Aquatic Plant Management, 1995, 33: 55- 60.
[34] Yu F H, Wang N, Alpert P, He W M, Dong M. Physiological integration in an introduced, invasive plant increases its spread into experimental communities and modifies their structure. American Journal of Botany, 2009, 96(11): 1983- 1989.
[35] 王志勇, 赵昌明. 空心莲子草的可利用价值. 河北农业科学, 2010, 14(10): 113- 114, 116- 116.
[36] 李振宇, 解焱. 中国外来入侵种. 北京: 中国林业出版社, 2002.
[37] Geng Y P, Pan X Y, Xu C Y, Zhang W J, Li B, Chen J K, Lu B R, Song Z P. Phenotypic plasticity rather than locally adapted ecotypes allows the invasive alligator weed to colonize a wide range of habitats. Biological Invasions, 2007, 9(3): 245- 256.
[38] Mole S, Waterman P G. A critical analysis of techniques for measuring tannins in ecological studies II. Techniques for biochemically defining tannins. Oecologia, 1987, 72(1): 148- 156.
[39] Folin O, Denis W. A colorimetric method for the determination of phenols (and phenol derivatives) in urine. Journal of Biological Chemistry, 1915, 22(2): 305- 308.
[40] 波钦诺克X H. 植物生物化学分析方法. 荆家海, 丁钟荣, 译. 北京: 科学出版社, 1981.
[41] Chludil H D, Leicach S R, Corbino G B, Barriga L G, Vilario M D P. Genistin and quinolizidine alkaloid induction inL.angustifoliusaerial parts in response to mechanical damage. Journal of Plant Interactions, 2013, 8(2): 117- 124.
[42] 郭伟, 李钧敏, 胡正华. 酸雨和采食模拟胁迫下克隆整合对空心莲子草生长的影响. 生态学报, 2012, 32(1): 151- 158.
[43] Baldwin I T. Herbivory simulations in ecological research. Trends in Ecology & Evolution, 1990, 5(3): 91- 93.
[44] Sun Y, Ding J Q, Ren M X. Effects of simulated herbivory and resource availability on the invasive plant,Alternantheraphiloxeroidesin different habitats. Biological Control, 2009, 48(3): 287- 293.
[45] 张国友, 何兴元, 唐玲, 颜坤, 陈玮, 徐胜, 李响. 高浓度臭氧对蒙古栎叶片酚类物质含量和总抗氧化能力的影响. 应用生态学报, 2009, 20(3): 725- 728.
[46] 张苏芳, 张真, 王鸿斌, 孔祥波. 植物防御的新发现: 植物-植物相互交流. 植物生态学报, 2012, 36(10): 1120- 1124.
[47] 黄伟, 王毅, 丁建清. 入侵植物乌桕防御策略的适应性进化研究. 植物生态学报, 2013, 37(9): 889- 900.
[48] Herms D A, Mattson W J. Plant growth and defense. Trends in Ecology & Evolution, 1994, 9(12): 488- 488.
[49] 黄璐琦, 郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成. 中国中药杂志, 2007, 32(4): 277- 280.
[50] 阎秀峰, 王洋, 李一蒙. 植物次生代谢及其与环境的关系. 生态学报, 2007, 27(6): 2554- 2562.
——“单宁”

