尿路上皮细胞在老年SD大鼠前列腺导管内的表达情况
雷琳,安凌悦,罗光恒,孙兆林,郝佳
(1.贵州医科大学附属人民医院;2.贵州省人民医院;3.贵州省建设职业技术学院,贵州 贵阳 550002)
良性前列腺增生是老年男性的常见疾病,前列腺切除术是治疗进展期良性前列腺增生的有效方式。前列腺切除术后创面最终修复机制及修复源细胞研究尚不明确。1996年Pow-Sang等[1]认为前列腺切除术后修复前列腺部尿道的细胞主要源于膀胱颈的尿路上皮细胞爬行覆盖创面,完成修复过程,这个观点被大多数泌尿外科医生所认可。同年,Eduardo等[2]提出不同意见,认为修复前列腺部尿道的尿路上皮细胞主要来源于残余的前列腺上皮细胞或导管内皮细胞的观点,但其具体修复机制并未进一步深入研究。2012年Son等[3]在研究前列腺癌时发现前列腺导管内存在CK7阳性尿路上皮细胞。2016年作者发现,前列腺切除术后前列腺部尿道的修复细胞来源于膀胱颈的可能性较小,来源于残余前列腺部细胞的可能性大[4-5],该细胞可能是残余前列腺导管内的尿路上皮细胞。正常前列腺导管腔面虽然覆盖腺上皮,但正常前列腺导管内是否存在尿路上皮细胞目前尚未见报道。本研究的目的旨在探索老年SD大鼠前列腺导管内是否存在尿路上皮细胞及其形态特点。
1 材料与方法
1.1 实验动物
老年雄性SD大鼠15只,购于贵州医科大学动物房(合格证号:SCXK,黔 2012-0004),年龄1.5岁,体重600~700 g。
1.2 HE染色和免疫组化染色
取5只老年雄性SD大鼠,水合氯醛(0.5 mL/100 g)麻醉,麻醉生效后仰卧位固定,常规消毒后行下腹部正中切口至耻骨联合,切开腹壁全层,充分暴露盆腔脏器,仔细解剖膀胱、前列腺及尿道,将三者完整取出,用福尔马林固定。将组织脱水、石蜡固定后连续切片行HE染色,同时采用免疫组化EnVision两步法对CK7、CK20及UroplakinⅢ(UPⅢ)进行染色。染色步骤按照说明书进行操作,一抗CK7、CK20及UPⅢ的工作浓度分别是1:100、1:200和1:200,用已知阳性的人膀胱、前列腺及尿道组织作阳性对照,PBS代替一抗作阴性对照。
1.3 流式细胞学检测
另10只老年雄性SD大鼠,随机分成实验组和空白对照组,每组5只老年雄性SD大鼠。水合氯醛(0.5 mL/100 g)麻醉,麻醉生效后仰卧位固定,常规消毒后行下腹部正中切口至耻骨联合,切开腹壁全层,充分暴露盆腔脏器,仔细解剖膀胱、前列腺侧叶及前列腺腹侧叶,将三者完整取出,碎冰保存。将上述3种组织PBS清洗,制备单细胞悬液,前列腺组织用胰蛋白酶37 ℃消化45 min(1 g组织加入10 mL胰酶),膀胱组织在相同理化条件下加用0.1%胶原酶消化45 min,每5~10 min震荡1次。冷却悬液后过滤筛除去多余组织,调整细胞数量为1×106个/mL,离心后PBS重悬细胞,加入冷PBA(100 Ml PBS加入2 mL胎牛血清)再次离心,弃上清,结合一抗(UPⅢ)冰上孵育30 min。再次冷PBA离心洗涤1次,去除多余未结合抗体,结合二抗(FITC)冰上孵育30 min,冷PBA离心、洗涤后PBS重悬细胞避光,以UPⅢ染色阳性的尿路上皮细胞设门,流式细胞技术检测三种不同组织内UPⅢ的表达情况,以PBS代替二抗作空白对照,观察前列腺导管内是否存在尿路上皮细胞。
1.4 统计学分析
采用SPSS24.0软件进行统计学处理,分析膀胱、前列腺腹侧叶和前列腺侧叶流式细胞学样本五组数据荧光强度是否有统计学意义。统计方法为t检验,以P<0.05认为差异有统计学意义。
2 结果
2.1 HE染色结果
HE染色可见膀胱组织和前列腺部尿道组织内典型尿路上皮有三层细胞,分别为伞状细胞层、中间细胞层以及基底细胞层。前列腺部尿道中尿路上皮的伞状细胞层细胞呈极性排列,细胞核体积大于中间细胞层和基底细胞层,常可见双核;中间细胞层和基底细胞层均呈极性排列,三层细胞胞质均匀(图1A、B)。
前列腺导管开口处也可见尿路上皮,厚薄不均,约2~3层,伞状细胞层仅在前列腺导管开口黏膜褶皱处可见。该处尿路上皮的伞状细胞未呈极性排列,体积与前列腺部尿道中尿路上皮的伞状细胞无明显差异。前列腺导管开口处尿路上皮表面的伞状细胞细胞核常居中,偶见双核,胞核体积大小与前列腺部尿道内尿路上皮的伞状细胞无明显差异。前列腺导管开口处尿路上皮的中间细胞层和基底细胞层完整,细胞呈极性排列。随着前列腺导管向管腔底部延伸,该处尿路上皮中的伞状细胞层、中间细胞层和基底细胞层的细胞数量逐渐减少,细胞排列由极性转变为非极性,直至转化为单层极性排列的腺上皮细胞(图1C、D)。
2.2 免疫组化结果
膀胱组织和尿道组织内尿路上皮细胞,CK7和UPⅢ强阳性,CK20部分细胞弱阳性,均在细胞浆表达;前列腺导管开口处存在CK7和UPⅢ中度阳性,CK20阴性的细胞,均在细胞浆表达;随着前列腺导管延伸至管腔底部,该细胞CK7和UPⅢ的表达逐渐减弱,直至最后不表达,但该细胞的免疫组化表达程度较膀胱尿路上皮细胞低(图1E~P)。

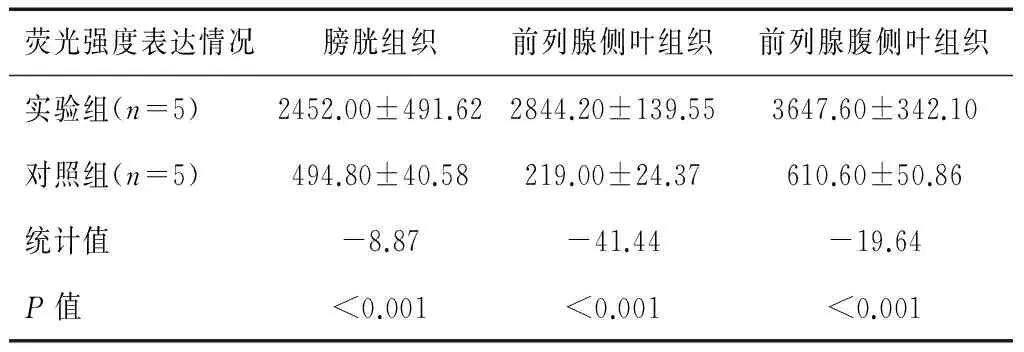
荧光强度表达情况膀胱组织前列腺侧叶组织前列腺腹侧叶组织实验组(n=5)2452.00±491.622844.20±139.553647.60±342.10对照组(n=5)494.80±40.58219.00±24.37610.60±50.86统计值-8.87-41.44-19.64P值<0.001<0.001<0.001
2.3 流式细胞检测结果
膀胱组织、前列腺侧叶组织及前列腺腹侧叶组织流式细胞结果显示,实验组3种组织的FITC荧光强度均较空白对照组明显升高,差异有统计学意义(P<0.05)。(表1及图2)前列腺侧叶和腹侧叶组织内均存在UPⅢ阳性的细胞(图3)。该UPⅢ阳性的细胞在膀胱组织中分别占比为(14.3±3.5)%,在前列腺侧叶组织中占比为(50.76±3.99)%,在前列腺腹侧叶中占比为(55.96±3.85)%(表2)。
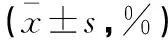

不同组织内UPⅢ阳性细胞的占比情况膀胱组织前列腺侧叶组织前列腺腹侧叶组织实验组(n=5)14.3±3.550.76±3.9955.96±3.85对照组(n=5)2.96±0.590.76±0.3057.76±0.96



3 讨论
本次研究所选SD大鼠,平均寿命为2年,日龄1年以上的即可称之为老龄SD大鼠,日龄1.5年的雄性SD大鼠即可相当于人50周岁以上的男性。因此选用日龄1.5年的老年雄性SD大鼠可以模拟鼠前列腺增生模型。
尿路上皮细胞最常分布在肾盂、输尿管、膀胱和前列腺部尿道。正常尿路上皮由三层细胞组成,分别为基底细胞、中间细胞以及最上层的伞状细胞,伞状细胞的表面存在增加细胞表面张力、影响细菌黏附和流体运输的微绒毛结构,能够维持泌尿道的屏障功能,保持尿液在泌尿道内正常的贮存和流动[6-7]。
前列腺部尿道腔内表面被尿路上皮覆盖,前列腺导管开口于前列腺部尿道,以保持前列腺液通过前列腺导管排入前列腺部尿道。1990年Lee等[8-9]研究SD大鼠前列腺导管时发现,前列腺导管的内层上皮细胞因为其形态不同可以分为三个不同的区域,远端(前列腺导管底部)和中间段均可见高柱状细胞,近端(前列腺导管近尿道部)腔面被上皮细胞覆盖,但其并未指明三个区域的细胞是否存在尿路上皮细胞或者具有尿路上皮细胞功能的细胞。
前列腺导管内衬有前列腺上皮,前列腺上皮主要由腺泡和导管上皮构成,腺泡和导管上皮含有分泌细胞、基底细胞和散在的神经内分泌细胞。前列腺基底细胞具有很强的增生、修复能力,同时也具有向腺上皮和尿路上皮分化的能力[10];此外,它还可能存在维持前列腺发育、成熟和功能的具有分化潜能的干细胞[11]。作者的前期研究推测前列腺切除术后前列腺部尿道的修复细胞可能来源于前列腺基底细胞,虽然有文献报道前列腺特异抗原(PSA)、聚集素(cd133)、核蛋白(P63)和前列腺干细胞抗原(PSCA)等有功能的特异性抗体[12-15],但由于作者无法选择合适的干细胞标记物进行前列腺干细胞的筛选,而前列腺基底细胞筛选、培养和传代极其困难,因此未能完成进一步实验。
人尿液中含有尿路上皮细胞,该细胞可能是前列腺切除术后创面的修复的细胞来源。在完成犬经膀胱前列腺切除术+双侧输尿管皮肤造瘘+膀胱造瘘术的实验后,作者观察到在无尿液刺激的情况下,前列腺切除术后创面仍能完成修复,因此尿液中的种子细胞作为创面再上皮化的来源较小[16]。有趣的是尿液中的一些细胞生长因子(如EGF、TGF),有可能为前列腺切除术后创面的修复起到了促进的作用,而这也将成为我们下一步的研究方向。
要揭示前列腺切除术后创面的修复机制,首先要找到创面修复的源细胞,即要证实前列腺导管内是否存在尿路上皮细胞或者具有尿路上皮细胞功能细胞的可能。本研究从HE染色切片上可以观察到老年SD大鼠前列腺导管开口处存在形态和大小与前列腺部尿道内尿路上皮细胞相似的尿路上皮,但SD大鼠前列腺导管开口处尿路上皮厚薄不均,表面伞状细胞层未呈极性排列,随着前列腺导管延伸至管腔底部,尿路上皮典型的三层细胞结构消失,逐渐转变为具有细胞极性、单层排列的腺上皮细胞。前列腺部尿道和膀胱内尿路上皮中伞状细胞的主要功能为输送尿液和防止尿液及细菌等物质渗入肌层,前列腺导管是为了储存和输送前列腺液而存在。适应是生物的形态结构和生理机能与其赖以生存的一定环境条件相适应的现象,因此前列腺导管内尿路上皮结构不如前列腺部尿道和膀胱尿路上皮典型;但由于前列腺导管开口于前列腺部尿道,导管开口处仍能接触到部分尿液,该处尿路上皮仍可见到数量较少的典型三层细胞结构。
CK7存在于尿路上皮细胞和一些导管上皮、间皮、假复层上皮中[17],CK20的表达在正常情况下伞状细胞极少量表达[18],UPⅢ是尿路上皮细胞的特异性标志物,三者联合可以观察前列腺导管内是否存在阳性表达的尿路上皮细胞。本实验结果表明前列腺部尿道导管开口处有CK7和UPⅢ阳性的细胞,但其阳性表达程度较膀胱尿路上皮细胞低,并且随着前列腺导管向管腔底部延伸,该细胞表达程度逐渐减低,最后消失。本结果提示该细胞可能具有尿路上皮细胞的表型和特性,但随着前列腺管腔向导管底部延伸,这种尿路上皮细胞的特性和功能逐渐减弱。
流式细胞学检测结果表明SD大鼠前列腺侧叶和腹侧叶内均存在UPⅢ阳性的细胞,该细胞在两种组织内的(55.96±3.85)%和(50.76±3.99)%。图3中UPⅢ阳性的细胞可能就是存在于前列腺导管中的尿路上皮细胞。但是,膀胱组织内UPⅢ阳性的尿路上皮细胞比例少于上述两种组织,作者分析其原因在于大鼠膀胱较小,组织溶解消化不充分,单细胞数量不够。
综上所述,前列腺导管内存在尿路上皮细胞,其体积大小和细胞胞质复杂程度与膀胱尿路上皮相似,但表面伞状细胞结构与前列腺部尿道尿路上皮细胞有差异。前列腺导管内的尿路上皮细胞CK7和UPⅢ细胞浆表达阳性。接下来作者将从细胞的亚显微结构、蛋白水平和核酸水平对前列腺导管内的尿路上皮细胞进行深入研究,为研究前列腺切除术后创面修复的细胞来源奠定基础。
参考文献
[1] Pow-Sang M,Orihuela E,Motamedi M,etal.Healing response of the canine prostate to Nd:YAG laser radiation[J].Prostate,1996,28(5):287-294.
[2] Orihuela E,Pow-Sang M,Motamedi M,etal.Mechanism of healing of the human prostatic urethra following thermal injury[J].Urology,1996,48(4):600-608.
[3] Son DH,Ro JY,Kang MJ,etal.Histology and distribution of prostatic tissue on prostatic urethral margins:evaluation of radical prostatectomy specimens and implications on frozen section analysis[J].Annals of Diagnostic Pathology,2012,16(2):79-84.
[4] Luo GH,Liu H,Luo L,etal.Re-epithelialization of the prostatic urethra after two-micron laser resection of the prostate[J].Asian Journal of Andrology,2016,18(1):151-153.
[5] 丁华,罗光恒,孙兆林,等.前列腺切除术后创面修复细胞来源的初步探讨[J].川北医学院学报,2016,31(3):288-290.
[6] Michael Winder,Gunnar Tobin,Da?a Zupan?i?,etal.Signaling Molecules in the Urothelium[J].Biomed Research International,2014,2014(15):295-297.
[7] Lori Birder,Karl-Erik Andersson.Urothelial Signaling[J].Physiological reviews,2013,93(2):653-680.
[8] Lee C,Sensibar JA,Dudek SM,etal.Prostatic ductal system in rats:regional variation in morphological and functional activities[J].Biol Reprod,1990,43(6):1079-1086.
[9] Lee C,Goolsby CL,Sensibar JA.Cell cycle kinetics in rat pros-tatic epithelia:nuclear migration during G2 phase[J].J Urol,1994,152(6 pt 2):2294-2299.
[10] Ramon LA,Braza-Boils A,Gilabert J,etal.microRNAs related to angiogenesis are dysregulated in endometrioid endometrial cancer[J].Hum Reprod,2012,27(10):3036-3045.
[11] Huang YH,Lin KH,Chen HC,etal.Identification of postoperative prognostic microRNA predictors in hepatocellular carcinoma[J].PLOS One,2012,7(5):e37188.
[12] Alan J Wein,Louis R Kavoussi,Alan W Partin,etal.Campbell-Walsh tenth edtion CHAPTER 90 Development[M].Philadelphia:Elsevier,2011:2539-2540.
[13] Foster CS,Ke Y.Stem cells in prostatic epithelial[J].Int J Exp Pathol,1997,78:311-329.
[14] De Marzo AM,Meeker AK,Epsein JI,etal.Prostate stem cell compartments:expression of the cell cycle inhibition P27kip1 in normal,hyperplastic,and neoplastic cells[J].Am J Pathol,1998,153(3):911-919.
[15] Leenders GJLHV,Schalken JA.Stem cell differentiation within the human prostate epithelium:implication for prostate carinogenesis[J].Bju International,2001,88(Supplement s2):35-42.
[16] 丁华,罗光恒,曹颖,等.尿液对犬经膀胱前列腺切除术后前列腺部尿道创面再上皮化的影响[J].中华泌尿外科杂志,2016,37(5):376-379.
[17] 曹颖,罗光恒,罗蕾等.2μm激光前列腺切除术后犬前列腺部尿道创伤修复的病理组织学观察[J].临床与实验病理学杂志,2013,29(10):1084-1088.
[18] Babichenko II,Samoi?lov MV,Kudriavtsev LV.Urothelial tumor of the urinary bladder:immune-histochemical features[J].Arkh Patol,2012,74(3):7-10.

