胃固有肌层肿瘤内镜切除术中穿孔内镜闭合术与腹腔镜修补术的疗效比较
屠惠明,乔峤,许科斌,费伯健,杨帆,李捷,高其中
(江南大学附属医院,1.消化内科;2.腔镜外科,江苏 无锡 214062)
起源于胃固有肌层的粘膜下肿瘤,由于肿瘤位置深,单纯内镜治疗风险大、难度高,治疗效果不佳且易出现各种并发症性穿孔。术中穿孔在内镜切除术的早期需要依靠腹腔镜联合胃镜双镜联合的方法进行穿孔修补处理。2008年周平红等[1]首次将ESD技术应用于治疗固有肌层GIST,将其命名为内镜黏膜下肿物挖除术(endoscopic submucosal excavation,ESE),并首次报道了内镜全层切除术(endoscopic full-thickness resection,EFR)中一旦发生穿孔即用钛夹、尼龙绳等迅速进行内镜下穿孔闭合术[2]。此时的穿孔有别于并发症穿孔,是内镜治疗中的一个过程和步骤,称为治疗性穿孔[3]。胃固有肌层肿瘤内镜切除术包括三个步骤:ESE/EFR、治疗性穿孔、内镜下穿孔闭合术[4]。本课题通过比较早期的腹腔镜辅助组与现行的内镜治疗组,以期考察胃固有肌层间质瘤完整切除和闭合的安全性、有效性。
1 资料与方法
1.1 一般资料
选取2013年1月至2016年6月于江南大学附属医院消化内镜中心经超声内镜发现的起源于胃固有肌层的黏膜下肿瘤(SMTs),内镜切除过程发生穿孔的病例40例,其中男性24例,女性16例;年龄30~81岁,平均(55.3±4.5)岁。分为腹腔镜辅助修复术组与无腹腔镜辅助内镜闭合组,各20例。术前诊断主要依据内镜、超声内镜EUS及腹部CT等影像学检查来判断消化道粘膜下肿瘤SMT的大小、起源、边界及生长方式,肿瘤直径8~30 mm,平均2.6 cm。所有患者麻醉风险评估为美国麻醉学会分级(ASA)Ⅰ级,无出血风险。所有患者均已充分告知内镜治疗的必要性,术中治疗性穿孔行腹腔镜或内镜闭合术,签署知情同意书。
1.2 器械及方法
1.2.1 器械 内镜、尼龙绳、金属钛夹及钛夹释放器。内镜包括注水治疗内镜(GIF-H260,Olympus)、双腔胃镜、OLYMPUS GIF-XQ 260型电子胃镜;尼龙绳包括Olympus一体尼龙绳、乐奥钩拉尼龙绳;钛夹包括:钛夹投放器,(HX-1 10UR;Olympus),一次性闭合钛夹(HX-600-135;Olympus),南京微创多次开合和谐夹。ESD相关器械及附件:氩气(ICC-200;ERBE),DUAL刀,透明帽(D-201-11802;Olympus),热活检钳(FD-410LR;Olympus),注射针(NM-4L-1;Olympus),CO2注气泵(UCR;Olympus)。腹腔镜手术器械,腔镜专用持针器、3.0可吸收缝线等。
1.2.2 术前准备 术前8 h禁食禁水,术前2 h开始预防性接受质子泵抑制剂(PPI)及抗生素治疗。置胃管持续负压吸引,以减少胃酸及内容物流入腹腔。清洁脐孔,以防术后脐孔处切口感染。手术室安排在万级洁净双镜联合手术间,室温22~25 ℃,湿度40%~60%,全麻插管下内镜联合腹腔镜手术。患者取仰卧头左侧位,术中监测生命体征及CO2分压,手术开始前充分冲洗胃腔,吸尽胃内液体。治疗性穿孔术中监测气腹压力,一旦发现患者腹壁膨隆明显、鼓音明显,立即用20 mL注射针排气减轻腹腔内压力。穿刺点选在位于右肋缘下方经腹腔穿刺留置,直到穿孔完全闭合,确认无空气从排气针排出,气腹明显改善时拔出排气针。后续内科治疗以降低术后腹膜炎发生风险。
1.2.3 粘膜下肿瘤切除术 采用ESE肿瘤挖除术及EFR胃壁肿瘤全层切除术。ESE肿瘤挖除耗时长,仔细沿瘤体表面剥离,穿孔往往较小,易经钛夹直接闭合。EFR胃壁肿瘤全层切除穿孔较大而明显,气腹明显迅速出现,需做好穿孔腹腔排气监护。穿孔闭合修补难度较大,早期手术双镜联合手术腹腔镜辅助修补术,后期内镜闭合术。腹腔镜修补术:脐下缘做1 cm弧形切口达皮下,气腹满意后拔出气腹针,穿刺10 mm套管针并置入腹腔镜。在腹腔镜直视下分别于剑突下、锁骨中线、腋前线与肋缘交点下各3 cm处分别穿刺10 mm、5 mm、5 mm套管针。插入相应器械。先用吸引器吸净胃内容物及渗液,找到穿孔后,用3.0可吸收缝合线进行全层缝合后,暂不结扎,游离部分大网膜填塞于穿孔内,然后打结。冲洗腹腔、盆腔。于穿孔附近放置引流管,从腋前线套管处引出体外并固定。放出CO2气体,拔出套管,粘合皮肤切口。患者于术后次日可下床进行活动,两天后可将引流管和胃管拔除。内镜下闭合术分2个阶段完成:首先进行闭合练习采用动物实验内镜闭合术培训及急性穿孔内镜闭合术练习;待熟练掌握闭合操作后进行急性穿孔内镜闭合:单一方法闭合:钛夹、OTSC(OVER THE SCOPY CLIPS);联合方法闭合:尼龙绳钛夹眼裂样闭合、腹膜补片钛夹缝合、双腔镜荷包缝合、单腔镜荷包缝合。术后取半卧位,持续胃肠减压2~3 d,静脉滴注奥美拉唑,预防性使用抗生素控制感染;补充液体营养支持治疗,纠正水、电解质和酸碱平衡失调。通过对患者的症状、体征观察闭合效果,了解粘膜闭合是否促进肌层愈合。
1.2.4 病理确诊 固有肌层起源肿瘤位置深,无法通过内镜活检取到需要的组织,只有通过肿瘤完整一次性切除带出体外,依赖于病理学证据和免疫组化标记确诊GIST。临床上再根据病理结果决定是否追加手术治疗或给予生物靶向治疗。
1.3 统计学分析
2 结果
2.1 手术完成情况
气管插管全麻下完成ESE 18例,EFR 22例。其中,腹腔镜修补术20例中ESE 8例,EFR 12例;内镜闭合术20例中ESE10例,EFR10例。ESE/EFR手术时间为45~120 min,平均86.8 min,均一次性完整切除,切除离体肿瘤直径1.2~3.0 cm,平均最大直径1.8 cm。
ESE及EFR术后病理38例诊断为间质瘤,2例平滑肌瘤。其中胃底17例,胃体15例,胃窦8例。病变最大直径0.6~3.8 cm,平均最大直径1.5 cm。
2.2 腹腔镜修补与内镜闭合术比较
<0.5 cm小穿孔予1枚和谐夹金属夹和2~4枚奥林巴斯小钛夹完整封闭穿孔。手术平均耗时(16.8±7.6)min,平均费用约4 800元。>0.5 cm的穿孔使用和谐夹6~15枚,平均使用钛夹10枚,应用尼龙绳联合钛夹进行荷包缝合,手术平均耗时(49.6±9.9)min,反复观察术野,未见活动性出血,留置胃管负压吸引引流,胃肠减压管拔除时间在术后(1.1±0.6)d,术后住院时间(4.6±1.9)d。两组在<0.5 cm穿孔手术耗时、医疗费用胃相比差异均有统计学意义(P<0.05)。两组在>0.5 cm穿孔手术耗时、术后住院时间比较差异无统计学意义(P>0.05)。见表1。
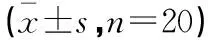
表1 急性穿孔内镜闭合术与腹腔镜修补术的比较
*P<0.05,与腹腔镜修补术组比较。
2.3 术后随访
全组未出现术后出血,随访5~32个月,恢复良好,未出现复发或转移。(1)腹部CT:早期1例空气下内镜手术ESE,术中治疗性穿孔,后钛夹闭合。1个月随访CT膈下游离气体依然存在,患者无腹膜炎症状;1例术后腹痛,CT提示膈下游离气体,急诊腹腔镜干预,未发现腹腔渗出,慢性胆囊炎急性发作,因粘膜上皮表面高级别瘤变,予以局部扩大切除。均无出血、腹膜炎表现。(2)复查:胃镜术后3个月、6个月、1年复查,随访时没有不适症状出现,胃镜复查显示创面均呈星状瘢痕愈合,病变均无残留或复发。
3 讨论
腹腔镜联合胃镜双镜联合切除技术(CLER)为固有肌层的胃肠道间质瘤患者提供更多的微创治疗选择[5-6]。在固有肌层胃肿瘤中主要是腹腔镜辅助内镜手术,在内镜切除过程中,可通过腹腔镜下器械牵拉部分胃壁,使肿瘤更好地暴露于内镜下便于切除,保证胃镜治疗安全性,也可在第一时间进行急性穿孔修补术[7]。在内镜ESD及ESE、EFR技术开展的早期,内镜穿孔单纯内镜治疗困难,当无法完成内镜缝补时,往往有赖于腹腔镜修补术的辅助[8]。双镜联合手术治疗胃间质瘤具有快速定位、优化手术流程、术时短、创伤小、切口小、外源性感染几率小、术野清晰、恢复快、安全有效等优点,适合于直径<5 cm、术中仅靠腹腔镜难以定位的瘤灶。但腹腔镜技术也有其局限性,如位于胃后壁等的穿孔腹腔镜手术操作难度较大;腹腔污染严重、部分常须开腹手术治疗,手术对瘤体定位、手术组成员配合要求较高,需要富有经验的医师操作[9-10]。
随着内镜切除技术突飞猛进,无腹腔镜辅助的固有肌层胃肿瘤内镜切除术应运而生,内镜下肌层剥离术(EMD)包括: ESE, EFR、经隧道粘膜下肿瘤挖除术(STER)等[11]。ESE是ESD的衍生技术的延伸。在内镜透明帽辅助下将肿瘤表面黏膜及黏膜下层切开,暴露瘤体后,再沿瘤体边缘切割分离,直至充分暴露整个瘤体并完整切除。EFR胃全层切除术主要针对胃固有肌层的胃肠道间质瘤进一步扩大ESE的治疗深度和范围,EFR治疗成功的关键是镜下成功修补术中发生的主动性穿孔,既往常直接采用钛夹夹闭,对于较大的全层缺损,可使用强力负压吸引将大网膜吸入穿孔处胃腔,再用金属夹沿缺损边缘将大网膜和胃黏膜一起夹闭使缺损有效缝合。常使用钛夹结合尼龙绳的方法行荷包缝合。STER隧道技术最大的优点是既可一次性完整切除固有肌层GIST,又可维持消化道内壁黏膜层的完整性,即使术中发生穿孔,也可通过闭合隧道口减少消化道瘘及腹腔内感染的机会。可见术中穿孔的处置成为整个EMD手术成功的关键。
随着内镜闭合方法的进步,腹腔镜辅助创面缝合逐步减少,并逐步过渡到内镜闭合术[12-13]。内镜医生在学习ESD技术的同时,需要有急性穿孔闭合术的动物实验培训和闭合技术不断成熟。内镜闭合术减少腹腔镜工作人员和器械设备,减少了成本及创伤,固有肌层肿瘤手术将成为内镜独立完成手术。因此,双镜联合手术创伤与单独内镜下切除手术相仿,术后恢复时间与单纯内镜治疗已没有差别。
根据发生穿孔的可预见性分为并发症性穿孔和治疗性穿孔,随着操作器械及内镜技术的提高,内镜闭合术必将为患者带来一个崭新的微创时代。将被动穿孔成为主动穿孔,将穿孔成为内镜切除术的一个步骤,在内镜闭合术中完成经胃肠道的各种手术。由于胃肠镜操作在空腹状态下,只要及时发现,迅速进行内镜下闭合术,急性穿孔腹膜炎症状轻,可避免传统的经腹手术。减少医患双方的心理和经济负担,缩短病程,减少住院费用,提高快速治愈率。
EMD治疗上消化道固有肌层肿瘤术中穿孔内镜闭术与腹腔镜修补术无显著性差异,具有创伤小、恢复快、费用低的优点,随着内镜下闭合医源性消化道穿孔技术的发展,内镜下切除的适应症进一步拓宽具有良好的临床推广价值。
参考文献
[1] 周平红,姚礼庆,秦新裕.内镜黏膜下剥离术治疗20例胃肠道间质瘤[J].中华胃肠外科杂志,2008,15(3):219-222.
[2] 周平红,姚礼庆,秦新裕,等.无腹腔镜辅助的内镜全层切除术治疗源于固有肌层的胃黏膜下肿瘤[J].中华消化内镜杂志,2009,26(12):617-621.
[3] 徐美东,姚礼庆,周平红,等.经黏膜下隧道内镜肿瘤切除术治疗源于固有肌层的上消化道黏膜下肿瘤初探[J].中华消化内镜杂志,2011,28(11):606-610.
[4] 凌亭生,裴庆山,吕瑛,等.内镜下切除胃巨大间质瘤的疗效及安全性评价[J].中华消化内镜杂志,2013,30(2):90-93.
[5] 屠惠明,许科斌,翁鸳,等.胃镜与胸腔镜联合微创治疗食管平滑肌瘤[J].中国医药,2011,6(1):65-66.
[6] 屠惠明,费伯建,翁鸢,等.内镜联合胸腹腔镜治疗消化道良性肿瘤的初步应用体会[J].中华消化内镜杂志,2010,27(7):365-366.
[7] Matsuda T,Nunobe S,Kosuga T,etal.Laparoscopic and luminal endoscopic cooperative surgery can be a standard treatment for submucosal tumors of the stomach:a retrospective multicenter study[J].Endoscopy,2017,49(5):476-483.
[8] Dávila JS,Momblán D,Ginès à,etal.Endoscopic-assisted laparoscopic resection for gastric subepithelial tumors[J].Surg Endosc,2016,30(1):199-203.
[9] 任明,顾春林.双镜联合技术在胃间质瘤治疗中的应用体会[J].腹腔镜外科杂志,2015,20(1):25-27.
[10] Yamamoto K,Sumiyoshi T,Saikawa D,etal.Laparoscopic and Endoscopic Cooperative Surgery for Two Gastrointestinal Stromal Tumors of the Stomach-Report of a Case[J].Nihon Rinsho Geka Gakkai Zasshi,2015,76(9):2158-2162.
[11] Sun GL,Hur H,Han SU,etal.Laparoscopy-assisted endoscopic full-thickness resection for gastric subepithelial tumors originated from the muscularis propria layer:a pilot study with literature review[J].Scandinavian Scand J Gastroenterol,2017,52(3):257-263.
[12] 马丽黎,陈世耀,周平红,等.四种内镜下尼龙绳结扎法处理上消化道黏膜下肿瘤的疗效评价[J].中华消化内镜杂志,2010,27(11):581-584.
[13] Zhou PH,Yao LQ,Qin XY,etal.Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria[J].Surg Endosc,2011,25(9):2926-2931.

