基于生物网络模块分析薏苡仁治疗胃癌的药理机制❋
张风宾,张瑞星,郭 剑,霍炳杰,李 兵,3△,王 忠
(1. 河北医科大学第四医院,石家庄 050011; 2. 山东步长制药股份有限公司,山东 菏泽 274000; 3. 中国中医科学院中医药信息研究所,北京 100700; 4. 中国中医科学院中医临床基础医学研究所,北京 100700)
网络生物学认为,疾病是由于机体整体调控网络失衡而产生的,对疾病的治疗需要机体复杂网络中的多个节点使其恢复平衡[1]。网络和系统生物学研究具有整体性和系统性的特点,而中医药学是系统科学,强调整体观念和辨证论治,中药的作用亦是多成分、多靶点的系统调节,这些共性为我们利用网络生物学方法研究中医药的病证机理、方剂配伍理论、中药药理等提供了新的理念和策略[2-3]。
胃癌是发病率和死亡率最高的消化道恶性肿瘤,在我国恶性肿瘤发病率中列位第二位[4]。中药在增效解毒、改善生存质量、增强免疫功能,防止肿瘤复发和抗耐药方面具有一定的优势,在胃癌的治疗中发挥着越来越重要的作用[5]。多项研究证实,薏苡仁抗肿瘤作用明确,能够抑制胃癌MKN28、BGC-823细胞增殖,下调CD44、CD133表达,从而降低胃癌细胞黏附、侵袭能力[6]。康莱特注射液(主要成分为薏苡仁提取物)在配合胃癌化疗治疗中能够抑制胃癌耐药性基因表达,降低耐药性,增加敏感性、从而提高化疗效果[7]。
因此本文利用生物网络及模块化分析方法,发掘薏苡仁治疗胃癌的潜在作用靶点及模块,从系统水平阐释薏苡仁抗肿瘤的药理作用,也为从网络和多靶点层次分析中药药理、发现中药靶点提供新的思路。
1 数据来源
1.1 薏苡仁成分及作用靶点数据
通过中国科学院上海有机化学研究所的中药化学数据库和中药系统药理学数据库(TCMSP)检索获取薏苡仁的化学成分。利用CTD数据库和TCMSP获取每个化学成分对应的作用靶点数据。经规范、去重后得到薏苡仁的化学成分及其作用靶点数据集。
1.2 胃癌相关基因数据
通过在线人类孟德尔遗传(online mendelian inheritance in man,OMIM)和人类表型本体(human phenotype ontology,HPO)数据库获取胃癌相关基因。OMIM是关于人类基因和遗传疾病的综合性数据库,关注人类疾病基因型和表型间的关系,目前已收录超过15000个疾病相关基因,具有及时性、权威性、全面性和实用性的特点[7]。HPO是基于OMIM数据建立的疾病基因和表型间关系,目前已超过5万多条注释[8]。
2 研究方法
2.1 基因集对比分析
将薏苡仁作用靶点基因数据集和胃癌相关基因数据集进行对比分析,发现二者共同的重叠基因,观察其相似性关系。
2.2 薏苡仁作用靶点网络构建
通过人类蛋白相关关系数据库(HPRD)和BioGERD数据库获取已知的蛋白相互作用关系(PPI),将薏苡仁作用靶点基因和蛋白映射到已知的蛋白相互作用关系中,得到薏苡仁作用靶点间关系和PPI网络。利用Cytoscape 3.0软件实现网络的可视化,并利用网络分析插件分析薏苡仁作用靶点网络的相关参数,发现关键基因和蛋白。
2.3 靶点网络模块划分
在生物网络中,模块是在紧密连接的功能集团,通过模块内多靶点的相互作用来执行相应的功能。在Cytoscape中,按照默认参数,利用MCL工具[9]识别薏苡仁作用靶点网络的模块。
2.4 模块功能富集分析
通过薏苡仁靶点模块的功能富集分析揭示其所具有的生物功能,从而阐释薏苡仁治疗肿瘤的多靶点作用机制。利用DAVID 6.8进行模块的基因本体(gene ontology, GO)和京都基因与基因组百科全书(KEGG)通路分析。DAVID采用改良的Fisher精确检验计算出得到各个功能、通路的P值,用Benjamini方法进行校正。选择P<0.05的GO terms和KEGG通路作为模块所富集到的功能。
3 结果
3.1 基因集对比分析
通过数据库检索共得到薏苡仁的组成成分41个,成分的作用靶点482个,胃癌的相关基因165个。通过基因集对比发现,薏苡仁作用靶点与12个已知胃癌相关基因重叠,分别是AICDA、CASP3、EP300、ERBB2、FGFR2、IL12 A、IL12B、IL1B、LOX、TJP1、TP53、TRIB3。可以看出,薏苡仁通过多个靶点的调节起到治疗胃癌的作用。
研究显示,幽门螺杆菌感染阳性胃癌患者的AICDA基因异常表达,该基因的上调可以导致胃癌肿瘤抑制因子TP53的核苷酸变化,介导NF-kB的激活,从而导致胃黏膜致癌的基因突变[10]。CASP3基因是在细胞凋亡及肿瘤的发生中起重要作用,在胃癌、肝癌、结肠癌、非小细胞肺癌、非霍奇金淋巴瘤等肿瘤中观察到CASP3基因的突变[11]。EP300是在细胞增殖和分化过程对转录调节起重要作用的组蛋白乙酰转移酶,EP300的移位突变和表达缺失是胃癌和结肠癌的特征之一[12]。ERBB2基因是胃癌的靶向标志物之一,研究显示调节ERBB2可以上调microRNA-375,从而增加顺铂治疗胃癌的敏感性[13]。FGFR2基因是纤维母细胞生长因子受体,其杂合体细胞突变的激活可导致胃癌的发生,过表达FGFR2与胃癌患者的整体存活显著相关[14]。IL1B、IL12 A和IL12B的基因多态性是影响幽门螺杆菌感染患者胃黏膜癌变的重要因素[15]。LOX基因是细胞外启动胶原蛋白与弹性蛋白交联的赖氨酸氧化酶。研究表明,其在胃癌等多种癌症中通过杂合子丢失或启动子甲基化而表现为下调,是一个抑癌基因[16]。TJP1、TP53、TRIB3基因也都与胃癌治疗密切相关[17-19]。通过分析可知,薏苡仁可能通过这些重要作用靶点来调节胃癌的发生和治疗。
3.2 薏苡仁作用靶点网络分析
图1显示,根据薏苡仁的化学成分和作用靶点,构建了薏苡仁的成分—靶点网络,由523个节点(42成分、481靶点)和858条边组成。在这一网络中,已知胃癌基因CASP3的节点度为7,即7个薏苡仁的成分作用于该基因。其他节点度较高的作用靶点还包括NCOA2(14)、PTGS2(14)、PTGS1(12)、TNF(10)、 ADH1C(8)、PPARA(8),这些靶点可能是薏苡仁发挥治疗作用的重要药理机制。
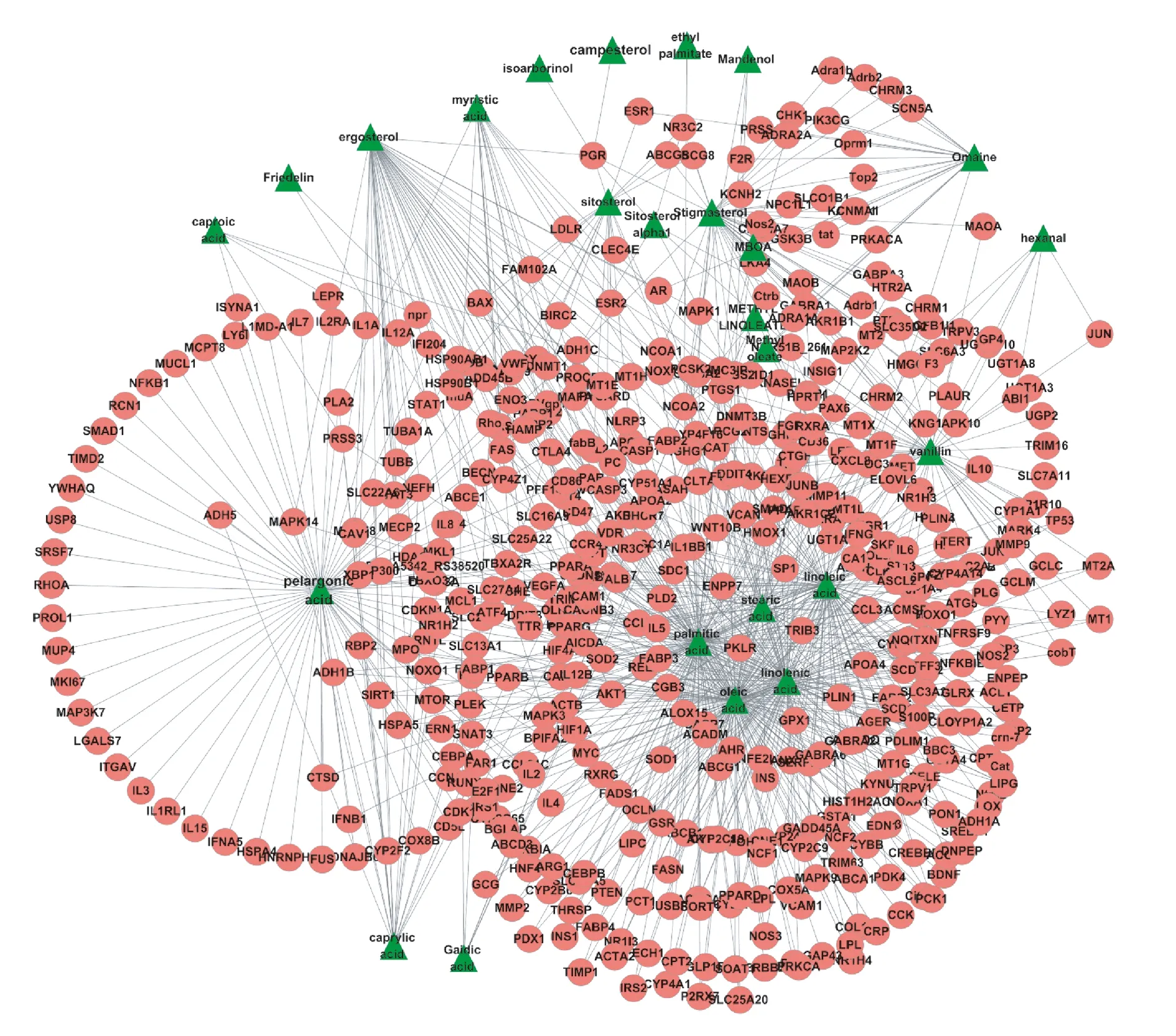
图1 薏苡仁成分-靶点网络注:图中三角形节点表示薏苡仁组成成分,圆形节点为成分作用靶点
图2显示,基于薏苡仁的作用靶点和PPI关系,构建了薏苡仁的作用靶点网络。该网络由120个节点、137条边组成,其核心节点包括RXRA、MAPK3、BCL2、CDK1等。
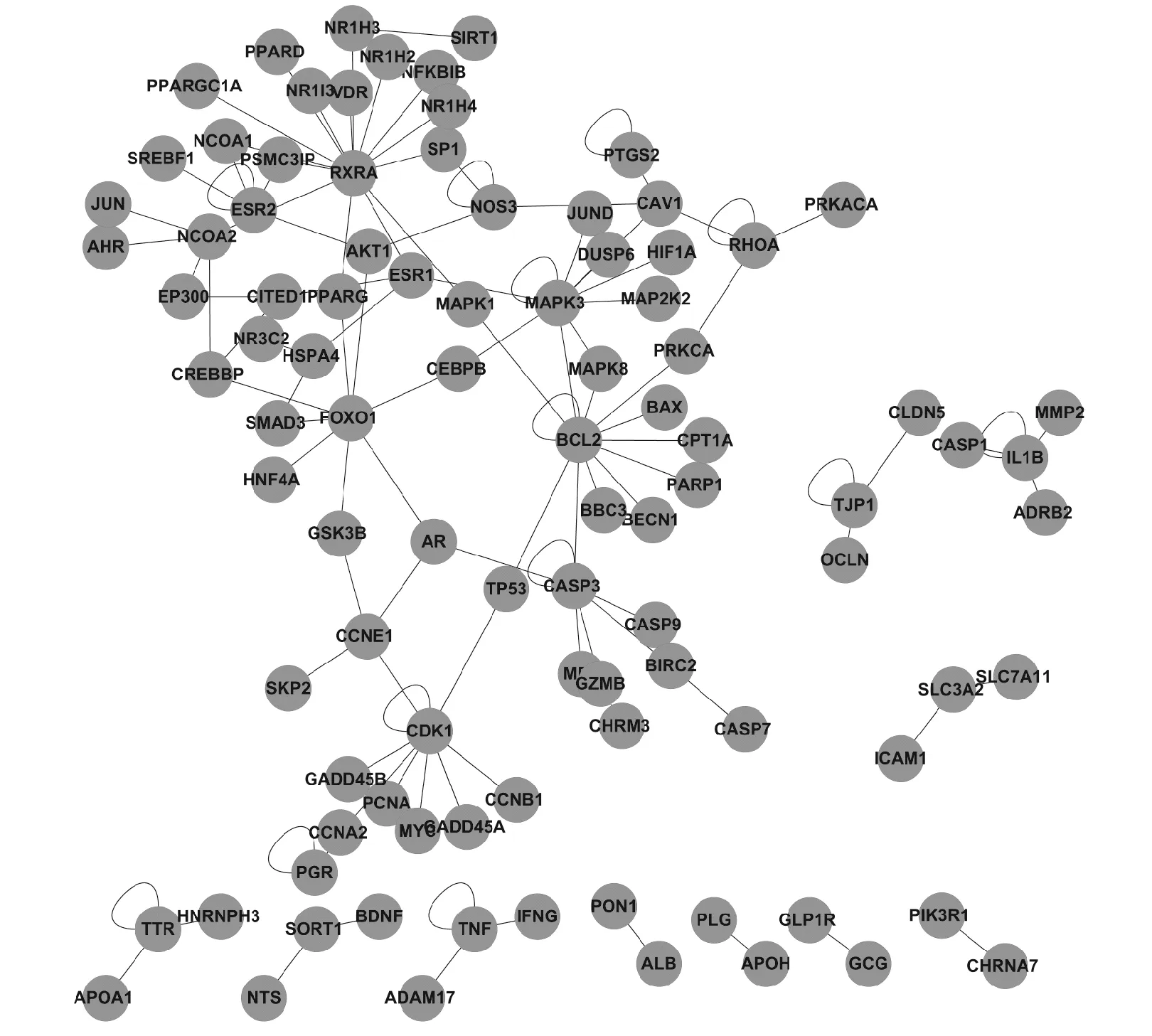
图2 薏苡仁靶点网络
3.3 薏苡仁作用靶点模块
利用MCL算法对薏苡仁的靶点网络进行模块划分,共得到16个模块(节点数≥3),其中最大的模块由11个节点组成,模块划分结果如图3所示。有5个模块包含已知的5个胃癌相关基因,分别是CASP3、EP300、IL1B、TJP1、TP53。
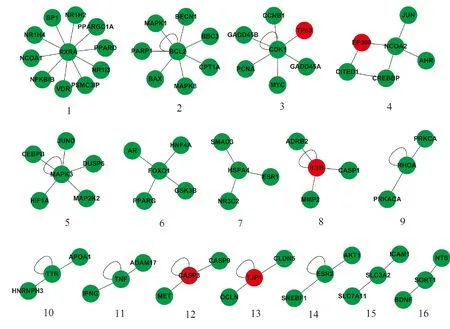
图3 薏苡仁靶点模块注:图中浅色节点表示已知的胃癌相关基因
3.4 机制分析
通过DAVID 6.8工具对薏苡仁作用靶点模块进行GO和KEGG通路的功能富集,从而揭示薏苡仁治疗胃癌的潜在作用机制。为提高结果的准确性,本研究仅对5个含有已知胃癌基因的模块进行了分析。根据富集分析的显著性,表1列出每个模块排在前5位的GO和KEGG通路。可以看出,薏苡仁的靶点模块主要富集到的功能涉及DNA损伤应答、转录调节、细胞凋亡、细胞连接等GO功能和癌症、细胞循环、受体信号传导等KEGG通路,其中模块4、模块12排在前5位的通路中直接包含有结直肠癌、肾癌等癌症通路。
4 讨论
薏苡仁是禾本科薏苡属植物薏苡(Coix lacryma-jobi L.)的干燥成熟种仁,味甘淡、性微寒,归脾、胃、肺经。《药性论》谓薏苡仁“煎服之破毒肿”。现代药理学研究发现,薏苡仁抗肿瘤作用明确,其主要活性成分包括薏苡仁酯、脂肪酸及脂类、甾醇类、三萜类、多糖类化合物,通过多靶点、多途径的协同作用,实现直接的抑瘤和免疫调节作用[20-21],主要的作用机制包括抑制肿瘤细胞的分裂增殖,诱导肿瘤细胞凋亡,抑制肿瘤细胞的转移,抑制环氧合酶-2(COX -2)、脂肪酸合成酶(FAS)的活性,抑制肿瘤血管形成,调节机体免疫系统功能等[20]。
薏苡仁及其提取物在联合化疗治疗胃癌中具有显著疗效,同时能够改善骨髓抑制和减少化疗的不良反应[22],而其作用机制仍不十分明确。本文利用生物网络和模块化分析方法,探讨薏苡仁治疗胃癌的作用靶点及机制,通过研究得到12个薏苡仁靶点基因与胃癌密切相关,提示薏苡仁在治疗胃癌中可能的作用靶点。通过薏苡仁成分-靶点、靶点PPI网络的构建,发掘薏苡仁作用的核心靶点,为今后进一步研究薏苡仁的药理作用提供参考。此外通过薏苡仁靶点网络模块化分析,探讨了薏苡仁治疗胃癌的潜在靶点模块及机制,发现薏苡仁的作用机制广泛,涉及到癌症通路、细胞循环通路、受体信号传导通路及DNA损伤应答、转录调节、细胞凋亡、细胞连接等功能,为进一步揭示薏苡仁的抗肿瘤机制提供线索。
生物网络及模块化分析方法与中医药的多组分、多靶点、系统调节作用具有相似的特点,为阐释中药的复杂药理机制、发现中药的核心作用靶点和模块提供了新的思路。以相互作用多靶点组成的模块为药物的靶点,可能成为药物研发的新方向,通过多靶点的调节和协同达到增效解毒、对抗耐药的作用,为新的、有效的肿瘤药物研发提供新的策略。本文对薏苡仁治疗胃癌的应用分析也证明了该方法的可行性和优势。
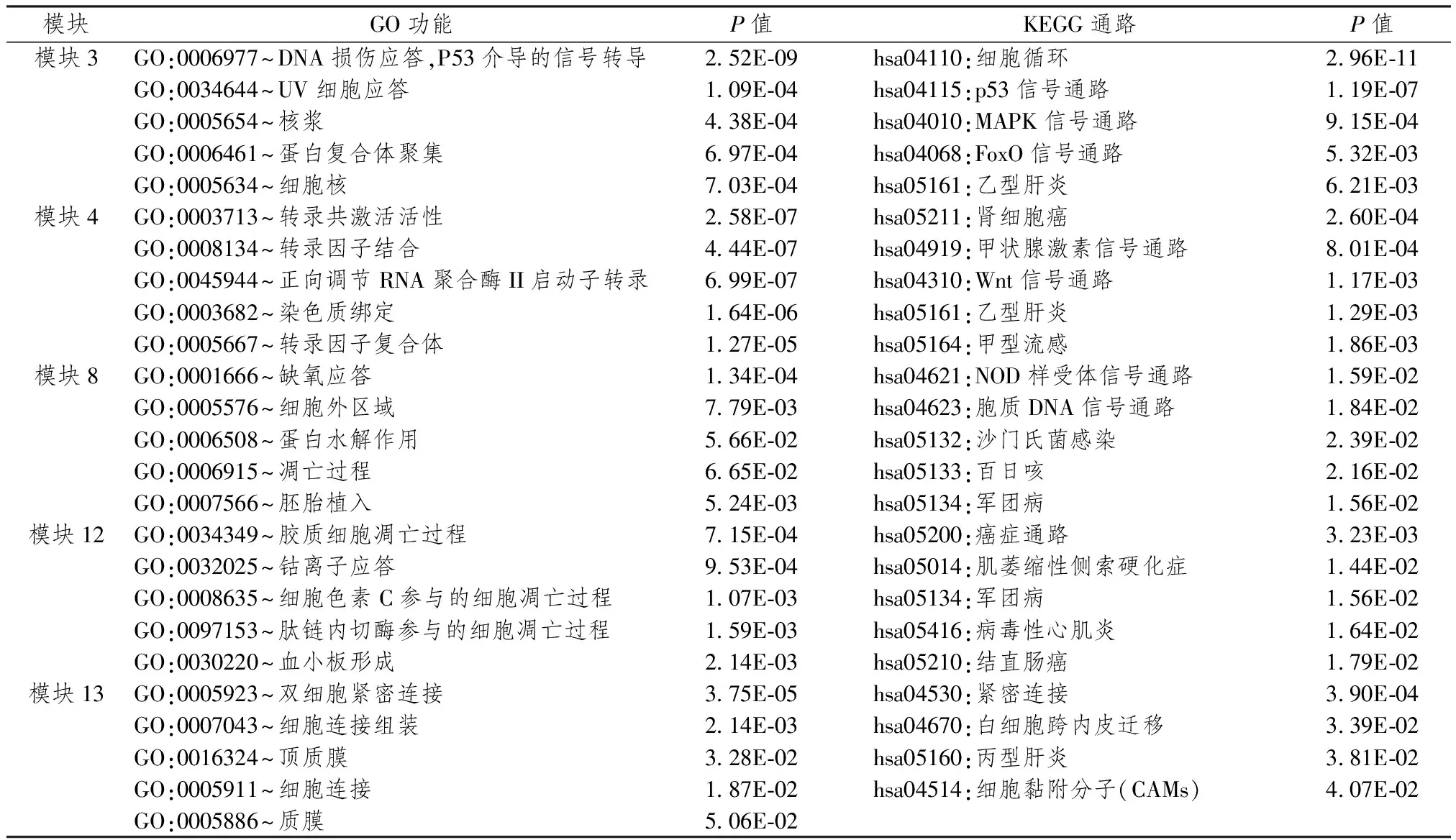
表1 薏苡仁靶点模块功能富集分析
参考文献:
[1] BARABASI A L, OLTVAI Z N. Network biology: understanding the cell's functional organization[J]. Nature Reviews Genetics, 2004, 5(2):101-13.
[2] 汤佩佩,白明,苗明三. 中医药研究与网络药理学[J]. 中医学报,2012,27(9):1112-1115.
[3] 李梢,张博. 中药网络药理学:理论、方法与应用(英文)[J]. 中国天然药物,2013,11(2):110-120.
[4] JOHN C. LAYKE, PETER P. LOPEZ. 胃癌:诊断和治疗方案的选择[J]. 中国全科医学, 2015(3):248-249.
[5] 马梦雨, 韩克起. 中医药治疗胃癌研究进展[J]. 中医学报, 2015, 30(6):777-779.
[6] 张明发, 沈雅琴. 薏苡仁油抗消化系肿瘤的基础和临床研究[J]. 中国执业药师, 2011, 8(8):19-23.
[7] AMBERGER J S, BOCCHINI C A, SCHIETTECATTE F, et al. OMIM.org: Online Mendelian Inheritance in Man (OMIM®), an online catalog of human genes and genetic disorders[J]. Nucleic Acids Research, 2014, 43(D1):789-98.
[8] ROBINSON P N, MUNDLOS S. The Human Phenotype Ontology[J]. Clinical Genetics, 2010, 77(6):525-534.
[9] SHIH Y K, PARTHASARATHY S. Identifying functional modules in interaction networks through overlapping Markov clustering[J]. Bioinformatics, 2012, 28(18):i473-i479.
[10] MATSUMOTO Y, MARUSAWA H, KINOSHITA K, et al. Helicobacter pylori infection triggers aberrant expression of activation-induced cytidine deaminase in gastric epithelium[J]. Nature Medicine, 2007, 13(4):470-476.
[11] SOUNG Y H, LEE J W, KIM S Y, et al. Somatic mutations of CASP3 gene in human cancers[J]. Human Genetics, 2004, 115(2):112-115.
[12] KIM M S, LEE S H, YOO N J, et al. Frameshift mutations of tumor suppressor gene EP300 in gastric and colorectal cancers with high microsatellite instability[J]. Human Pathology, 2013, 44(10):2064-2070.
[13] ZHOU N, QU Y, XU C, et al. Upregulation of microRNA-375 increases the cisplatin-sensitivity of human gastric cancer cells by regulating ERBB2[J]. Experimental & Therapeutic Medicine, 2015, 11(2): 625-630.
[14] JANG J H, SHIN K H, PARK J G. Mutations in Fibroblast Growth Factor Receptor 2 and Fibroblast Growth Factor Receptor 3 Genes Associated with Human Gastric and Colorectal Cancers[J]. Cancer Research, 2001, 61(9):3541-3543.
[15] EL-OMAR E M, CARRINGTON M, CHOW W H, et al. Interleukin-1 polymorphisms associated with increased risk of gastric cancer[J]. Nature, 2000, 404(6776):398-402.
[16] KANEDA A, WAKAZONO K, TSUKAMOTO T, et al. Lysyl oxidase is a tumor suppressor gene inactivated by methylation and loss of heterozygosity in human gastric cancers[J]. Cancer Research, 2004, 64(18):6410-6415.
[17] AMIEVA M R, VOGELMANN R, COVACCI A, et al. Disruption of the Epithelial Apical-Junctional Complex by Helicobacter pylori CagA[J]. Science, 2003, 300(5624):1430-1434.
[18] VARLEY J M, MCGOWN G, THORNCROFT M, et al. An extended Li-Fraumeni kindred with gastric carcinoma and a codon 175 mutation in TP53[J]. Journal of Medical Genetics, 1995, 32(12):942-945.
[19] SMITH S M, MORAN A P, DUGGAN S P, et al. Tribbles 3: a novel regulator of TLR2-mediated signaling in response to Helicobacter pylori lipopolysaccharide[J]. Journal of Immunology, 2011, 186(4):2462-2471.
[20] 杜萌, 丁安伟, 陈彦. 薏苡仁化学成分及其防治肿瘤作用机制研究[J]. 吉林中医药, 2012, 32(2):195-201.
[21] 温晓蓉. 薏苡仁化学成分及抗肿瘤活性研究进展[J]. 辽宁中医药大学学报, 2008, 10(3):135-138.
[22] 王灿, 王权, 何曦冉,等. 康莱特联合化疗对进展期胃癌临床疗效的Meta分析[J]. 现代中西医结合杂志, 2011, 20(30):3774-3777.

