健脾软肝方对四氯化碳诱导肝纤维化大鼠肝窦基底膜形成的影响
陈文玲,杜良,陈文慧,谭丽萍,姚政,石安华
(1 云南中医学院,昆明650500;2 本溪市第九人民医院)
肝纤维化以肝内纤维组织生成和降解失平衡,胶原纤维弥漫性增生、沉积,但不形成假小叶结构为特征,是各种慢性肝病发展至肝硬化必经的病理过程[1]。肝纤维化过程中一个重要的病理改变是纤维间隔近旁肝窦毛细血管化,而肝窦内皮下基底膜形成是肝窦毛细血管化的重要特征[2,3]。因此推测,早期阻止肝窦内皮下基底膜形成有可能逆转肝纤维化形成,这或许会成为防治肝硬化的新途径。健脾软肝方是云南省名老中医苏涟教授治疗肝病的经验方,经肝组织穿刺活检发现,该方治疗后可延缓肝纤维化形成[4]。但其作用机制是否与阻止肝窦内皮下基底膜形成有关尚不清楚。2014年5月~2016年3月,本研究观察了健脾软肝方对四氯化碳(CCl4)诱导肝纤维化大鼠肝窦内皮下基底膜形成的影响。现分析结果并报告如下。
1 材料与方法
1.1 材料 健康雄性Wistar大鼠60只,清洁级,2月龄,体质量(150±10)g,由成都达硕生物科技有限公司提供。所有大鼠自由摄食、饮水,于云南中医学院实验动物房中分笼饲养,环境温度20~22 ℃,相对湿度50%~55%,通风良好。健脾软肝方,由云南中医学院门诊部药房提供生药;扶正化瘀胶囊,上海黄海制药有限责任公司;CCl4,天津市光复科技发展有限公司。JEM-1011型透射电镜,日本电子株式会社;7500fast型PCR扩增仪,美国BIO公司;Step OneTM型荧光定量PCR仪,美国ABI公司;Image-pro Plus5.0图像分析系统,日本奥林巴斯株式会社。兔抗鼠层黏连蛋白(LN)多克隆抗体,武汉博士德生物工程有限公司;生物素-HRP免疫组化试剂盒(兔),包括生物素二抗、ABC复合物,上海生工生物工程股份有限公司。TRIzol试剂盒、第一链cDNA合成试剂盒,上海生工生物工程股份有限公司;SG Fast qPCR Master Mix(High Rox),美国BBI公司。
1.2 健脾软肝方制备 健脾软肝方方药组成:兰花参20 g,三七2 g,莪术15 g,白芍15 g,香附8 g。用水煎煮,去渣浓缩成稠浸膏状[5],4 ℃冰箱冷藏。
1.3 肝纤维化模型制作及分组处理 所有大鼠适应性喂养1周,按随机数字表法分为正常对照组、模型组、扶正化瘀胶囊组及健脾软肝方高、中、低剂量组,每组10只。除正常对照组外,其余各组制备肝纤维化模型:腹腔注射30%CCl4橄榄油溶液2 mL/kg,每周2次,连续注射4周。造模同时,健脾软肝方高、中、低剂量组根据人和动物间按体表面积折算的等效剂量比值分别给予健脾软肝方10.8、5.4、2.7 g/(kg·d)灌胃,扶正化瘀胶囊组给予扶正化瘀胶囊0.4 g/(kg·d)灌胃。正常对照组和模型组给予生理盐水15 mL/(kg·d)灌胃,连续灌胃4周。
1.4 相关指标观察 末次灌胃结束,各组禁食12 h、不禁水,10%水合氯醛腹腔注射麻醉,迅速剖腹,取肝组织。选取肝脏质地最硬部分,切成1.0 cm×1.0 cm×0.3 cm大小的多个组织块,一部分用10%中性甲醛固定,用于观察组织病理变化;一部分用3.5%戊二醛固定,用于透射电镜下观察肝窦基底膜超微结构;其余部分-80 ℃保存,用于检测肝组织ColⅣ、LN表达。
1.4.1 肝组织病理变化 采用Mallory染色法。取10%中性甲醛固定的肝组织,梯度乙醇脱水,二甲苯透明,浸蜡,石蜡包埋,3 μm厚切片。将切片置于重铬酸钾溶液10 min,蒸馏水冲洗2 min;酸性复红液染色2 min,蒸馏水稍洗;苯胺蓝溶液染色20 min,95%乙醇快速分化;无水乙醇脱水,二甲苯透明,中性树胶封固,显微镜下观察。
1.4.2 肝窦基底膜超微结构 取出3.5%戊二醛固定的肝组织,1%锇酸再固定,乙醇、丙酮逐级脱水;然后用环氧树脂618渗透、包埋,70 ℃聚合20 h,将组织块用光镜定位、修块,超薄切片机切片,柠檬酸铅-醋酸双氧铀双重染色,透射电镜下观察。
1.4.3 肝组织ColⅣ、LN mRNA表达 采用Real-time PCR法。取出冰冻的肝组织,复温后根据TRIzol试剂盒说明提取组织总RNA,按第一链cDNA合成试剂盒说明逆转录为cDNA,然后以cDNA为模板进行PCR扩增。引物序列:ColⅣ上游引物5′-CAGCAATTAGGCAGGTCAAGT-3′,下游引物5′-TGGTGTTTTCACATTCGGTG-3′;LN上游引物5′-CCATGATGACGGCACTTTTC-3′,下游引物5′-GTCAATCCACAGGTAGACGAG-3′;内参β-actin上游引物5′-CGTAAAGACCTCTATGCCAACA-3′,下游引物5′-AGCCACCAATCCACACAGAG-3′。PCR反应体系共20 μL:SybrGreen qPCR Master Mix 10 μL,上下游引物各0.4 μL,ddH2O 7.2 μL、Template (cDNA)2 μL;反应条件:95 ℃ 7 s,57 ℃ 10 s,72 ℃ 15 s,共40个循环。采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。
1.4.4 肝组织LN蛋白表达 采用ABC法。取出冰冻的肝组织,复温后梯度乙醇脱水,二甲苯透明,浸蜡,石蜡包埋,3 μm厚切片。切片常规脱蜡至水,高温高压法抗原修复,3%过氧化氢封闭20 min,PBS冲洗5 min×3次,滴加兔抗鼠LN多克隆抗体,4 ℃孵育过夜;PBS冲洗5 min×3次,滴加生物素标记的二抗室温孵育2 h;PBS冲洗5 min×3次,滴加ABC复合物室温孵育2 h;PBS冲洗5 min×3次,DAB显色,苏木素复染,常规脱水、透明,中性树胶封固,光镜下观察。LN蛋白阳性表达定位于细胞质,呈棕黄色颗粒状。每张切片随机选取5个400倍视野,采用Image-pro Plus5.0软件分析每个视野积分光密度值,以其平均值表示目的蛋白相对表达量。
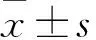
2 结果
2.1 各组肝组织病理变化 正常对照组肝组织可见肝小叶结构完整,仅在汇管区、中央静脉周围有少量胶原纤维沉积。模型组肝组织可见大量呈深蓝色的胶原纤维弥漫性增生、沉积,将正常肝小叶分隔包绕。与模型组相比,扶正化瘀胶囊组及健脾软肝方高、中、低剂量组肝组织中胶原纤维沉积相对减少,面积相对减小,分割包绕程度减轻。
2.2 各组肝窦基底膜超微结构变化 正常对照组肝窦内皮细胞呈扁平状,远侧胞质有许多不连续的窗孔,内皮下未见基底膜,Disse间隙内有少量的胶原纤维沉积。模型组肝窦内皮下可见到连续或不完整的基底膜,Disse间隙内可见胶原纤维束。扶正化瘀胶囊组及健脾软肝方高、中、低剂量组肝窦内皮下基底膜不完整,Disse间隙内胶原纤维较少,均较模型组有所改善。
2.3 各组ColⅣ mRNA表达比较 正常对照组ColⅣ mRNA相对表达量为0.910±0.017,模型组为3.041±0.505,扶正化瘀胶囊组为1.472±0.285,健脾软肝方高剂量组为2.601±0.270,健脾软肝方中剂量组为1.836±0.234,健脾软肝方低剂量组为2.349±0.649。与正常对照组比较,模型组ColⅣ mRNA相对表达量明显升高(P<0.05);与模型组比较,健脾软肝方中剂量组和扶正化瘀胶囊组ColⅣ mRNA相对表达量明显降低(P<0.05),健脾软肝方高、低剂量组虽然ColⅣ mRNA相对表达量均降低,但差异无统计学意义(P均>0.05)。健脾软肝方高、中、低剂量组间ColⅣ mRNA相对表达量比较差异无统计学意义(P均>0.05)。
2.4 各组LN mRNA和蛋白表达比较 见表1。

表1 各组LN mRNA和蛋白相对表达量比较
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与扶正化瘀胶囊组比较,△P<0.05;与健脾软肝方高剂量组比较,▲P<0.05。
3 讨论
中医并无肝纤维化这一名词,但类似描述最早记载于《灵枢·水胀篇》“腹胀,身皆大,色苍黄,腹筋起”。目前中医认为,肝纤维化属于“鼓胀”“积聚”“朦胀”“庙积”等范畴,治法以清热解毒、益气化瘀、软坚散结等为主[6,7]。中医药防治肝纤维化特色鲜明,已有多种方药用于临床。如有研究者采用芪叶保肝饮[8]、逍遥散[9]等复方治疗肝纤维化。苏涟等[4]研究认为,肝纤维化是在长期病理状况下肝的气机调节障碍、脏腑功能虚损,导致肝郁脾虚,瘀血阻络,应以健脾益气、理气活血、软肝化积为治则。健脾软肝方是苏涟教授治疗肝纤维化的有效经验方[4],该方由兰花参、三七、莪术、白芍、香附组成,兰花参健脾益气、补虚解表,三七化瘀止血、活血止痛,白芍敛阴养血柔肝,香附疏肝理气止痛,莪术破血行气止痛。诸药合用,相辅相成,行健脾益气、理气活血、软肝化积之功效。前期研究已证实,健脾软肝方能延缓肝纤维化形成。但对其可能的作用机制尚不清楚。
肝窦毛细血管化是肝纤维化过程中一个重要的病理改变,主要特征是肝窦内皮细胞失窗孔和内皮下基底膜形成[10,11]。因此,阻止基底膜形成可延缓肝纤维化发展。研究证实,基底膜的主要成分包括ColⅣ、LN、entactin、纤维连接蛋白等[12],其中ColⅣ、LN是肝窦基底膜形成的早期标志物[13,14]。生理状态下,肝窦内皮下无基底膜。当发生肝纤维化时,LN上的一个结构域可与ColⅣ结合,形成十字形立体结构异常沉积物,继而参与基底膜形成[15],影响肝细胞与血液间的物质交换,使肝细胞变性、坏死和肝窦塌陷[16],胶原纤维增生,长此恶性循环即可导致肝纤维化形成。黄月红等[17]研究也表明,CCl4诱导的早期肝纤维化大鼠基底膜是由ColⅣ与LN沉积共同构成。
扶正化瘀胶囊是临床常用治疗肝纤维化的中成药,其临床疗效已得到证实[18]。本研究结果显示,扶正化瘀胶囊组与健脾软肝方各剂量组用药后肝组织胶原纤维沉积均减少,基底膜病变均减轻,肝组织ColⅣ、LN表达均降低,证实健脾软肝方亦具有抗肝纤维化作用,与前期研究[19]结果一致。为进一步探讨健脾软肝方抗肝纤维化作用与基底膜有关,我们观察了肝窦基底膜超微结构及肝窦基底膜形成的早期标志物ColⅣ、LN表达变化,结果发现,模型组电镜下可见连续或不完整的基底膜形成,肝组织ColⅣ、LN mRNA及LN蛋白相对表达量均明显增加;与模型组比较,扶正化瘀胶囊组与健脾软肝方各剂量组肝窦内皮下基底膜形成延缓,Disse间隙内胶原纤维较少,肝组织ColⅣ、LN mRNA及LN蛋白表达降低。健脾软肝方各剂量组ColⅣ mRNA表达降低以中剂量组最为显著,高、低剂量组比较无明显统计学差异,其原因可能与样本较少有关。在下一步的工作中,我们将进一步对健脾软肝方抗肝纤维化是否通过作用于ColⅣ、LN起效、可能涉及哪些信号通路、如何调控进行深入研究,以期明确其作用机制,丰富健脾软肝方治疗肝纤维化的科学内涵。
综上所述,健脾软肝方能延缓CCl4诱导的肝纤维化大鼠基底膜形成,发挥抗肝纤维化作用;其作用机制可能与降低肝组织ColⅣ、LN表达有关。
参考文献:
[1] Braet F, Wisse E. Structural and functional aspects of liver sinusoidal endothelial cell fenestrae: a review[J]. Comp Hepatol, 2002,1(1):1-17.
[2] 陆雄,刘平.肝纤维化过程中一个重要的病理改变——肝窦毛细血管化[J].中华肝脏病杂志,2001,9(1):53-54.
[3] Yao Q, Lin Y, Li X, et al. Curcumin ameliorates intrahepatic angiogenesis and apillarization of the sinusoids in carbon tetrachloride-induced rat liver fibrosis[J]. Toxicol Lett, 2013, 222(1):72-82.
[4] 苏涟,张超,陈文慧,等.健脾活血柔肝法治疗慢性乙肝炎257例疗效观察[J].中西医结合肝病杂志,1998,8(增刊):52-53.
[5] 李仪奎.中药药理实验方法学[M].2版.上海:科学技术出版社,2006:120.
[6] 徐建良.盛国光治疗慢性乙型肝炎肝纤维化的经验[J].湖北中医杂志,2015,37(3):21-22.
[7] 陈文林,吴其恺.杨大国教授治疗肝纤维化及肝硬化用药特色[J].中华中医药杂志,2014,29(3):776-778.
[8] 牛春红,田新强,朱壮彦.芪叶保肝饮对大鼠肝脏纤维化及星形细胞活化的影响[J].时珍国医国药,2016,27(2):338-341.
[9] 李建民,王业秋,张宁,等.逍遥散保护受损肝细胞和抗肝纤维化的作用机理研究[J].时珍国医国药,2014,25(3):565-567.
[10] Deleve LD, Wang X, Guo Y. Sinusoidal endothelial cells prevent rat stellate cell activation and promote reversion to quiescence[J]. Hepatology, 2008,48(3):920-930.
[11] Xie G, Wang X, Wang L, et al. Role of differentiation of liver sinusoidal endothelial cells in progression and regression of hepatic fibrosis in rats[J]. Gastroenterology, 2012,142(4):918-927.
[12] Xu GF, Wang XY, Ge GL, et al. Dynamic changes of capillarization and peri-sinusoid fibrosis in alcoholic liver diseases[J]. World J Gastroenterol, 2004,10(2):238-243.
[13] 陆雄,刘成海,徐光福,等.大鼠肝纤维化形成中肝窦壁层黏连蛋白及IV型胶原蛋白的变化[J].世界华人消化杂志,2001,9(3):260-262.
[14] Arnaud A, Fontana L, Saez-Lara MJ, et al. Exogenous nucleosides modulate the expression of rat liver extracellular matrix genes in single cultures of primary hepatoeytes and a liver stellate cell line and in their co-culture[J]. Clin Nutr, 2004,23(5):43-51.
[15] DeLeve LD. Hepatic microvasculature in liver injury[J]. Semin Liver Dis, 2007,27(4):390-400.
[16] Ott P, Clemmesen O, Keiding S. Interpretation of simultaneous measurements of hepatic extraction fractions of indocyanine green and sorbitol: evidence of hepatic shunts and capillarization[J]. Dig Dis Sci, 2000,45(2):359-365.
[17] 黄月红,郭杞兰,陈治新,等.四氯化碳诱导肝纤维化早期大鼠肝窦内皮细胞及基底膜形态改变的动态研究[J].中国病理生理杂志,2014,30(8):1501-1505.
[18] 赵长青,吴艺青,徐列明.扶正化瘀胶囊抗肝纤维化的临床疗效和作用机制[J].中西医结合学报(英文版),2006,4(5):467-472.
[19] 陈文慧,魏东,马洁,等.健脾软肝方及拆方对CCl4肝纤维化大鼠MMP-2、MMP-9活性及蛋白表达的影响[J].云南中医学院学报,2007,30(1):29-32.

