Notch信号途径对放疗后骨髓谱系造血重建的影响及其机制
陈娟娟,周思朗,夏鸳鸯,赵永星,陈永乐,黄斯勇,吴必嘉
(1 中国人民解放军第四二一医院,广州510318;2 西安高新医院)
高度保守的Notch信号途径是造血调控最为关键的信号途径之一,需要通过相邻细胞间Notch受体与配体直接接触才能被激活[1,2]。造血细胞和造血微环境分别高表达Notch受体和Notch配体,这为干预造血重建提供了新思路[3]。目前已发现的5种Notch配体均具有扩增造血干细胞的生物学效应,尤其是Delta-like 1[4]。造血微环境中骨髓窦状内皮细胞是造血干细胞维稳和应激调控的重要结构和功能基础[5,6]。本课题组前期研究发现,在生理状态下Notch信号依赖内皮细胞促进造血干细胞体外扩增[7]。但目前尚无放疗等病理状态下Notch信号调控造血失稳态和谱系重建的体内研究[8,9]。2014年1月~2017年1月,我们利用骨髓造血细胞特异性敲除Notch信号关键转录因子RBP-J的转基因小鼠以及重组蛋白D1R激活Notch信号的野生型小鼠建立γ射线放疗模型,观察了Notch信号途径对放疗后造血重建和谱系重塑的影响,现分析结果并探讨其机制。
1 材料与方法
1.1 材料 RBP-Jflox/+转基因C57/B6小鼠8只,雌雄各半,8周龄,体质量18~22 g,由日本京都大学Tasuku Honjo教授馈赠。MxCre转基因C57/B6小鼠8只,雌雄各半,8周龄,体质量18~22 g,购自南京大学模式动物研究所。雄性C57/B6小鼠42只,8周龄,体质量20~22 g,购自第四军医大学实验动物中心。所有动物于SPF级实验动物房饲养,自由摄食及饮水,光照12 h明暗交替。主要仪器:60钴源(60Co-γ),第四军医大学辐照中心;倒置显微镜,德国Leica公司;FACScalibur流式细胞仪,美国BD公司;激光共聚焦显微镜,日本Olympus公司;化学发光成像仪,上海勤翔科学仪器有限公司。主要试剂及抗体:Notch配体重组蛋白D1R,本课题组自主研发;聚肌胞苷酸(poly:I-C),德国Sigma公司;APC标记的抗小鼠Lin抗体、FITC标记的抗小鼠CD3ε抗体,美国BD公司;FITC标记的抗小鼠Sca-1抗体,美国eBioscience公司;PE标记的抗小鼠c-Kit抗体、FITC标记的抗小鼠Ly-6G抗体、APC标记的抗小鼠CD11b抗体、APC标记的抗小鼠CD45R/B220抗体,美国Biolegend公司;兔源抗ICN1抗体,英国Abcam公司;Cy3标记的抗兔IgG抗体,武汉博士德生物工程有限公司;HRP标记的抗兔IgG抗体,德国Sigma公司;Anti-Ly-6G MicroBead Kit、Anti-CD11b MicroBead Kit,德国Miltenyi公司;兔抗小鼠PI3K抗体,美国Cell Signaling公司。
1.260Co-γ射线电离辐照对Notch信号敲除小鼠生存状态及造血重建影响的观察
1.2.1 Notch信号敲除小鼠模型建立 选择4只雌性MxCre转基因C57/B6小鼠、2只雄性RBP-Jflox/+转基因C57/B6小鼠,按雌雄比2∶1分成两笼并交配,获得第2代MxCre+RBP-Jflox/+小鼠9只(雌鼠6只、雄鼠3只),饲养至8周龄,按雌雄比2∶1分成三笼并交配,获得第3代骨髓造血细胞特异性敲除Notch信号经典转录因子RBP-J的双转基因MxCre+RBP-Jflox/flox小鼠18只(敲除组)和未敲除MxCre+RBP-Jflox/+对照小鼠18只(未敲除组)。两组饲养至5周龄,腹腔注射IFN-α诱生剂poly:I-C 300 μg,隔日1次,注射4次;之后每周注射1次,注射2次。共注射6次。
1.2.260Co-γ射线电离辐照 将上述行poly:I-C诱导小鼠饲养至8周龄,均接受全身一次性60Co-γ射线亚致死剂量600 cGy电离辐照,皮源距60 cm,吸收剂量率为156.44 cGy/min。
1.2.3 观察指标 ①生存状态:电离辐照后,每日早晚观察1次,记录小鼠精神、行为、毛发等改变,统计电离辐照第14天的死亡率。②造血重建情况:a.造血细胞形态:两组电离辐照第7天,取鼠尾血,载玻片常规推片;戊巴比妥钠麻醉后,取双侧股骨和胫骨骨髓细胞,载玻片常规推片;室温下瑞氏-吉姆萨染色15 min,流水冲洗约30 s,晾干,倒置显微镜下观察细胞数目、种类和形态。b.细胞免疫表型:两组电离辐照第7天,取骨髓、脾脏和眼球血细胞,红细胞裂解液裂红,300目尼龙膜过滤,洗涤,25%大鼠血清4 ℃封闭10 min,分别加入造血干/祖细胞抗体(Lin、Sca-1、c-Kit)、髓系细胞抗体(Ly6G、CD11b)、B淋巴细胞抗体(B220)、T淋巴细胞抗体(CD3ε),4 ℃避光孵育20 min,流式液洗涤2遍,300目尼龙膜二次过滤,流式液重悬,置于冰上备用。上机前加入PI染液,FACScalibur流式细胞仪检测细胞免疫表型,FlowJo软件分析数据。
1.360Co-γ射线电离辐照后激活小鼠Notch信号对造血重建影响的观察
1.3.1 Notch信号激活小鼠模型建立及60Co-γ射线电离辐照 取8周龄C57/B6雄鼠12只,随机分为激活组、未激活组,每组6只。两组均接受全身一次性60Co-γ射线亚致死剂量600 cGy电离辐照,皮源距60 cm,吸收剂量率为156.44 cGy/min。辐照后2 h,激活组腹腔注射Notch信号激活剂重组蛋白D1R 4 mg/kg,未激活组腹腔注射等体积PBS,之后每24 h腹腔注射1次,连续注射7天。
1.3.2 观察指标 ①重组蛋白D1R的体内活性:两组电离辐照第7天,戊巴比妥钠麻醉,完整剥离股骨,EDTA脱钙液37 ℃孵箱脱钙21天,OCT包埋,10 μm厚切片。1% BSA室温封闭30 min,兔源抗ICN1一抗4 ℃孵育12 h,Cy3标记的抗兔IgG二抗室温避光孵育2 h,1∶10 000稀释Hoechst 33258染细胞核15 min,50%甘油PBS封片,激光共聚焦显微镜下观察并采图。②造血重建情况:两组电离辐照第7天,取骨髓、脾脏和眼球血细胞,FACScalibur流式细胞仪检测,FlowJo软件分析数据。方法同1.2.3。③髓系前体细胞周期:两组电离辐照第7天,戊巴比妥钠麻醉,取股骨和胫骨骨髓细胞,红细胞裂解液裂红,300目尼龙膜过滤,洗涤,25%大鼠血清4 ℃封闭10 min,加入Ly6G和CD11b抗体,4 ℃避光孵育20 min;流式液洗涤,300目尼龙膜过滤,70%乙醇4 ℃固定30 min;流式液洗涤并重悬,上机前加入PI染液,FACScalibur流式细胞仪检测,FlowJo软件分析数据。④髓系前体细胞增殖信号通路:两组电离辐照第7天,戊巴比妥钠麻醉,取股骨和胫骨骨髓细胞,磁珠分选Ly6G+CD11b+细胞。RIPA∶PMSF=100∶1充分裂解细胞,4 ℃、12 000 r/min离心15 min,留取上清液,加入100 μg/15 μL蛋白上样缓冲液,100 ℃水浴10 min,使蛋白充分变性。然后行SDS-PAGE,200 mA稳定电流湿法转膜3 h,将蛋白电泳产物转印至PMSF膜上,用含5%脱脂奶粉的PBST封闭液室温摇床封闭2 h;加入兔抗小鼠PI3K一抗,4 ℃孵育12 h;室温洗膜4次,加入HRP标记的抗兔IgG二抗,室温避光孵育2 h;洗膜,Millipore发光液发光,化学发光成像仪显影。以β-actin为内参,采用Image J软件分析数据。
1.4 重组蛋白D1R激活电离辐照小鼠Notch信号对组织器官毒性作用观察 取8周龄C57/B6雄鼠18只,随机分为阴性对照组、D1R组、阳性对照组,每组6只。D1R组和阳性对照组均接受600 cGy60Co-γ射线电离辐照,阴性对照组不接受电离辐照。辐照后2 h,D1R组腹腔注射重组蛋白D1R 4 mg/kg,阳性对照组腹腔注射等体积PBS,方法同1.3.1。停药3个月,戊巴比妥钠麻醉,取心、肝、脾、肺、肾、胰,计算脾/体质量和肝/体质量,行HE染色,观察组织细胞形态;取股骨和胫骨骨髓以及外周血单个核细胞,按1.2.3中方法行流式细胞术检测骨髓造血干/祖细胞以及骨髓和外周血髓系细胞。
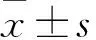
2 结果
2.1 电离辐照对Notch信号敲除小鼠生存状态及造血重建的影响 ①生存状态:两组电离辐照后均出现精神萎靡、反应迟钝,摄食减少、体质量下降,毛色晦暗。敲除组上述症状更为严重,且有2只出现放射性脑病症状。电离辐照第14天,未敲除组死亡6只,敲除组死亡12只,两组比较P<0.05。②有核细胞形态学变化:与未敲除组比较,敲除组骨髓和外周血有核细胞、造血干/祖细胞和髓系细胞数量明显减少,但形态正常。③各造血谱系细胞变化:见表1。
2.2 激活Notch信号对电离辐照小鼠造血重建的影响 ①重组蛋白D1R的体内活性:电离辐照第7天,与未激活组比较,激活组骨髓造血细胞Notch信号活化片段ICN1的核表达增多,Notch信号明显激活。②各造血谱系细胞变化:见表2。③髓系前体Ly6G+CD11b+细胞周期变化:见表3。④PI3K蛋白表达:未激活组与激活组PI3K蛋白相对表达量分别为0.26±0.05、0.82±0.16,两组比较P<0.01。

表1 未敲除组与敲除组电离辐照第7天各造血谱系细胞变化
注:LSK为Lin-Sca-1+c-Kit+造血干/祖细胞;与未敲除组比较,*P<0.05,#P<0.01。
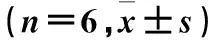
表2 未激活组与激活组电离辐照第7天各造血谱系细胞变化
注:与未激活组比较,*P<0.05,#P<0.01。

表3 未激活组与激活组髓系Ly6G+CD11b+细胞周期变化
注:与未激活组比较,*P<0.01。
2.3 重组蛋白D1R激活电离辐照小鼠Notch信号对组织器官的毒性作用 停药3个月,三组心、肝、脾、肺、肾、胰组织HE染色,细胞形态和组织构架差别不明显。三组脾/体质量、肝/体质量及骨髓和外周血各造血谱系细胞变化见表4。
3 讨论
血液肿瘤和实体瘤的传统治疗以手术、放疗、化疗和造血干细胞移植为主。约50%实体瘤及80%血液肿瘤在治疗过程中会发生急慢性造血功能抑制,近10%患者死于骨髓耗竭及全血细胞减少诱发的严重感染、出血等并发症[10]。放化疗相关的骨髓毒性反应和造血微环境损害存在难以复原的特点,容易导致造血恢复延迟、化疗周期脱落、自体移植动员困难等,目前临床上缺乏应对良策。传统造血生长因子主要通过刺激造血祖细胞增殖和分化,提升白细胞、血小板、血红蛋白等指标,存在过度刺激、提前消耗造血潜能以及促进肿瘤生长等隐患[11]。目前,骨髓应激损伤时造血干细胞与造血微环境失稳或重塑的细胞和分子机制尚不清楚,这为放化疗及造血干细胞移植相关急慢性造血功能抑制的新药研发带来困难。

表4 停药3个月阴性对照组、阳性对照组及D1R组骨髓和外周血各造血谱系细胞及脾/体质量、肝/体质量变化
注:与阴性对照组比较,*P<0.05,#P<0.01;与阳性对照组比较,△P<0.05,▽P<0.01。
研究显示,造血的动态平衡依赖于造血干细胞自身(如表面受体、信号通路等)和造血微环境(如基质细胞、细胞因子、黏附分子等)的精细调控[12,13]。作为造血微环境的重要支架细胞,骨髓窦状内皮细胞所表达的受体、配体、细胞因子、黏附分子和血管内分泌因子等是维持造血稳态和重建的必需条件[14]。Notch信号途径是调控造血干细胞胚胎发育、“干性”维持及体外扩增的关键信号[15],也是维系血管内皮细胞发育和功能的重要信号[16,17],不仅参与造血维稳[18],还可能调控造血失稳。本研究利用双转基因小鼠特异性敲除Notch信号的关键转录因子RBP-J,发现骨髓造血细胞Notch信号缺失使小鼠放疗相关死亡增加,造血干/祖细胞重建受阻,髓内外多系尤其是髓系重建障碍,不利于放疗小鼠造血功能的早期恢复。提示Notch信号途径在放疗后造血重建过程中可能发挥正向调控作用。
失稳态下窦状内皮细胞表达多种Notch受体和配体调控造血重建,目前关于Jagged1、Delta-like 1、Jagged2的研究最多。但Notch信号激活新药研发的难点在于无法准确介导受体和配体胞外段的内吞,不能完美暴露酶切位点,故药物活性欠佳。本课题组前期自主研发的高纯度新型Notch配体重组蛋白D1R具有靶向锚定内皮细胞、激活Notch信号途径的生物学特性[7]。本研究结果发现,重组蛋白D1R具有外源性激活造血龛内造血细胞经典Notch信号途径的生物学活性,可促进骨髓抑制小鼠早期造血重建,内源性扩增造血干/祖细胞,尤其有利于髓系细胞的谱系重塑,提高机体免疫力。该效应具有剂量相关性,低剂量无效,中剂量效果最佳,高剂量次之,这可能与Notch信号的激活依赖于受体和配体的相互作用有关。本研究还发现,重组蛋白D1R可激活放疗小鼠髓系前体细胞Notch信号下游的PI3K信号通路,继而推进细胞周期进程。但既往研究报道,Notch信号负性调控骨髓增殖性肿瘤[19,20],本研究结果与其相悖,这可能与体内复杂的调控网络相关,尚需进一步研究。
本研究结果发现,电离辐照对小鼠骨髓造成了慢性损伤,其远期造血重建能力受损;重组蛋白D1R可显现出良好的长期保护造血干细胞和髓系细胞的生物学作用;Notch激活小鼠未出现实体瘤、血液肿瘤等疾病的病理表现和症状体征,初步排除了D1R诱发二次肿瘤的可能性。提示短期激活Notch信号途径能长期安全维系放疗后造血重建,对接受放化疗或造血干细胞移植的恶性肿瘤患者具有重要意义。
Notch信号可在T、B淋巴细胞分化选择方面发挥重要作用,能决定着脾脏边缘带和滤泡B淋巴细胞的作用[21]。本研究发现,Notch敲除小鼠的脾脏B淋巴细胞减少,Notch激活小鼠的脾脏和外周血B淋巴细胞均升高,这些变化具有一过性,可能与髓系大量增殖、代偿性抑制淋系分化有关,其具体机制有待于深入研究。
综上所述,Notch信号途径在造血重建中具有正向调控作用;本研究通过局部靶向造血微环境富集治疗,动态观察了Notch信号途径参与放疗后造血维稳的体内过程,并初步探讨了细胞和分子学机制,为骨髓抑制防控药物的研发提供了新思路。
参考文献:
[1] Tanigaki K, Honjo T. Regulation of lymphocyte development by Notch signaling[J]. Nat Immunol, 2007,8(5):451-456.
[2] Guiu J, Shimizu R, D′Altri T, et al. Hes repressors are essential regulators of hematopoietic stem cell development downstream of Notch signaling[J]. J Exp Med, 2013,210(1):71-84.
[3] Lobry C, Oh P, Mansour MR, et al. Notch signaling: switching an oncogene to a tumor suppressor[J]. Blood, 2014,123(16):2451-2459.
[4] Csaszar E, Wang W, Usenko T, et al. Blood stem cell fate regulation by Delta-1-mediated rewiring of IL-6 paracrine signaling [J]. Blood, 2014,123(5):650-658.
[5] Ding L, Saunders TL, Enikolopov G, et al. Endothelial and perivascular cells maintain haematopoietic stem cells [J]. Nature, 2012,481(7382):457-462.
[6] Mirshekar-Syahkal B, Fitch SR, Ottersbach K. Concise review: from greenhouse to garden: the changing soil of the hematopoietic stem cell microenvironment during development [J]. Stem Cells, 2014,32(7):1691-1700.
[7] Tian DM, Liang L, Zhao XC, et al. Endothelium-targeted Delta-like 1 promotes hematopoietic stem cell expansion ex vivo and engraftment in hematopoietic tissues in vivo[J]. Stem Cell Res, 2013,11(2):693-706.
[8] Benveniste P, Serra P, Dervovic D, et al. Notch signals are required for in vitro but not in vivo maintenance of human hematopoietic stem cells and delay the appearance of multipotent progenitors[J]. Blood, 2014,123(8):1167-1177.
[9] Souilhol C, Lendinez JG, Rybtsov S, et al. Developing HSCs become Notch independent by the end of maturation in the AGM region[J]. Blood, 2016,128(12):1567-1577.
[10] Copelan EA. Hematopoietic stem-cell transplantation [J]. N Engl J Med, 2006,354(17):1813-1826.
[11] Li L, Li M, Sun C, et al. Altered hematopoietic cell gene expression precedes development of therapy-related myelodysplasia/acute myeloid leukemia and identifies patients at risk[J]. Cancer Cell, 2011,20(5):591-605.
[12] Morrison SJ, Scadden DT. The bone marrow niche for haematopoietic stem cells[J]. Nature, 2014,505(7483):327-334.
[13] Mendelson A, Frenette PS. Hematopoietic stem cell niche maintenance during homeostasis and regeneration [J]. Nat Med, 2014,20(8):833-846.
[14] Crane GM, Jeffery E, Morrison SJ. Adult haematopoietic stem cell niches[J]. Nat Rev Immunol, 2017,17(9):573-590.
[15] Bigas A, Espinosa L. Hematopoietic stem cells: to be or Notch to be[J]. Blood, 2012,119(14):3226-3235.
[16] Nolan DJ, Ginsberg M, Israely E, et al. Molecular signatures of tissue-specific microvascular endothelial cell heterogeneity in organ maintenance and regeneration[J]. Dev Cell, 2013,26(2):204-219.
[17] Kusumbe AP, Ramasamy SK, Itkin T, et al. Age-dependent modulation of vascular niches for haematopoietic stem cells[J]. Nature, 2016,532(7599):380-384.
[18] Konantz M, Alghisi E, Müller JS, et al. Evi1 regulates Notch activation to induce zebrafish hematopoietic stem cell emergence[J]. EMBO J, 2016,35(21):2315-2331.
[19] Klinakis A, Lobry C, Abdel-Wahab O, et al. A novel tumour-suppressor function for the Notch pathway in myeloid leukaemia[J]. Nature, 2011,473(7346):230-233.
[20] De Obaldia ME, Bell JJ, Wang X, et al. T cell development requires constraint of the myeloid regulator C/EBP-α by the Notch target and transcriptional repressor Hes1[J]. Nat Immunol, 2013,14(12):1277-1284.
[21] Han H, Tanigaki K, Yamamoto N, et al. Inducible gene knockout of transcription factor recombination signal binding protein-J reveals its essential role in T versus B lineage decision[J]. Int Immunol, 2002,14(6):637-645.

