过表达miR-18a-5p对结肠癌细胞增殖和凋亡的影响及其作用机制
玛依努尔·达吾提,胡尼其古丽·阿巴克,阿依努尔·玉苏普,祖丽胡玛尔·阿卜杜合力力,依米提·热合曼
( 新疆大学生命科学与技术学院,乌鲁木齐830046)
微小RNA(miRNA)是一类存在于真核生物中的内源性非编码单链小分子RNA[1],长度为20~25个核苷酸。成熟的miRNA以碱基互补配对原则与靶基因mRNA的非编码区结合,从而引起靶基因mRNA降解或抑制靶基因mRNA翻译,进而在转录后对基因表达起负性调控作用,主要参与细胞增殖、分化、凋亡以及生长发育等一系列生物学过程。近年研究发现,miRNA还与肿瘤的发生、发展有关[2,3]。miR-18a-5p为miR-17-92家族成员之一,之前称为miR-18a,基于miRbase更名为miR-18a-5p[4]。研究发现,在食管鳞癌、胰腺癌、甲状腺癌等多种肿瘤细胞可见miR-18a-5p差异表达,可能具有癌基因或抑癌基因作用[5~7]。2016年12月~2017年8月,本研究通过脂质体瞬时转染技术构建过表达miR-18a-5p的结肠癌细胞,观察过表达miR-18a-5p对结肠癌细胞生物学行为的影响,并对其可能的靶基因进行初步研究。现分析结果并报告如下。
1 材料
结肠癌SW480细胞,购自中国科学院上海细胞生物学研究所。靶基因特异性引物,由上海生工生物工程股份有限公司设计合成。miRNA真核质粒PGV514,上海吉凯基因化学技术有限公司。miR-18a-5p特异性引物,由北京天根生化科技有限公司合成。NanoDrop ND-2000核酸定量测定仪、Multiskan FCM酶标仪,美国Thermo Fisher Scientific公司;荧光倒置显微镜,日本奥林巴斯株式会社;流式细胞仪,美国Beckman公司;荧光定量PCR仪,美国Bio-Rad公司。LipofectaminTM3000转染试剂,美国Invitrogen公司;Annexin V-PE/7-AAD细胞凋亡检测试剂盒,美国BD公司;miRcute miRNA cDNA试剂盒、miRcute miRNA荧光定量检测试剂盒,北京天根生化科技有限公司;QuantiNovaTMSYBR®Green PCR Kit,德国QIAGEN公司;First Strand cDNA Synthesis Kit,美国Thermo Fisher Scientific公司;质粒小体试剂盒,美国Omega-Bio-Tek公司。
2 方法与结果
2.1 质粒表达构建与质粒DNA抽提 从miRbase数据库中获得成熟miRNA序列,按照hsa-miR-18a-5p(miRbas编号:MIMAT0000072)的成熟miRNA序列:UAAGGUGCAUCUAGUGCAGAUAG,设计合成带有末端保护碱基、BamHⅠ、XhoⅠ酶切位点的hsa-miR-18a-5p引物。引物序列:hsa-miR-18a-5p-XhoⅠ-F:5′-GTCCGGACTCAGATCTCGAGCTTGAAT-CTACTGCAGTGAAGGCACTTG-3′,hsa-miR-18a-5p-BamHⅠ-R: 5′-TATCTAGATCCGGTGGATCCGTGCA-ACTATGCAAAACTAACAG-3′。扩增pre-miR-18a-5p序列,构建真核过表达hsa-miR-18a-5p-PGV514-EGFP质粒(miR-18a-5p-eGFP)、插入空载体(5′-TTCTCCGAACGTGTCACGT-3′)的阴性对照CMV-EGFP-MCS-SV40-Neomycin质粒(NC-eGFP)。将miR-18a-5p-eGFP、NC-eGFP接种于含50 mg/mL卡那霉素的LB培养基中,220 r/min、37 ℃恒温摇床12~16 h,按质粒小体试剂盒说明抽提真核miRNA质粒DNA,核酸定量测定仪检测质粒DNA浓度和纯度合格,可用于后续实验。
2.2 细胞转染及转染效率验证 将SW480细胞接种于含10% FBS、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。每2~3天更换1次新的培养基,当细胞融合约90%时,用含0.25% EDTA的胰蛋白酶消化,按1∶2比例进行传代。取传4代对数生长期细胞,以4×106个/孔接种于6孔板,随机将细胞分为miR-18a-5p-eGFP组、NC-eGFP组、空白对照组。当细胞融合约70%时,miR-18a-5p-eGFP组加入含200 ng/μL miR-18a-5p-eGFP的质粒DNA 25 μL、LipofectaminTM3000 Reagent 3.75 μL和Opti-MEM培养基250 μL;NC-eGFP组加入含200 ng/μL NC-eGFP的质粒DNA 25 μL、LipofectaminTM3000 Reagent 3.75 μL和Opti-MEM培养基250 μL;空白对照组仅加入Opti-MEM培养基250 μL。各组均置于37 ℃、5% CO2细胞培养箱孵育6 h,弃去旧培养基,更换为含10% FBS的RPMI 1640完全培养基,之后每隔24 h更换1次新的培养基。转染12、24、48 h,荧光倒置显微镜下空白对照组未见绿色荧光,miR-18a-5p-eGFP组、NC-eGFP组均可见绿色荧光,表明转染成功,且以转染48 h效率最高。故选择转染48 h细胞进行后续实验。收集miR-18a-5p-eGFP组、NC-eGFP组转染48 h细胞,采用TRIzol法提取细胞总RNA,经核酸定量测定仪检测,OD260/OD280为1.8~2.0;经1.5%琼脂糖凝胶电泳检测,可见28、18 S两条RNA条带。说明提取的总RNA纯度和完整性符合实验要求。取总RNA 1 μg,按照miRNA cDNA试剂盒说明逆转录为cDNA。以cDNA为模板,按照miRNA荧光定量检测试剂盒说明进行PCR扩增。miR-18a-5p和内参U6的引物序列由北京天根生化科技有限公司提供。PCR反应体系共20 μL:2×miRcute miRNA Premix 10 μL,上下游引物各0.4 μL,cDNA 2 μL,RNase-Free ddH2O 7.2 μL;反应条件:94 ℃ 2 min,94 ℃ 20 s、60 ℃ 34 s共40个循环,最后55 ℃ 30 s。以U6为内参,采用2-ΔΔCt法计算miR-18a-5p相对表达量。结果发现,miR-18a-5p-eGFP组、NC-eGFP组、空白对照组miR-18a-5p相对表达量分别为17.19±0.98、7.32±0.51、2.97±0.66;与NC-eGFP组、空白对照组比较,miR-18a-5p-eGFP组miR-18a-5p相对表达量明显升高(P均<0.05),而NC-eGFP组与空白对照组比较P>0.05。表明此转染方法能使miR-18a-5p过表达,可用于后续实验。
2.3 过表达miR-18a-5p对SW480细胞增殖抑制率影响的观察 采用MTT法。预实验发现,NC-eGFP组和空白对照组细胞增殖抑制率比较P>0.05[8],故本次检测仅设miR-18a-5p-eGFP组和NC-eGFP组。取传4代对数生长期SW480细胞,按2.2中方法进行转染。转染48 h,每孔加入MTT 20 μL,继续培养4 h,1 000 r/min离心10 min,吸弃上清液;每孔加入DMSO 150 μL,轻轻振荡10 min,使结晶充分溶解。酶联免疫分析仪450 nm波长处检测各孔的吸光度(A)值,计算细胞增殖抑制率(Ri)。Ri=[1-(实验孔A450值-空白对照孔A450值)/(阴性对照孔A450值-空白对照孔A450值)]×100%。结果发现,miR-18a-5p-eGFP组、NC-eGFP组细胞增殖抑制率分别为(66.02±0.51)%、(23.81±0.64)%,两组比较P<0.05。
2.4 过表达miR-18a-5p对SW480细胞凋亡率影响的观察 采用流式细胞术。取传4代对数生长期SW480细胞,按2.2中方法进行分组、转染。转染48 h,收集各组细胞,4 ℃、800 r/min离心5 min,弃上清液,PBS重悬。收集含2×105个细胞的细胞悬液,4 ℃、800 r/min离心5 min,弃上清液,室温下加入1×Binding Buffer 400 μL,然后加入Annexin V-PE 5 μL和7-AAD 5 μL轻轻混匀,避光反应15~20 min。采用流式细胞仪自动检测早期凋亡率和晚期凋亡率。结果见表1。
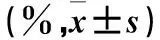
表1 三组转染48 h早期凋亡率和晚期凋亡率比较
注:与空白对照组比较,*P<0.05;与NC-eGFP组比较,#P<0.05。
2.5 miR-18a-5p过表达对SW480细胞靶基因表达影响的观察
2.5.1 miR-18a-5p靶基因预测与筛选 根据基因芯片结果,运用在线数据库miRanda、microCosm、Targetscan等预测miR-18a-5p的靶基因可参与MAPK、Wnt等信号通路,通过靶基因信号通路分析,筛选出miR-18a-5p的靶基因可能为DUSP5、FZD3、CCND2。
2.5.2 过表达miR-18a-5p对SW480细胞靶基因DUSP5、FZD3、CCND2表达的影响 采用qRT-PCR法。预实验发现,NC-eGFP组和空白对照组靶基因相对表达量比较P>0.05[8],故本次检测仅设miR-18a-5p-eGFP组和NC-eGFP组。取传4代对数生长期SW480细胞,按2.2中方法进行转染。转染48 h,收集两组细胞,采用TRIzol法提取细胞总RNA。经核酸定量测定仪和1.5%琼脂糖凝胶电泳鉴定,提取的总RNA纯度和完整性符合实验要求。取总RNA 1 μg,按照First Strand cDNA Synthesis Kit说明逆转录为cDNA。以cDNA为模板,按QuantiNovaTMSYBR®Green PCR Kit试剂盒说明进行PCR扩增。引物序列:DUSP5上游引物5′-AATGAGGTAGTTGGTTGAAGTAGC-3′,下游引物5′-AGAAGA-GGTGGAATGAGACAAGT-3′;FZD3上游引物5′-TGGCTCTCATAGTTGGCATTCC-3′,下游引物5′-ACCTGTCGGCTCTCATTCACT-3′;CCND2上游引物5′-TG-AGGAACAGAAGTGCGAAGA-3′, 下游引物5′-CTGAGGCTTGATGGAGTTGTC-3′; β-actin上游引物5′-CATCCGTAAAGACCTCTATGCCAAC-3′,下游引物5′-ATGGAGCCACCGATCCACADUSP-3′。PCR反应体系共20 μL:cDNA 1 μL,2×SYBR Green PCR Master Mix 10 μL,上下游引物各0.7 μL,RNase-Free ddH2O 7.6 μL;反应条件:95 ℃ 2 min,95 ℃ 5 s、60 ℃ 30 s共40个循环,最后55 ℃ 10 s。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。结果见表2。
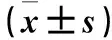
表2 两组miR-18a-5p的靶基因DUSP5、FZD3、CCND2相对表达量比较
注:与NC-eGFP组比较,*P<0.05。
3 讨论
miRNA是一种转录后调节基因表达的非编码小分子RNA,可通过与靶mRNA结合,抑制靶mRNA翻译过程或诱导靶mRNA降解,继而参与基因表达调控。生理状态下,miRNA主要参与生物体生长、发育、衰老、死亡等生命过程调控[9]。miRNA异常表达会影响靶基因表达,导致多种疾病的发生[10]。据报道,超过50%的miRNA位于肿瘤相关的基因区域或脆性位点,其异常表达与肿瘤的发生、发展有关[11]。miR-18a-5p是miRNA中的一种,属于miR-17-92家族成员,定位于染色体13q31.3,与抑癌基因GUGC序列结合发挥作用[12]。miR-18a-5p可在多种肿瘤细胞中差异表达。如在非小细胞肺癌、胰腺癌等恶性肿瘤细胞中miR-18a-5p表达上调,并通过靶向调控干扰素因子2,促进肿瘤细胞增殖和侵袭[13,14];miR-18a-5p还可下调肿瘤抑制基因PTEN表达,促进肿瘤进展[15]。
本研究通过脂质体瞬时转染法成功在SW480细胞过表达miR-18a-5p。结果发现,miR-18a-5p-eGFP组细胞增殖抑制率明显高于NC-eGFP组,说明miR-18a-5p过表达能抑制SW480细胞增殖。miR-18a-5p-eGFP组早期凋亡率、晚期凋亡率均明显高于NC-eGFP组和空白对照组,提示过表达miR-18a-5p可促进SW480细胞凋亡。
miRNA的功能主要取决于其下游靶基因的生物学效应。本研究对miR-18a-5p的靶基因进行预测,筛选出其靶基因可能为DUSP5、FZD3、CCND2。DUSP5是蛋白酪氨酸磷酸酶家族成员,其功能是磷酸酪氨酸和磷酸丝氨酸去磷酸化而起作用的MAPK负性调节剂[16]。MAPK信号通路是细胞内广泛存在的信号通路之一。Bellou等[17]研究发现,DUSP5能去磷酸化p-VEGF从而抑制肿瘤血管生成;在前列腺癌中DUSP5呈低表达,其表达变化可引起前列腺癌细胞生物学行为改变[18]。FZD3基因是FZD家族成员之一,其编码的卷曲蛋白是Wnt蛋白的受体,可与Wnt配体结合启动Wnt信号通路[19,20]。Pourreyron等[20]研究发现,FZD3与Wnt5a结合激发Wnt信号通路与非黑色素瘤皮肤癌的侵袭有关。CCND2是D型细胞周期蛋白家族成员,主要参与细胞周期调控。CCND2可参与PI3K-AKT信号通路,调控细胞增殖、凋亡和迁移等过程[21,22]。本研究结果显示,miR-18a-5p-eGFP组DUSP5、FZD3相对表达量高于NC-eGFP组,CCND2相对表达量低于NC-eGFP组。说明过表达miR-18a-5p通过靶向调控其靶基因DUSP5、FZD3、CCND2表达,继而调控MAPK、Wnt和PI3K/AKT等信号通路,参与肿瘤的发生、发展。
综上所述,过表达miR-18a-5p能够抑制结肠癌SW480细胞增殖并促进其凋亡,其机制可能与调控靶基因DUSP5、FZD3、CCND2表达有关。
参考文献:
[1] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism and function[J]. Cell, 2004,116(2):281-297.
[2] Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006,6(11):857-866.
[3] 郝莉,孙国平.miRNA作为大肠癌生物标志物的研究进展[J].安徽医药,2013,17(2):183-185.
[4] Ichihara A, Wang Z, Jinnin M, et al. Upregulation of miR-18a-5p contributes to epidermal necrolysis in severe drug eruptions[J]. J Allergy Clin Immunol, 2014,133(4):1065-1074.
[5] Xu XL, Jiang YH, Feng JG, et al. MicroRNA-17, microRNA-18a, and microRNA-19a are prognostic indicators in esophageal squamous cell carcinoma[J]. Ann Thorac Surg, 2014,97(3):1037-1045.
[6] Sand M, Skrygan M, Sand D, et al. Expression of microRNAs in basal cell carcinoma[J]. Br J Dermatol, 2012,167(4):847-855.
[7] Takakura S, Mitsutake N, Nakashima M, et al. Oncogenic role of miR-17-92 cluster in anaplastic thyroid cancer cells[J]. Cancer Sci, 2008,99(6):1147-1154.
[8] 胡尼其古丽·阿巴克,玛依努尔·达吾提,依米提·热合曼,等.蜂胶黄酮PB3A作用下结肠癌细胞株中miRNA-198和miRNA-296-5p的表达及功能预测[J].中国病理生理杂志,2017,33(7):1317-1322.
[9] 宛彦,程琳,王晓云,等.血管紧张素Ⅱ对小鼠胰岛β细胞miR-375表达的影响[J].山东医药,2015,55(24):4-6.
[10] Dong WH, Li Q, Zhang XY, et al. Deep sequencing identifies deregulation of microRNAs involved with vincristine drug-resistance of colon cancer cells[J]. Int J Clin Exp Pathol, 2015,8(9):11524-11530.
[11] 邓晰月,吴运妙,吴运妙,等.姜黄素对HeLa细胞增殖、迁移及miRNA表达谱的影响[J].中国妇幼保健,2015,30(26):4554-4558.
[12] Hamilton MP, Rajapakshe K, Harting SM, et al. Identification of a pan-cancer oncogenic microRNA superfamily anchored by a central core seed motif[J]. Nat Commun, 2013(4):2730.
[13] Liang C, Zhang X, Wang HM, et al. MicroRNA-18a-5p functions as an oncogene by directly targeting IRF2 in lung cancer[J]. Cell Death Dis, 2017,8(5):e2764.
[14] Morimura R, Komatsu S, Ichikawa D, et al. Novel diagnostic value of circulating miR-18a in plasma of patients with pancreatic cancer[J]. Br J Cancer, 2011,105(11):1733-1740.
[15] Zhang W, He W, Gao J, et al. The long noncoding RNA CASC2 inhibits tumorigenesis through modulating the expression of PTEN by targeting miR-18a-5p in esophageal carcinoma[J]. Exp Cell Res, 2017,361(1):30-38.
[16] Moon SJ, Lim MA, Park JS, et al. Dual-specificity phospha-tase 5 attenuates autoimmune arthritis in mice via reciprocal regulation of the Th17/Treg cell balance and inhibition of osteoclastogenesis[J]. Arthritis Rheumatol, 2014,66(11):3083-3095.
[17] Bellou S, Hink MA, Bagli E, et al. VEGF autoregulates its proliferative and migratory ERK1/2 and p38 cascades by enhancing the expression of DUSP1 and DUSP5 phosphatases in endothelial cells[J]. Am J Physiol Cell Physiol, 2009,297(6):C1477-C141489.
[18] 汤永峰,蔡超,陈果,等.双特异性磷酸酶5基因在良性前列腺增生症与前列腺癌中的表达及临床意义[J].中华临床医师杂志:电子版,2015,9(16):3006-3009.
[19] 丁林灿,郑斐斐,佘林,等.FZD3基因在涎腺腺样囊性癌转移与复发中的作用[J].福建医科大学学报,2013,47(2):85-88.
[20] Pourreyron C, Reilly L, Proby C, et al. Wnt5a is strongly expressed at the leading edge in non-melanoma skin cancer, forming active gradients, while canonical wnt signalling is repressed[J]. PLoS One, 2012,7(2):e31827.
[21] Chalhoub N, Baker SJ. PTEN and the PI3-kinase pathway in cancer[J]. Annu Rev Pathol, 2009(4):127-150.
[22] 王军义,夏源,杨翠婵,等.体外培养耳蜗毛细胞氧化应激损伤的微小RNA调控网络分析[J].中华耳鼻咽喉头颈外科杂志,2016,51(10):751-755.

