磷酸三钙磨损颗粒诱导小鼠假体周围骨细胞损伤的作用*
严嘉琦,张 云,刘方舒,蔡听听,童康强,朱 灿,胡露琦,吕淑敏
(1.绍兴文理学院医学院基础医学部,浙江绍兴312000;2.宁波市杭州湾医院儿科,浙江宁波315336)
人工关节(也称假体)翻修术回顾性研究发现聚乙烯(polyethylene,PE)、金属钛(titanium,Ti)和磷酸三钙(tricalcium phosphate,TCP)等三类松动假体可释放大量的磨损颗粒,这些颗粒可诱导假体周围组织细胞如巨噬细胞、成纤维细胞和成骨细胞等分泌大量的炎症因子[1],促进假体周围破骨细胞生成和骨溶解。因此,磨损颗粒诱导的假体周围骨溶解是假体关节松动和关节置换的主要原因之一。
假体周围除了含上述组织细胞外,还存在着丰富的骨细胞,其数量占骨组织细胞的90%~95%。骨细胞由成骨细胞分化而来,其胞体深埋于骨陷窝中,细胞间通过其丰富的伪足彼此连接形成通讯网络,维持自身生理功能或合成、分泌DMP-1及SOST等分子调控骨表面的成骨细胞和破骨细胞活动而调节骨重建与骨修复[2,3]。因此,骨细胞是维持成熟骨新陈代谢的主要细胞。以往研究结果显示PE、钴铬钼合金(Co-Cr-Mo)和TCP等磨损颗粒可诱导骨细胞 MLO-Y4损伤[2-4],释放破骨细胞活化因子 TNF-α、IL-1β、IL-6和 RANKL,后者促进破骨细胞分化、存活和骨溶解[1]。因此,骨细胞参与溶骨过程,可能是研究和防治假体周围骨溶解的另一种新的靶细胞。但是,目前有关骨细胞与磨损颗粒之间的关系研究较少,而且多为体外实验研究,不能真实地反应体内假体周围的系统性和复杂性。
本研究拟利用前期成功构建的磨损颗粒诱导小鼠颅骨溶解模型,模拟体内关节假体释放的磨损颗粒诱导假体周围骨溶解和无菌性松动病理过程[5-7],以小鼠颅骨溶解部位周围骨细胞为研究对象,探讨TCP磨损颗粒诱导假体周围骨细胞损伤情况,阐明其可能作用机制,为研究和防治假体周围骨溶解和关节松动提供新的靶细胞、新方法和新治疗靶点。
1 材料与方法
1.1 动物分组与模型建立
SPF级雄性ICR小鼠购于浙江省医学科学院实验动物中心(SCXK(浙)2014-0001)。实验前动物适应性饲养1周,环境温度22℃~24℃,湿度50%~70%,动物自由进食进水,自然昼夜节律光照。取36只雄性ICR小鼠随机分为3组(n=12):假手术(Sham)组、模型(TCP)组和 3-甲基腺嘌呤(3-methyladenine,3-MA)组。腹腔注射 1.5%戊巴比妥钠(60 mg/kg)麻醉小鼠后,无菌条件下取颅顶正中矢状切口,长约0.8 cm,分离皮下组织,显露出1 cm×1 cm颅骨区域,其中Sham组进行原位缝合。TCP组和3-MA组取TCP磨损颗粒30 mg置于小鼠颅骨中缝骨膜上缝合皮肤构建小鼠颅骨溶解模型,模拟体内关节假体周围磨损颗粒诱导假体骨溶解病理过程[5-7]。3-MA组小鼠于术后第2天颅顶皮下注射3-MA(1.0 mg/kg),2 d 1次,持续干预2周。假手术组小鼠颅骨顶皮下注射等量生理盐水,注射时间与3-MA组一致。实验结束后取血清和颅骨(以正中矢状缝为中心的方形区域)。
1.2 药品与试剂
TCP磨损颗粒由浙江大学化学系馈赠;鲎试剂购自上海吴昊经贸有限公司;SOST和 DMP-1的ELISA试剂盒购自武汉博士德生物工程有限公司;Annexin-V/PI凋亡检测试剂盒和超敏ECL化学发光检测试剂盒购自杭州联科生物技术有限公司;RIPA裂解液和HE染色液购自上海碧云天生物有限公司;3-MA购自美国 Selleck公司;DMP-1、SOST、Beclin-1、LC-3和β-actin等抗体购自美国Cell Signaling公司;PVDF膜购自美国Millipore公司。
1.3 Micro-CT扫描分析假体周围骨溶解
小鼠颅骨经4%多聚甲醛固定48 h后,行Micro-CT扫描(条件为电压 59 kV、电流 167μA、深度 16 bit、曝光时间 295 ms,分辨率为9.18μm)。将所有标本以完整骨组织为兴趣区域(region of interes,ROI)进行三维重建,应用三维重建处理软件和ABA专用骨骼分析软件计算颅骨骨密度(bone mineral density,BMD)、骨体积分数(bone volume fraction,BVF)和骨吸收孔数量的变化。
1.4 ELISA法检测血清中DMP-1和SOST水平
通过摘小鼠眼球取血,置于4℃冰箱放置30 min,经1 500 r/m离心10 min后取上层血清。利用牙本质基质蛋白 1(dentin matrix protein 1,DMP-1)和骨硬化蛋白(sclerostin,SOST)的ELISA试剂盒检测小鼠血清中DMP-1和SOST水平。
1.5 HE染色观察假体周围骨细胞活性
颅骨经10%甲醛固定 48 h和10%EDTA(pH 7.4)脱钙2周后进行石蜡包埋,后经切片机对颅骨矢状面连续切片 (5μm),脱蜡后行HE染色。置于IX70显微镜观察假体周围骨细胞活性及死亡(即空骨陷窝)情况变化,应用Image Pro-Plus 6.0(美国MediaCybernetics公司)软件分析单位面积内空骨陷窝数。
1.6 骨细胞的获取
参照Prideaux等[8]方法分离骨细胞。颅骨去除软组织和骨膜后,小鼠颅骨与0.2%IV型胶原酶溶液(用含 70 mmol/L NaCl,10 mmol/L NaHCO3,60 mmol/L山梨醇,30 mmol/L KCl,3 mmol/L K2HPO4,1 mmol/L CaCl2,0.1%BSA,0.5%葡萄糖 和 25 mmol/L HEPES)在 37℃培养箱中孵育 20 min。去除上清液,颅骨碎片在 37℃与含 5 mmol/L EDTA和0.1%BSA消化液中消化20 min,中间用移液器吹打1次。PBS冲洗后,重复以上消化步骤4次,收集最后2步消化后的上清液。经1 500 r/min离心10 min后取下层骨细胞。
1.7 流式细胞术定量分析骨细胞凋亡[9]
骨细胞与5μl Annexin V-FITC/碘化丙啶(propidium iodide,PI),10μl轻轻混匀后,避光室温温育15 min。然后加入200μl PBS并混匀,上流式细胞仪检测细胞凋亡情况。FITC的激发波长为488 nm,检测发射波长 575 nm(Ex:488 nm,Em:575 nm)。
1.8 Western blot法检测假体周围骨细胞自噬相关蛋白的表达[10]
骨细胞加入RIPA(100μl)裂解液冰上裂解30 min。经12 000 r/min离心15 min收集上清液即为总蛋白,通过BCATM试剂盒检测各组骨细胞总蛋白浓度。各组蛋白提取液加入上样缓冲液后煮沸10 min,冷却后每孔上样30μg蛋白,行12%SDS-PAGE分离蛋白,电泳完成后将蛋白转移到PVDF膜上,经5%脱脂牛奶常温封闭2 h后,分别加入兔源性一抗DMP-1(1∶500)、SOST(1∶500)、Beclin-1(1∶1 000)、LC-3(1∶1 000)和β-actin(1∶1 000)4°C孵育过夜。次日用TBST洗涤3次后加入HRP标记的二抗室温孵育2 h,TBST清洗3次加入ECL显色液;通过凝胶成像系统扫描分析各蛋白变化。
1.9 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(±s)表示,多组间比较采用单因素方差分析(one way ANOVA),组间两两比较采用Bonferroni矫正的 t检验。
2 结果
2.1 TCP磨损颗粒对假体周围骨溶解的影响
Micro-CT分析和三维重建结果显示:与Sham组相比,TCP组小鼠颅骨正中矢状缝发生明显骨溶解(图1),BMD、BV/TV和骨吸收孔数显著增加(P<0.05,表1),表明 TCP磨损颗粒可诱导假体周围骨溶解,该模型可用于研究假体周围骨细胞损伤。
2.2 TCP磨损颗粒对诱导假体周围骨细胞死亡的影响
HE染色显示:与Sham组比较,TCP组假体周围骨细胞活性明显降低,死亡数明显增加,表现为空骨陷窝数显著增加(41.52 count/mm2),为 Sham组(12.15 count/mm2)的 3.42倍(图 2)。流式细胞术定量分析结果表明TCP组假体周围骨细胞凋亡明显增加,其凋亡率从4.56%增加为39.41%,与 Sham组比较,差异具有统计学意义(P<0.05,图3)。

Fig.1 Micro-computed tomography(Micro-CT)for the calvaria osteolysis in mice
Tab.1 Changes in bone parameters(±s,n=3)

Tab.1 Changes in bone parameters(±s,n=3)
BMD:Bone mineral density;BV/TV:Bone volume fraction;TCP:Tricadcium phosphate*P<0.05 vs sham group
Group BMD(mg/cc) BV/TV(%)Number of porsity Sham 666.25±4.12 39.98±1.98 21.37±2.41 TCP 634.05±2.29*26.85±2.56*56.81±4.32*

Fig.2 Viability of periprosthetic osteocytes in the mouse calvaria(HE×200)

Fig.3 Flow analysis of osteocytes apoptosis in the mouse calvaria using Annexin-V/PI double labeling
2.3 TCP磨损颗粒对假体周围骨细胞功能损伤的影响
ELISA和免疫印迹结果显示:TCP磨损颗粒可诱导假体周围骨细胞功能损伤,表现为TCP组小鼠血清和假体周围骨细胞中DMP-1水平及蛋白表达均明显减少,而SOST水平及蛋白表达均显著增加,与Sham组比较,差异具有统计学意义(P<0.05,表2、图 4)。
Tab.2 Changes in serum levels of DMP-1 and SOST(ng/ml,±s,n=4)

Tab.2 Changes in serum levels of DMP-1 and SOST(ng/ml,±s,n=4)
DMP-1:Dentin matrix protein 1;SOST:Sclerostin*P<0.05 vs sham group
Group DMP-1 SOST Sham 56.36±5.31 34.78±3.04 TCP 22.13±2.70* 87.65±7.16*
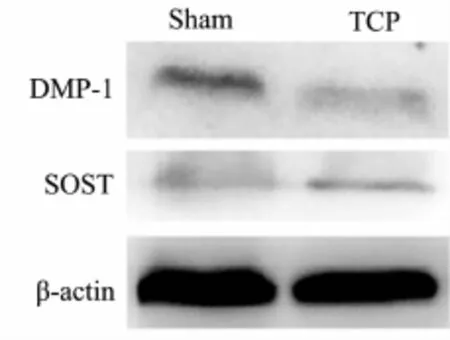
Fig.4 Protein expression of DMP-1 and SOST in the calvaria osteocytes
2.4 TCP磨损颗粒对假体周围骨细胞自噬的影响
Western blot结果显示:与Sham组比较,TCP组假体周围骨细胞发生自噬,表现为TCP组小鼠假体周围骨细胞自噬相关蛋白Beclin-1蛋白表达显著增加,LC-3I向 LC-3II转换明显增加,造成 LC-3II/LC-3I升高,Beclin-1表达和LC-3II/LC-3I比值分别增加为Sham组的2.53和1.73倍(图 5)。

Fig.5 Protein expression of Beclin-1 and LC-3 in the calvaria osteocytes
2.5 3-MA对TCP磨损颗粒诱导的假体周围骨细胞损伤影响的影响
与TCP组比较,3-MA组假体周围骨细胞损伤明显加重,表现为空骨陷窝数和骨细胞凋亡率显著增加,分别增加为 TCP组的1.70倍和 1.65倍(P<0.05,表 3)。
3 讨论
本研究首先通过Micro-CT分析证实了TCP磨损颗粒可诱导小鼠颅骨中缝发生骨溶解,成功模拟了关节假体周围磨损颗粒诱导的骨溶解病理过程,与以往报道结果基本一致[5-7]。因此,该模型可用于研究磨损颗粒所致的假体周围骨细胞损伤。在此基础上,本研究以假体周围含量丰富的骨细胞为研究对象,探讨TCP磨损颗粒诱导假体周围骨细胞损伤情况。结果显示TCP磨损颗粒可抑制假体周围骨细胞活性,诱导骨细胞死亡,增加空骨陷窝数量,释放能促进破骨细胞分化、存活和骨溶解的破骨细胞活化因子 TNF-α、IL-1β、IL-18和 IL-6[2-4],促进假体周围骨溶解。此外,TCP磨损颗粒还能诱导假体周围骨细胞功能损伤,表现为TCP组血清及假体周围骨细胞中DMP-1水平及其蛋白表达明显减少,血清SOST水平及其蛋白表达显著增加;而DMP-1减少和(或)SOST增加均能通过骨细胞自身丰富的伪足与假体周围成骨细胞和破骨细胞发生通讯连接,抑制成骨细胞骨矿化和骨形成、促进破骨细胞形成和骨溶解[2,3],调控假体周围骨重建与骨修复。因此,TCP磨损颗粒诱导的假体周围骨细胞DMP-1水平减少和SOST水平增加可促进假体周围骨溶解。
Tab.3 Effect of 3-MA on osteocytes injuries in the mouse calvaria(±s,n=4)

Tab.3 Effect of 3-MA on osteocytes injuries in the mouse calvaria(±s,n=4)
Group Empty osteocytes lacunae(1/mm2)Apoptosis(%)Sham 12.15±1.91 4.01±1.27 TCP 41.52±7.12* 35.49±4.61*3-MA 70.43±4.78# 58.87±4.61#
大量研究表明骨细胞的数量、活性及其功能对骨量的维持和骨重建起着重要的作用[2-4,8],而骨细胞凋亡常常伴随着骨质疏松症或骨关节炎等骨吸收疾病的发生,同时会引起骨脆性增加和骨修复能力减弱[11,12]。Emerton等[11]观察到雌激素缺乏的小鼠股骨皮质骨吸收与骨细胞凋亡呈正相关。2016年Cabahug-Zuckerman研究小组又发现后肢卸载的小鼠股骨皮质骨和骨小梁骨细胞发生凋亡及骨丢失显著;应用Caspase抑制剂QVD能显著抑制上述骨细胞凋亡骨吸收[12]。本研究发现TCP磨损颗粒能诱导假体周围骨细胞死亡及凋亡,与TCP磨损颗粒诱导的假体周围骨溶解趋势基本一致。推测骨细胞凋亡参与调控TCP磨损颗粒诱导的假体周围溶解。另外,有研究证实自噬调控成骨细胞和破骨细胞活动[13,14],在骨重建和骨吸收疾病中发挥重要的作用。但是,目前关于自噬参与骨细胞调控骨重建的研究并不多。Zahm等[15]研究显示自噬标志蛋白LC3II在正常小鼠和人的皮质骨骨细胞中高表达;2014年又有学者发现雌激素缺乏骨质疏松大鼠胫骨近端骨细胞自噬,且自噬的活化与氧化应激程度密切相关[16];2015年 Toscani等[17]也观察到蛋白酶抑制剂硼替佐米能减少多发性骨髓瘤患者骨细胞自噬和凋亡,促进骨细胞存活;本研究结果也显示TCP磨损颗粒可诱导假体周围骨细胞中自噬相关蛋白Beclin-1表达显著增加,LC-3I向 LC-3II转换明显。以上研究结果表明骨细胞自噬调节正常与病理性骨代谢。同时我们还发现颅顶局部注射自噬特异性抑制剂3-MA能明显促进TCP磨损颗粒诱导的假体周围骨细胞损伤,增加骨细胞凋亡,提示自噬也参与了TCP磨损颗粒诱导的假体周围骨细胞损伤。
综上,TCP磨损颗粒可通过激活自噬和凋亡诱导假体周围骨细胞损伤,促进假体周骨溶解和关节无菌性松动。但是,TCP磨损颗粒诱导假体周围骨细胞自噬是否与氧化应激的发生有关,还需要以后进行深入地探讨。
【参考文献】
[1] Dumbleton JH,Manley MT,Edidin AA.A literature review of the association between wear rate and osteolysis in total hip arthroplasty[J].J Arthroplasty,2002,17(5):649-661.
[2] Zhang Y,Yan M,Yu AY,et al.Inhibitory effects of beta-TCP wear particles on osteocytes MLO-Y4 via induction of rapid apoptosis and Akt inactivation[J].Toxicol,2012,297(1-3):57-67.
[3] Atkins GJ,Welldon KJ,Holding CA,et al.The induction of a catabolic phenotype in human primary osteoblasts and osteocytes by polyethylene particles[J].Biomaterials,2009,30(22):3672-3681.
[4] Kanaji A,Caicedo MS,Virdi AS,et al.Co-Cr-Mo alloy particles induce tumor necrosis factor alpha production in MLO-Y4 osteocytes:a role for osteocytes in particle-induced inflammation[J].Bone,2009,45(3):528-533.
[5] Wang R,Wang Z,Ma Y,et al.Particle-induced osteolysis mediated by endoplasmic reticulum stress in prosthesis loosening[J].Biomaterials,2013,34(11):2611-2623.
[6] Zawawi MS,Marino V,Perilli E,et al.Parthenolide reduces empty lacunae and osteoclastic bone surface resorption induced by polyethylene particles in a murine calvarial model of peri-implant osteolysis[J].J Biomed Mater Res A,2015,103(11):3572-3579.
[7] Lv S,Zhang Y,Mao HJ,et al.Inhibition of osteolysis after local administration of osthole in a TCP particles-induced osteolysis model[J].Int Orthop,2016,40(7):1545-1552.
[8] Prideaux M,Schutz C,Atkins GJ,et al.Isolation of osteocytes from human trabecular bone[J].Bone,2016,88:64-72.
[9] 杨力明,梁会娟,彭成海,等.羟基乙酰化姜黄素诱导的声动力治疗对巨噬细胞凋亡与坏死的影响[J].中国应用生理学杂志,2015,31(2):102-106.
[10]胡中慧,马慧萍,樊鹏程,等.PC12细胞在缺氧条件下的自噬现象[J].中国应用生理学杂志,2017,33(1):65-68.
[11] Emerton KB,Hu B,Woo AA,et al.Osteocyte apoptosis and control of bone resorption following ovariectomy in mice[J].Bone,2010,46(3):577-583.
[12]Cabahug-Zuckerman P,Frikha-Benayed D,Majeska RJ,et al.Osteocyte apoptosis caused by hindlimb unloading is required to trigger osteocyte RANKL production and subsequent resorption of cortical and trabecular bone in mice femurs[J].J Bone Miner Res,2016,31(7):1356-1365.
[13]Xi G,Rosen CJ,Clemmons DR.IGF-I and IGFBP-2 Stimulate AMPK activation and autophagy,which are required for osteoblast differentiation[J].Endocrinol,2016,157(1):268-281.
[14]McManus S,Bisson M,Chamberland R,et al.Autophagy and phospho-inositide dependent kinase1(PDK1)-related kinome in pagetic osteoclasts[J].JBone Miner Res,2016,31(7):1334-1343.
[15] Zahm AM,Bohensky J,Adams CS,et al.Bone cell autophagy is regulated by environmental factors[J].Cells Tissues Organs,2011,194(2-4):274-278.
[16]Yang Y,Zheng X,Li B,et al.Increased activity of osteocyte autophagy in ovariectomized rats and its correlation with oxidative stress status and bone loss[J].Biochem Biophys Res Commun,2014,451(1):86-92.
[17]Toscani D,Palumbo C,Dalla Palma B,et al.The proteasome inhibitor,bortezomib,maintains osteocyte viability in multiple myeloma patients by reducing both apoptosis and autophagy:a new function for proteasome inhibitors[J].J Bone Miner Res,2016,31(4):815-827.

