内质网过度应激在肺缺血/再灌注小鼠心肌损伤中的作用*
项冰倩,高 慧,郝卯林,戴雍月,王万铁
(温州医科大学缺血/再灌注损伤研究所,浙江温州325035)
肺缺血 /再灌注损伤(ischemia/reperfusion injury,I/RI)是肺溶栓治疗、肺移植、肺切除等手术常见的病理过程。肺缺血/再灌注引发急性肺损伤的同时还可诱发远隔器官损伤,如脑、心脏、肝及肾脏等。心脏血流量和耗氧量大,对缺血缺氧较为敏感,是较易受累的器官。肺缺血再灌注引起的缺血、缺氧可诱发内质网应激(endoplasmic reticulum stress,ERS),内质网应激是指当机体发生缺血、缺氧,氧化应激,葡萄糖/营养物质匮乏,异常糖基化反应和钙离子稳态失衡等时,内质网未折叠蛋白明显增多,当超出内质网处理能力时,细胞会激活未折叠蛋白反应、内质网超负荷反应和Caspase 12介导的凋亡通路等信号途径,来应对条件的变化和恢复内质网良好的蛋白质折叠环境。适度的ERS可恢复细胞内环境稳态和维持细胞存活,但持续过强的ERS则会导致细胞凋亡甚至死亡,在缺血/再灌注损伤中起重要作用[1-3]。前期的研究结果表明,过度内质网应激参与了肺缺血/再灌注损伤,且抑制内质网应激能减轻肺I/R损伤[1,4],但其是否参与了肺 I/R诱发的心肌损伤目前尚未见有关报道。因此本研究在肺缺血/再灌注模型上通过使用ERS激动剂衣霉素及抑制剂4-苯丁酸来探讨内质网应激在肺缺血再灌注小鼠心肌损伤中的作用,为临床防治肺I/R引起的远隔器官损伤提供科学依据。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂 二甲基亚砜(dimathy sulfoxide,DMSO)(上海申工生物技术有限公司);衣霉素(tunicamycin,TM)和 4-苯丁酸(4-phenylbutyric acid,PBA)(Sigma公司);氯胺酮和塞拉嗪(中国福建古田药业有限公司);Caspase 3酶活性检测试剂盒和BCA蛋白定量试剂盒(碧云天生物技术研究所);TUNEL试剂盒(瑞士 Roche公司);肌酸激酶同工酶(creatine kinase-MB,CK-MB)及乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒(南京建成生物工程研究所);逆转录试剂盒(Thermo公司);葡萄糖调节蛋白78(glucose regulated protein 78,GRP78),c-Jun氨基末端激酶(c-JunN-terminalkinase,JNK),p-Jun氨基末端激酶(p-JunN-terminalkinase,p-JNK),天冬氨酸特异性半胱氨酸蛋白酶-12(cysteinylaspartate specific proteinase 12,Caspase 12)和 CCAAT增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)一抗(Cell Signaling Technology公司,美国);辣根酶标记山羊抗兔二抗(中国博蕴);一抗稀释液(碧云天生物技术研究所);PVDF膜(德国 Millipore公司);胎牛血清(美国 Gibco公司);脱脂奶粉(美国BD公司)。
1.1.2 主要仪器 UV-800全自动凝胶成像分析系统(温州奥利生物医学仪器厂);光学显微镜(Nikon,日本尼康);高速冷冻离心机(Thermo,美国);全自动生化分析仪(7600-020,日本日立公司产品);紫外分光光度计(Ultrospec 2100pro Amersham BioSciences,美国);PCR热循环仪(LifePro,杭州博日科技有限公司);多功能酶标仪(Thermo,美国);蛋白电泳/转膜仪(BIO-RAD,美国);电热恒温水温箱(上海贺德试验设备厂);DYY-5型稳压稳流电泳仪(北京市六一仪器厂)。
1.2 动物模型与干预
1.2.1 实验动物与模型建立 雄性健康 SPF级C57BL/6J小鼠40只,体质量 20~24 g,8~10周龄,由温州医科大学实验动物中心提供【SYXK(浙)2012-075】。依据文献采用C57BL/6J小鼠在体左侧肺门夹闭制备缺血/再灌注(I/R)模型[5]。腹腔注射 100 mg/kg氯胺酮和塞拉嗪 10 mg/kg麻醉,维持体温36.5℃~37.5℃。消毒胸颈部皮肤后切开并分离皮下组织和肌肉,暴露气管T型切开,气管插管后接呼吸机行机械通气,呼吸机参数为:吸呼比2∶3,呼吸频率 120 counts/min,100%氧浓度,潮气量 0.6~0.8 ml/min。于左胸部3~5肋间处开胸并游离左侧肺门,用动脉夹阻断左肺门,30 min后松开动脉夹再灌注180 min制备肺缺血再灌注模型。Sham组仅行开胸处理,不夹闭肺门,机械通气210 min;TM组、4-PBA组分别于造模前30 min腹腔注射衣霉素1 mg/kg和 4-苯基丁酸 400 mg/kg,再制备肺缺血/再灌注模型。
1.2.2 动物分组与干预 采用随机数字表法,将其分为 4组(n=10):假手术组(Sham组)、缺血/再灌注组(I/R组)、ERS通路激动剂衣霉素(Tunicamycin,TM)组,ERS通路抑制剂4-PBA组。TM组、4-PBA组分别于造模前30 min腹腔注射衣霉素1 mg/kg和4-PBA 400 mg/kg,再制备肺缺血/再灌注模型。
1.3 检测方法
1.3.1 光镜下心肌组织形态学观察 开胸取出心肌组织后,取约0.5 cm×0.5 cm×0.5 cm大小心肌组织,经4%甲醛固定,常规进行石蜡包埋切片,HE染色后光镜下观察各组标本组织学改变。
1.3.2 心肌酶检测 再灌注180 min时,眼眶取血,于-80℃冰箱保存。按照CK-MB及 LDH试剂盒操作说明书用全自动生化分析仪检测血清CK-MB及LDH的浓度。
1.3.3 TUNEL法检测心肌细胞凋亡指数 石蜡包埋心肌组织并切片,依次经染色、二甲苯、无水乙醇、95%和75%乙醇、PBS漂洗后加入蛋白酶K溶液去除组织蛋白,蒸馏水漂洗后按照TUNEL试剂盒操作说明书进行操作,光学显微镜(×400)下观察心肌细胞凋亡情况。细胞核呈现棕黄色者为阳性细胞,即凋亡细胞。每张切片400倍光镜下随机选择10个视野并记录总细胞数和阳性凋亡细胞数,计算凋亡指数(apoptosis index,AI),AI=(凋亡细胞数/总细胞数)×100%。
1.3.4 Caspase 3酶活性检测 按每3~10 mg心肌组织加入100μl裂解液的比例加入裂解液,冰上研磨成匀浆,转移到1.5 ml离心管中冰中裂解5 min。4℃,20 000 r/min离心 10~15 min后转移上清液,按照Caspase 3活性检测试剂盒操作说明书进行操作,采用分光光度计法检测心肌组织中Caspase 3酶活性。
1.3.4 Western blot分析 取心肌组织,低温下充分研磨,400μl RIPA(含 4μl PMSF)裂解组织,混匀后取匀浆液4℃离心取上清,BCA蛋白定量试剂盒测定蛋白浓度并绘制标准曲线。将蛋白样品制成2 μg/μl,煮沸 10 min变性。凝胶电泳,上样量 20μl,湿转至PVDF膜,5%脱脂奶粉室温封闭2 h,TBST漂洗,JNK、GRP78、CHOP一抗(1∶1 000)、GAPDH、Caspase12一抗(1∶800),4℃孵育过夜。TBST洗涤 3次,每次7 min,加入二抗室温孵育1 h。TBST洗涤3次,每次5 min,加ECL工作液反应2 min,暗室曝光,显影、定影后,凝胶分析软件分析蛋白吸光度值。p-JNK条带灰度值和JNK条带灰度值之比表示p-JNK蛋白相对含量,Caspase 12、CHOP、GRP78条带灰度值和内参GAPDH灰度值之比表示Caspase 12、CHOP、GRP78蛋白相对含量。
1.3.4 RT-PCR分析 取心肌组织加液氮研磨,Trizol法提取总RNA,测定RNA浓度,按照RT-PCR试剂盒说明书进行cDNA合成及扩增。PCR参数,预变性:94℃,3 min;变性:94℃,30 s;退火:JNK(56℃),Caspase 12(58℃),CHOP(54℃),GRP78(49℃),GAPDH(58℃),30 s;延伸:72℃,1 min;终止延伸:72℃,5 min;循环33次。RT-PCR以GAPDH为内参。引物序列见表1。结果用Quantity One分析。JNK、Caspase 12、CHOP、GRP78 mRNA条带灰度值和内参GAPDH条带灰度值的比值表示 JNK、Caspase 12、CHOP、GRP78 mRNA相对含量。
1.4 统计学方法
采用SPSS19.0软件进行分析,正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析。

Tab.1Sequences of the primers
2 结果
2.1 小鼠肺缺血/再灌注损伤后光镜下心肌组织形态学观察
光学显微镜结果显示:Sham组心肌组织结构和细胞层次清晰可见,细胞排列整齐紧密,形态正常。I/R组心肌细胞间隙和细胞体积稍增大,胞质疏松、淡染,水肿较明显。TM组细胞明显水肿,伴有部分细胞坏死。4-PBA组细胞排列尚规则,体积稍大,呈轻度水肿改变(图1)。
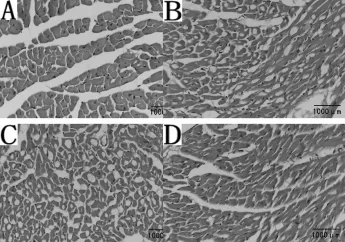
Fig.1 Morphologic changes of heart tissue in each group(HE×200)
2.2 小鼠肺缺血/再灌注损伤后血清 CK-MB和LDH活性观察
与Sham组相比,其余3组CK-MB和LDH活性均明显升高(P<0.01);与 I/R组相比,TM组 CKMB和LDH活性明显升高(P<0.01),4-PBA组则明显下降(P<0.01);与 TM组相比,4-PBA组明显下降(P<0.01,表 2)。
Tab.2 The change of CK-MB and LDH(U/L,±s,n=10)
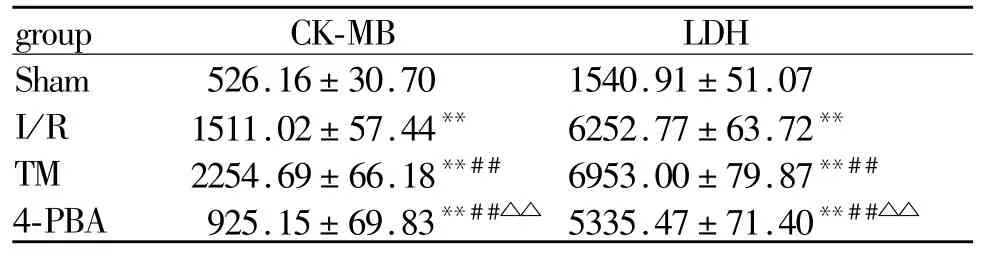
Tab.2 The change of CK-MB and LDH(U/L,±s,n=10)
Sham:Sham group;I/R:Ischemia/reperfusion injury group;TM:Tunicamycin group;4-PBA:4-phenylbutyric acid group;CKMB:Creatine kinase-MB;LDH:Lactic dehydrogenase**P<0.01 vs sham group;##P<0.01 vs I/R group;△△P<0.01 vs TM group
group CK-MB LDH Sham 526.16±30.70 1540.91±51.07 I/R 1511.02±57.44** 6252.77±63.72**TM 2254.69±66.18**##6953.00±79.87**##4-PBA 925.15±69.83**##△△ 5335.47±71.40**##△△
2.3 小鼠肺缺血/再灌注损伤后心肌细胞凋亡指数观察
TUNEL染色结果显示:与Sham组相比,其余3组细胞凋亡指数均明显升高(P<0.01);与 I/R组相比,TM组细胞凋亡指数明显升高(P<0.01),4-PBA组则明显下降(P<0.01);与 TM组相比,4-PBA组细胞凋亡指数明显下降(P<0.01,表 3,图 2)。
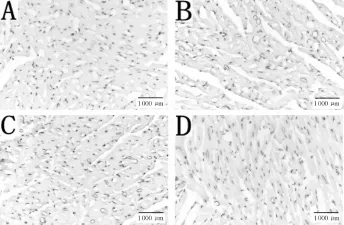
Fig.2 Cell apoptosis index of heart tissue in each group(TUNEL×200)
2.4 小鼠肺缺血/再灌注损伤后心脏组织中Caspase 3酶活性观察
Caspase 3酶活性结果显示,与Sham组相比,其余3组Caspase 3酶活性均明显升高(P<0.01);与I/R组相比,TM组Caspase 3酶活性明显升高(P<0.01),4-PBA组则明显下降(P<0.01);与 TM组相比,4-PBA组明显下降(P<0.01,表 3)。
Tab.3 Change of cell apoptosis index and Caspase 3 enzymatic activity(±s,n=10)

Tab.3 Change of cell apoptosis index and Caspase 3 enzymatic activity(±s,n=10)
Sham:Sham group;I/R:Ischemia/reperfusion injury group;TM:Tunicamycin group;4-PBA:4-phenylbutyric acid group**P<0.01 vs sham group;##P<0.01 vs I/R group;△△P<0.01 vs TM group
Caspase 3 Sham 13.05±3.40 37.74±7.16 I/R 75.85±4.49** 127.74±8.72**TM 86.63±4.24**## 220.61±14.69**##4-PBA 60.18±4.14**##△△ 83.58±8.10**##Group Apoptosis index(%)△△
2.5 小鼠肺缺血/再灌注损伤后心肌组织 JNK、Caspase 12、CHOP、GRP78 mRNA表达水平的变化
与Sham组相比,其余 3组 JNK、Caspase 12、CHOP和GRP78 mRNA表达水平均明显升高(P<0.01);与 I/R组相比,TM组 JNK、Caspase 12、CHOP和GRP78 mRNA表达水平明显升高(P<0.01),4-PBA组则明显下降(P<0.01);与 TM组相比,4-PBA组mRNA表达水平明显下降(P<0.01,表4)。
2.6 小鼠肺缺血/再灌注损伤后心肌组织p-JNK、Caspase 12、CHOP、GRP78蛋白表达水平的变化
与Sham组相比,其余 3组 p-JNK、Caspase 12、CHOP和GRP78蛋白表达水平均明显升高(P<0.01);与 I/R组相比,TM组 p-JNK、Caspase12、CHOP和GRP78蛋白表达水平明显升高(P<0.01),4-PBA组则明显下降(P<0.01);与 TM组相比,4-PBA组蛋白表达水平明显下降(P<0.01,表5)。
3 讨论
I/R是临床常见的病理过程,器官 I/R时细胞内信号转导涉及多条途径,其中ERS和JNK信号转导通路在脏器I/R中起重要作用[1]。内质网应激发生时,ERS既能诱导GRP78、GRP94等内质网分子伴侣表达而产生保护效应,亦能独立地诱导细胞凋亡。
Tab.4 Expression levels of JNK,Caspase 12,CHOP and GRP78 mRNA in each group(±s,n=10)
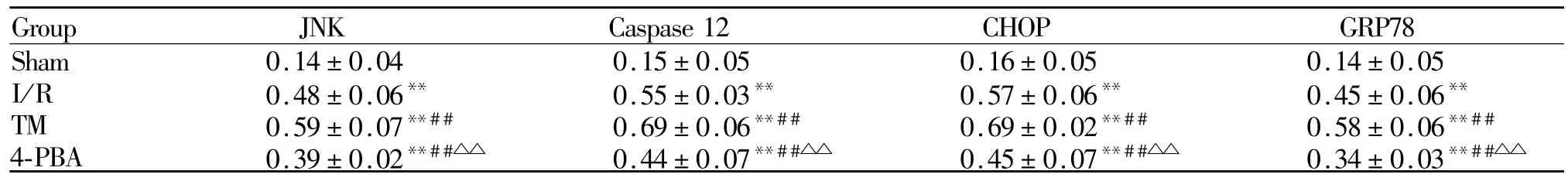
Tab.4 Expression levels of JNK,Caspase 12,CHOP and GRP78 mRNA in each group(±s,n=10)
Sham:Sham group;I/R:Ischemia/reperfusion injury group;TM:Tunicamycin group;4-PBA:4-phenylbutyric acid group;JNK:c-JunN-terminalkinase;Caspase 12:Cysteinylaspartate specific proteinase-12;CHOP:CCAAT/enhancer-binding protein homologous protein;GRP78:Glucose regulated protein 78**P<0.01 vs Sham group;##P<0.01 vs I/R group;△△P<0.01 vs TM group
Group JNK Caspase 12 CHOP GRP78 Sham 0.14±0.04 0.15±0.05 0.16±0.05 0.14±0.05 I/R 0.48±0.06** 0.55±0.03** 0.57±0.06** 0.45±0.06**TM 0.59±0.07**## 0.69±0.06**## 0.69±0.02**## 0.58±0.06**##4-PBA 0.39±0.02**##△△ 0.44±0.07**##△△ 0.45±0.07**##△△ 0.34±0.03**##△△
Tab.5 Expression levels of p-JNK,Caspase 12,CHOP and GRP78 protein in each group(±s,n=10)
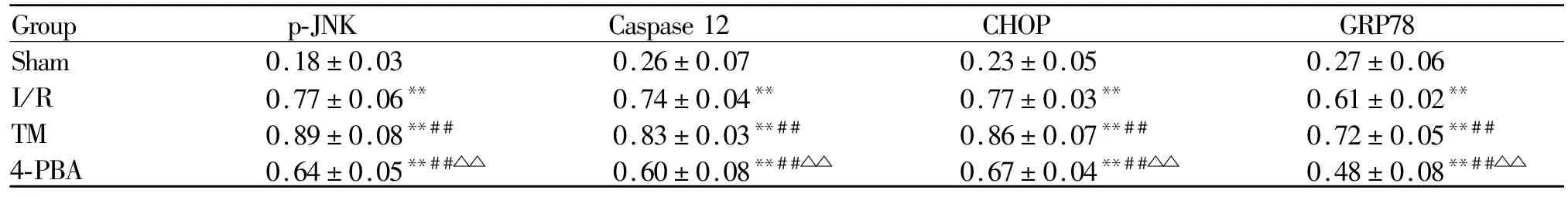
Tab.5 Expression levels of p-JNK,Caspase 12,CHOP and GRP78 protein in each group(±s,n=10)
Sham:Sham group;I/R:Ischemia/reperfusion injury group;TM:Tunicamycin group;4-PBA:4-phenylbutyric acid group;JNK:c-JunN-terminalkinase;Caspase 12:Cysteinylaspartate specific proteinase 12;CHOP:CCAAT/enhancer-binding protein homologous protein;GRP78:Glucose-regulated protein 78**P<0.01 vs Sham group;##P<0.01 vs I/R group;△△P<0.01 vs TM group
Group p-JNK Caspase 12 CHOP GRP78 Sham 0.18±0.03 0.26±0.07 0.23±0.05 0.27±0.06 I/R 0.77±0.06** 0.74±0.04** 0.77±0.03** 0.61±0.02**TM 0.89±0.08**## 0.83±0.03**## 0.86±0.07**## 0.72±0.05**##4-PBA 0.64±0.05**##△△ 0.60±0.08**##△△ 0.67±0.04**##△△ 0.48±0.08**##△△
ERS通路激动剂衣霉素是N-乙酰葡糖胺磷酸转移酶的抑制剂,可抑制N-蛋白质糖基化作用的第一步催化反应,引起蛋白质糖基化障碍,诱导未折叠蛋白积聚,导致体内外发生广泛的内质网应激反应[6-8]。是目前体外用于诱导内质网应激较经典的药物[9,10]。ERS抑制剂 PBA是一种化学性分子伴侣,可通过抑制内质网应激减轻非折叠蛋白反应并进一步减轻组织损伤。
本实验中GRP78的急速上调被认为是ERS最敏感的标志物[11,12]。JNK信号通路是 ERS的凋亡途径之一。有研究表明,在脏器I/R损伤过程中,JNK发生过度激活,而在缺血或再灌注前抑制JNK激活可明显减少细胞凋亡,减轻脏器 I/R损伤[13-15]。Caspase 12广泛存在于小鼠的各组织中,是ERS的主要凋亡信号分子之一,内质网内钙离子平衡的失调或者内质网蛋白积累过多都会导致Caspase 12的表达。过度的ERS可引起其他Caspase家族如Caspase 9和Caspase 3的活化,引起一系列的级联反应,最终导致细胞凋亡的发生[16,17]。CHOP是促凋亡的重要信号分子,是ERS特异的转录因子,在正常情况下表达水平很低,而在ERS时,其表达量大大增加,被认为是内质网应激的标志物[18]。细胞凋亡是程序性细胞死亡(programmed cell death,PCD),可被多种细胞信号激活,主要信号通路有线粒体途径与死亡受体途径。细胞内的凋亡信号通常激活线粒体途径,释放线粒体促凋亡蛋白及凋亡诱导因子(apoptosis inducing factor,AIF)等,激活 Caspase级联反应,诱发细胞凋亡。
本实验光镜结果说明肺缺血/再灌注引发了内质网应激并造成心肌损伤,而ERS通路抑制剂4-PBA能明显降低心肌组织损伤性因子的表达,减轻心肌组织学损伤性结构的改变,对心肌组织起到了有效的保护作用,其机制可能与抑制内质网应激通路有关。邹麓等[19]研究表明大鼠离体心肌细胞的损伤与ERS相关的凋亡密切相关,缺血后处理能减轻大鼠离体心脏缺血/再灌注损伤,可能与抑制PERK通路介导的ERS相关凋亡相关。除此之外,梁向艳等人的研究[20]亦表明血管钠肽可减轻糖尿病大鼠缺血/再灌注心脏损伤,可能是通过cGMPPKG信号通路抑制内质网应激及细胞凋亡促进心脏功能恢复。
综上所述,过度内质网应激参与肺缺血/再灌注心肌损伤,抑制内质网应激能减轻心肌组织损伤。
【参考文献】
[1] 郝卵林,赵 珊,陈海娥,等.siRNA沉默过度内质网应激下JNK基因在缺血/再灌注肺损伤中的作用[J].中国应用生理学杂志,2014,30(1):48-53.
[2] Zhang ZZ,Tong NT,Gong YY,et al.Valproate protects the retina from endoplasmic reticulum stress-induced apoptosis after ischemia-reperfusion injury[J].Neurosci Lett,2011,504(2):88-92.
[3] Yousefi H,Ahmadiasl N,Alihemmati A,et al.Effect of renal ischemian-reperfusion on lung injury and inflammatory responses in male rat[J].Iran J Basic Med Sci,2014,17(10):802-807.
[4] 罗梓垠,郭长满,项冰倩,等.右美托咪定对肺缺血/再灌注损伤小鼠内质网应激相关分子Caspase-12表达的影响[J].中国应用生理学杂志,2016,32(2):164-168.
[5] 万占海,张 红,冷玉芳,等.右美托咪定对大鼠肺缺血再灌注损伤的影响[J].中华麻醉学杂志,2014,34(9):1066-1068.
[6] Rutkowski DT,Arnold SM,Miller CN,et al.Adaptation to ERstress is mediated by differential stabilities of prosurvival and pro-apoptotic mRNAs and proteins[J].PLoS Biol,2006,4(11):e374.
[7] Rutkowski DT,Wu J,Back SH,et al.UPR pathways combine to prevent hepatic steatosis caused by ERstress-mediated suppression of transcriptional master regulators[J].Dev Cell,2008,15(6):829-840.
[8] Hosoi T,Noguchi J,Takakuwa M,et al.Inhibition of inducible nitric oxide synthase and interleukin-l Bexpression by tunicamycin in cultured glial cells exposed to lipopolysaccharide[J].Brain Res,2014,1558:11-17.
[9] Lefterova MI,MullicanSE,Tomaru TA,et al.Endoplasmic reticulum stress regulates adipocyte resistin expression[J].Diabetes,2009,58(8):1879-1886.
[10]Yacoub Wasef SZ,Robinson KA,Berkaw MN,et al.Glucose,dexamethasone,and the unfolded protein response regulate TRB3 mRNA expression in 3T3-L1 adipocytes and L6 myotubes[J].Am J Physiol Endocrinol Metab,2006,291(6):E1274-1280.
[11]Wu H,Tang Q,Yang J,et al.Atorvastain ameliorates myocardial ischemia/reperfusion injury through attenuation of endoplasmic reticulum stress-induced apoptosis[J].Int J Clin Exp Med,2014,7(12):4915-4923.
[12]Ye Z,Wang N,Xia P,et al.Parecoxib suppresses CHOP and Foxol nuclear translocation,but increases GRP78 levels in a rat model of focal ischemia[J].Neurochem Res,2013,38(4):686-693.
[13]Bogoyevitch MA,Ngoei KR,Zhao TT,et al.c-Jun N-terminal kinase(JNK)signaling:recent advances and challenges[J].Biochim Biophys Acta,2010,1804(3):463-475.
[14]Ishii M,Suzuki Y,Takeshita K,et al.Inhibition of c-Jun NH2-terminal kinase activity improves ischemia/reperfusion injury in rat lungs[J].J Immunol,2004,172(4):2569-2577.
[15]邱晓晓,戴雍月,宋张娟,等.SP600125对大鼠肺缺血,再灌注损伤的保护作用及机制[J].中国应用生理学杂志,2012,28(3):255-258.
[16] Poone GK,Hasseldam H,Munkholm N,et al.The hypothermic influence on CHOP and Erol-αin an endoplasmic reticulum stress model of cerebral ischemia[J].Brain Sci,2015,5(2):178-187.
[17]Lakshmanan AP,Thandavarayan RA,Palaniyandi SS,et al.Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ERstress-induced renal apoptosis in streptozotocin-induced diabetic mice[J].Eur J Pharm Sci,2011,44(5):627-634.
[18]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Differ,2004,11(4):381-389.
[19]邹 麓,吴 楠,李晓岩,等.缺血后处理抑制内质网应激PE RK通路减轻大鼠离体心脏缺血/再灌注损伤[J].解剖科学进展,2017,23(4):370-373.
[20]梁向艳,铁 茹,苏菲菲,等.血管钠肽抑制内质网应激减轻糖尿病大鼠缺血/再灌注心肌损伤[J].心脏杂志,2016,28(6):651-655.

