5,6-二甲基苯并咪唑(DMB)对丙酸杆菌生长及合成脱氧腺苷钴胺素的影响
王鹏 李路伟 郭金凤 徐凯莉 董哲

摘 要:在丙酸杆菌(Propionibacterium freudenreichii)厌氧发酵生产脱氧腺苷钴胺素(deoxyadenosylcobalamin,简称ADO)的过程中,中间体腺苷钴啉醇酰胺(adenosylcobinamide,简称CBI)和5,6-二甲基苯并咪唑(DMB)结合后生成产物ADO。目前维生素B12脱氧腺苷钴胺素发酵过程中的实时在线检测方法相对匮乏,为了解决该问题,提高维生素B12的发酵单位,以CBI为目标,运用代谢调控方法改善DMB的加入时间,研究不同时间加入DMB对丙酸杆菌生长以及ADO合成的影响。在分批次发酵情况下,实时检测了菌体发酵过程中具体的CBI合成量、ADO产量,并进一步绘制了菌体的生长曲线。结果表明,DMB对丙酸杆菌生长的抑制作用并不明显,但是可以抑制单位菌体产量,发酵周期为120 h,最佳添加时间为90~100 h,相比60 h添加DMB可提高发酵单位59.08%。方法简便、快捷、高效,对维生素B12的发酵调控研究具有一定的参考价值。
关键词:发酵工程;脱氧腺苷钴胺素(ADO);丙酸杆菌;腺苷钴啉醇酰胺(CBI);5,6-二甲基苯并咪唑(DMB)
中图分类号:Q815 文献标志码:A
文章编号:1008-1542(2018)06-0546-06
维生素B12别称钴胺或氰基钴胺,是一类含钴的咕啉类有机化合物的总称,主要以5种天然形式存在:甲基钴胺(methylcobalamin)、脱氧腺苷钴胺(deoxyadenosylcobalamin)、羟基钴胺(hydroxycobalamin)、水合钴胺(aquacobalamin)和硝基钴胺(nitrylcobalamin)[1-2]。广泛应用于商品用途的维生素B12是由细菌菌体发酵合成的钴胺素转化而来的[3-4]。维生素B12与人们的生产、生活联系密切,例如在农业上主要用作饲料添加剂,在临床上用来治疗神经系统疾病和恶性贫血等。
目前,工业生产中的脱氧腺苷钴胺素(ADO)发酵采用好氧和厌氧工艺。第1种工艺是假单孢菌好氧发酵,发酵单位较高,但发酵过程需要曝气及高功率搅拌,能耗较高。第2种工艺则为丙酸杆菌厌氧发酵,虽然厌氧发酵工艺产率较低,但发酵过程中不需要曝气和高功率搅拌,能耗较低。工业上应用最普遍的维生素B12产生菌之一是丙酸杆菌(Propionibacterium freudenreichii)[5-7],在其生长发酵中不会产生内、外毒素[8],
发醇废液含有细菌类物质及丙、乙酸盐类,都具有生物抗菌作用,可作为天然、绿色、安全的食品和饲料防腐剂[9],符合美国食品和药物管理局GRAS标准。综合考虑2种发酵工艺的成本相差不大,故选择丙酸杆菌厌氧发酵工艺。丙酸杆菌厌氧发酵生产ADO分2个阶段:第1个阶段,以增加菌体数量为目的培养发酵菌体,同时积累中间产物腺苷钴啉醇酰胺(CBI);第2个阶段,向培养基中加入5,6-二甲基苯并咪唑(DMB),促使菌体合成维生素B12脱氧腺苷钴胺素[10-11]。相关研究讨论了DMB合成以及在生产中添加DMB的必要性[12-14]。
目前对于维生素B12的厌氧发酵过程,企业缺乏实时在线监控方法,大多采用镜检,人为影响因素较大,发酵不稳定。此外,关于在发酵生产维生素B12的过程中,添加DMB是否对丙酸杆菌生长有影响,以及在什么时间添加DMB可得到最优产量的研究并不多。笔者采用简便、快捷、高效的液相色谱实时在线监控方法,探讨了添加DMB对菌体生长及合成ADO的影响,并运用代谢调控的方法对发酵过程进行优化,提高了维生素B12的发酵单位。
1 材料与方法
1.1 菌种来源
菌种丙酸杆菌Propionibacterium freudenreichii,CICC:10019,由中国工业微生物菌种保藏中心提供。
1.2 培养基配方
种子培养基配方(质量分数,下同):葡萄糖3.5%(需要单独灭菌),玉米糖浆2.1%,碳酸钙0.4%,磷酸二氢钾0.4%,硫酸铵0.5%,氯化钴0.000 5%。用自来水配制,pH值为6.8~7.0,加碳酸钙。
发酵培养基配方:葡萄糖6%,玉米糖浆4%,磷酸二氢钾0.46%,氯化钴0.001 27%。用自来水配制,pH值为6.8~7.0,加碳酸钙。
1.3 主要设备和试剂
美國Waters公司 2695高效液相色谱仪,Beckman C18(4.6 μm×25 cm,5 μm)色谱柱,福特斯(FTS)冷冻干燥机,Sigma 3K30高速离心机,Sartorius arium 611UF纯水机,Beckman J6-MC大体积离心机,Sonics & Materials公司生产的Uibracell超声波细胞破碎仪。
标准品ADO来自于Sigma公司;乙腈,色谱纯;冰乙酸,色谱纯;氢氧化钠,分析纯。
1.4 丙酸杆菌的发酵
取穿刺培养的细菌,用生理盐水冲洗,接种到种子培养基,在30 ℃静置培养50 h。取10%的种子液接种到发酵培养基中,在30 ℃下发酵培养,用氨水调节pH 值为6.8~7.0。在细菌菌体发酵过程中于不同时间加入DMB,促使丙酸杆菌积累ADO。
1.5 丙酸杆菌的收集与处理
在离心转速4 000 r/min时收集丙酸杆菌发酵液,菌体冻干。取单位质量的干菌配制成2.5%的悬浮液,然后在沸水浴中加热30 min使细胞破壁ADO释放。在转速10 000 r/min离心收集上清液,取1 mL通过0.2 μm纤维素滤膜过滤,最后用高效液相色谱仪检测ADO产量[15]。整个操作过程在避光下进行,以防止光降解。
1.6 分析方法
1.6.1 生物量的测定
采用7200型分光光度计测量吸光度。取1 mL发酵液,参数波长为600 nm,光程1 cm比色皿比浊,以OD表示生物量。
1.6.2 CBI及ADO的检测方法
液相条件:流动相1为乙腈,流动相2为醋酸钠缓冲液(pH值为3.5),检测波长为254 nm,流速为1.0 mL/min,柱温为25 ℃,进样量为10 μL。
洗脱条件:15%乙腈恒速洗脱5~10 min,15%~30%乙腈梯度洗脱10~15 min。
质谱条件:喷雾电压为4.5 kV,自加热金属毛细管温度为300 ℃,电喷雾离子源壳气速为50 arb。全扫描检测模式,扫描范围为m/z 300~1 200,精确质量数与二级质谱(MS/MS)的扫描方式为数据依赖型。
全部数据是经3次试验所取的平均值。
2 结果与分析
2.1 发酵过程中CBI的合成研究
笔者在原有实验基础上,已经得到一个关键且稳定的中间体,并通过光谱和液-质联用分析推测此中间产物为腺苷咕啉醇酰胺(CBI),相对分子质量为1 239。CBI结构如图1所示。研究发现,丙酸杆菌在发酵过程中,CBI随菌体的生长而积累,到一定程度时加入5,6-二甲基苯并咪唑(DMB),可以快速转化为维生素B12即ADO,但是不加DMB,丙酸杆菌将不能生成ADO[16]。
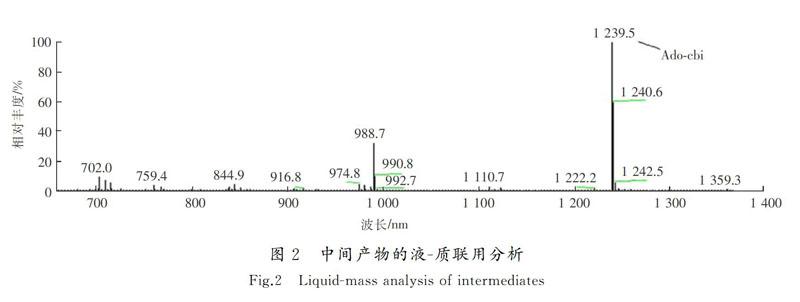
对中间产物采用液-质联用分析,结果如图2所示。
该中间体在被离子化后呈现出了+1价,相对分子质量为1 239.5,恰好同ADO-CBI厌氧生物合成途径中的脱氧腺苷钴啉醇酰胺(ADO)一致。ADO-CBI的分子结构中相对于ADO-CBI缺少了磷酸基团、核糖基团以及DMB基团(ADO-CBI分子质量比为1 580)。另外,图2中988.7 nm处对应的峰同ADO-CBI缺少了腺苷(ado-)基团的钴啉醇酰胺一致。由此可以得出结论:从实验中分离得到的关键中间产物应该是CBI。图2中,1 240.6 nm处对应的是CBI的加H峰。
2.2 DMB添加时间对ADO合成的影响
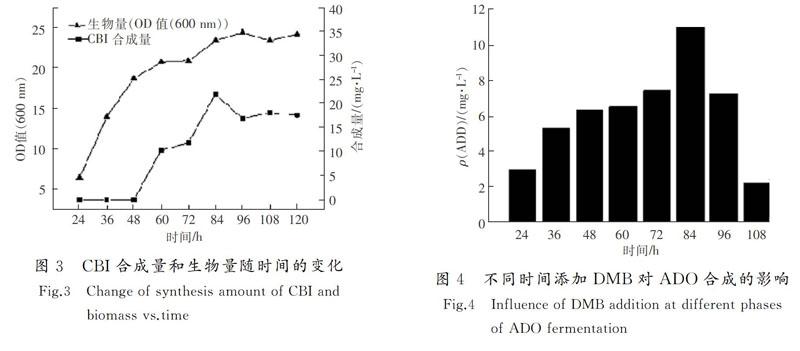
发酵过程中以不添加DMB为对照,分别在24,36,…120 h(间隔12 h)添加DMB,在120 h左右发酵结束后检测最终ADO合成量,对照定时取样测定CBI的合成量和OD值。结果如图3和图4所示。
由图3可以看出,在丙酸杆菌厌氧发酵生产ADO的过程中,OD值一直增大,在90~96 h之间生物量OD值最大,最后逐步平稳;CBI在60 h前后初次生成,90 h达到了最大值,随后略微减小。由图4可知,ADO合成量与CBI的生成有密切联系,在84 h CBI的合成量达到最大时添加DMB,合成终止后ADO可以达到最大产量;对比在60 h加入DMB,维生素B12即ADO产量可以提高59.08%,产量大幅提高,效果明显。
2.3 DMB对合成CBI的影响
2.3.1 DMB在CBI最大量左右时加入
在丙酸杆菌厌氧发酵生产ADO的过程中,以不加入DMB为对照,在96 h时加入DMB,全过程按小时定时取样测定生物量OD值、CBI以及ADO合成量。结果如图5所示。
由图5可知,随着发酵的进行OD值不断升高,在96 h时到达最高值,后续逐步稳定。对照中間产物CBI在60 h前后开始生成,96 h达到最大值,然后有小幅度降低,但仍保持在较高的水平。在96 h加入DMB后CBI不断减少,同时开始生成钴胺素ADO。随着反应的进行ADO合成量越来越多,123 h 时CBI彻底消失,ADO达到最大量,在124 h中间产物全部转化成产物脱氧腺苷钴胺素。
2.3.2 DMB不在CBI最大量时加入
在丙酸杆菌厌氧发酵生产ADO的过程中,以不加入DMB为对照,于74 h时加入DMB,全过程定时取样测定生物量OD值、CBI以及ADO合成量。结果如图6和图7所示。
由图6可知,未加DMB和加DMB两者的OD值都持续增大,在90 h时到达最大值后逐步稳定,加不加DMB对OD值的变化没有直接的影响。由此可知,DMB对丙酸杆菌的毒害效应不是很明显。加与不加DMB的发酵液两者的OD值不同,但无明显规律。对照CBI不断生成,在96 h到达最大量后逐步稳定。由图7可知,添加DMB后,CBI量快速减少,此时产物ADO开始生成并且产量逐步增大。在102 h 时CBI彻底消失,ADO产量在108 h达到最大值。由此可知,由CBI全部转化为ADO大约需要34 h。
2.4 DMB对细菌菌体生长的影响
在丙酸杆菌厌氧发酵生产维生素B12的过程中,DMB分别于发酵早期0 h,24 h和对数生长期48 h加入,以不加入DMB为对照,全过程定时取样测定生物量OD值(间隔12 h)、CBI以及ADO合成量,检验分析DMB对丙酸杆菌菌体的生长是否有毒害作用。结果如表1和图8所示。
由表1和图8可以看出,DMB对细菌生长有略微的毒害作用,但是作用并不明显。在菌体厌氧发酵完全结束停止后测定脱氧腺苷钴胺素ADO的产量,综合分析可知DMB加入的时间越早,ADO的产量越低。
优化发酵过程也可从代谢工程的角度出发,利用基因工程操纵代谢途径[17],在丙酸杆菌厌氧发酵脱氧腺苷钴胺素的过程中,强化目标产物途径,控制或消除副产品途径[18-19],特别是对ADO发酵过程中的丙酸杆菌、副产物丙酸抑制菌体的生长[20],从而进一步影响ADO的发酵单位。因此,新型发酵工艺是另一种可以显著提高ADO产量和效价的途径,比如采用产物原位分离技术[21-22]。
3 結 语
1)目前,在维生素B12的发酵生产中,添加DMB的时间只是根据生产经验进行判断,并没有较为科学的理论可遵循。笔者认为,可采用生物发酵代谢工程手段来确定适宜诱导物DMB的加入时间,从而得到更高的发酵单位。例如:随着丙酸杆菌菌体的生长发酵,CBI在菌体内持续生成并不断累计,该合成直接关系到ADO的最终产值;在丙酸杆菌厌氧发酵生产维生素B12的过程中,全程定时取样跟踪检测CBI产量,当其生成量到达最大值时加入DMB,CBI将快速转化生成产物ADO,有效提高了发酵单位。在发酵90~96 h添加DMB,维生素B12的产量可以提高到59.08%。
2)在丙酸杆菌厌氧发酵合成ADO的过程中,DMB对丙酸杆菌菌体的毒害作用不是很明显,生物量也没有明显减少;但是过早加入诱导物DMB则情况相反,其会抑制合成中间体CBI,减少菌体量,降低维生素B12脱氧腺苷钴胺素最后的产量。
3)本研究为维生素B12发酵过程检验检测技术的开发提供了理论依据。在丙酸杆菌厌氧合成ADO的次级代谢途径中,DMB为何对CBI的合成有抑制作用有待今后作进一步的研究。
参考文献/References:
[1] KASPER P J, MIKKELSEN K V. Semi-empirical studies of cobalamins, corrin models, and cobaloximes:The nucleotide loop doesnot strain the corrin ring in cobalamins[J]. Inorganica Chimica Acta, 2001, 323: 5-15.
[2] HODGKIN D C, KAMPER J, MACKAY M, et al. Structure of vitamin B12[J]. Nature, 1956, 178: 64-70.
[3] 罗祎,郝常明.维生素B12的研究及其进展[J].中国食品添加剂,2002(3):15-18.
LUO Yi, HAO Changming. Research and progress of vitamin B12[J]. China Food Additives,2002(3):15-18.
[4] CLAAS K R, PARRISH J R., MAGGIO-HAL L, et al. Functional analysis of the nicotinate mononucleotide: 5, 6- dimethylbenzimidazole phosphoribosyltransferase (CobT) enzyme, involved in the late steps of coenzyme B12 biosynthesis in Salmonella enterica[J]. Journal of Bacteriology, 2010, 192:145-154.
[5] LI K T, LIU D H, LI Y L, et al. Improved large-scale production of vitamin B12 by pseudomonas denitrificans with betaine feeding[J]. Bioresource Technology, 2008, 99:8516-8520.
[6] 马蕙, 王丽丽, 仪宏,等.维生素 B12 的生物合成、发酵生产与应用[J].生物工程学报,2008,24(6): 927-932.
MA Hui, WANG Lili, YI Hong, et al. Biosynthesis, fermentation production and application of vitamin B12[J].Journal of Bioengineering, 2008,24(6): 927-932.
[7] 曾碧榕,何旭敏,夏海平,等.维生素B12工业生产技术的进展[J].中国医药工业杂志,2003,34(8):421-424.
ZENG Birong, HE Xumin, XIA Haiping, et al. Progress of vitamin B12 industrial production technology[J]. Chinese Journal of Pharmaceuticals, 2003, 34(8): 421-424.
[8] SALMINEN S, WRIGHT A, MORELLI L, et al. Demonstration of safety of probiotics[J]. Int J Food Microbiol, 1998,44: 93-106.
[9] 卢楠,朱文华.谢氏丙酸杆菌发酵废液中生物抑菌物质的研究[J].河北工业科技,2012,29(3):138-140.
LU Nan,ZHU Wenhua.Study on biological antibacterial material in fermentation liquor of propionibacterium Shermanii[J].Hebei Journal of Industrial Science and Technology,2012,29(3):138-140.
[10]MIYANO K I, YE K, SHIMIZU K. Improvement of vitamin B12 fermentation by reducing the inhibitory metobolities by cell recycle system and a mixed culture[J]. Biochemical Engineering Journal, 2000(6): 204-207.
[11]YE K M, MIYAKO S, SHA J, et al. Efficient production of vitamin B12 from propionic acid bacteria under periodic variation of dissolved oxygen concentration[J]. Journal of Fermentations and Bioengineering,1996,82:484-491.
[12]WOODSON J D, ESCALANTESEMERENA J C. The cbis gene of the archaeon methanopyrus kandleri AV19 encodes a bifunctional enzyme with adenosylcobinamide amidohydrolase and α-Ribazole-Phosphate phosphatase activities[J]. Journal of Bacteriology, 2006, 188, 4227-4235.
[13]CHANDRA T, BROWN K L. Vitamin B12 and alpha-ribonucleosides[J]. Tetrahedron, 2008, 64:29-38.
[14]LI K T, LIU D H, LI Y L, et al. Improved large-scale production of vitamin B12 by pseudomonas denitrificans with betaine feeding[J]. Bioresource Technology, 2008, 99:8516-8520.
[15]張玉明,王雷,王云山,等.一种简便、快速测定发酵液中维生素B12含量的方法[J].食品与发酵工业,2005,31(1):124-127.
ZHANG Yuming, WANG Lei, WANG Yunshan, et al. A simple, rapid method to determine the content of vitamin B12 in fermentation broth [J]. Food and Fcrmentation Industries, 2005, 31(1):124-127.
[16]王鹏,王云山,张利平,等. 脱氧腺苷钴胺素生物合成途径中一种中间产物的研究[J].中国生物工程杂志,2007,27(11):37-40.
WANG Peng, WANG Yunshan, ZHANG Liping, et al. Study on an intermediate product of deoxyadenosine cobalamin biosynthesis pathway[J]. China Biotechnology, 2007, 27(11):37-40.
[17]PIAO Y, YAMASHITA M, KAWARAICHI N, et al. Production of vitamin B12 in genetically engineered Propionibacterium freudenreichii[J]. Journal of Bioscience and Bioengineering, 2004, 98: 167-173.
[18]LEE S L, LEE D Y, KIM T Y, et al. Metabolic engineering of Escherichia coli for enhanced production of succinic acid, based on genome comparison and in silico gene knockout simulation[J]. Applied and Environmental Microbiology, 2005, 71:7880-7887.
[19]SANCHEZ A M, BENNETT G N, SAN K Y. Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity[J]. Metabolic Engineering, 2005, 7:229-239.
[20]SUWANNAKHAM S, YANG S T. Enhanced propionic acid fermentation by propionibacterium acidipropionici mutant obtained by adaptation in a fibrous-bed bioreactor[J]. Biotechnology and Bioengineering, 2005, 91:325-337.
[21]CHEN C C, JU L K. Coupled lactic acid fermentation and adsorption[J]. Applied Microbiology and Biotechnology, 2002, 59:170-174.
[22]SCOTT A I, ROESSNER C A. Biosynthesis of cobalamin (vitamin B12)[J]. Biochemical Society Transactions, 2002, 30:613-620.

