气相色谱-质谱联用法测定植物组织中糖与糖醇
项 萍,唐 喆
(西北农林科技大学植物保护学院,陕西 杨凌 712100)
糖醇类物质广泛存在于自然界各种生物中,植物体内的糖醇具有提供能量、清除自由基以及调节植物细胞渗透压等生理功能[1]。糖醇类物质是植物体内重要的初生代谢物,其含量的变化可直接反映植物组织的生理状况。枸杞作为西北半干旱地区常见的植物,不仅是常用的传统中药材,还是百姓喜爱的保健品。据研究报道,枸杞的果、叶、苗、根都含有多种营养和活性组分,其中以葡萄糖、阿拉伯糖为活性基础形成的水溶性多糖(LPB)[2]为主。
糖与糖醇类物质的检测方法一般有容量法、分光光度法、酶分析法、色谱分析法等[3-4],但由于植物组织中糖醇类物质的浓度相对较低,使用上述方法很难得到准确的含量,因此有必要建立一种快速且灵敏的糖醇类物质分析方法。气相色谱法的灵敏度高、分离能力强,能够有效地分离天然化合物中的同分异构体,并能够对痕量物质进行检测;质谱法能够准确地确定化合物的分子质量,并且推算化合物的分子式,对于鉴定有机物分子具有重要作用。目前,气相色谱-质谱(GC/MS)联用技术已广泛应用于各种检测中[5-6],然而,糖醇类物质高温易分解或难以气化,在进行GC/MS分析前要对化合物进行衍生化处理。
本研究拟以7种常见的糖醇类物质作为目标化合物,经乙酰化处理后,以核糖醇作为内标物,采用GC/MS法测定枸杞叶片和根系中的含糖情况,希望为各种植物组织中糖和糖醇类物质的检测提供方法参考。
1 实验部分
1.1 仪器与试剂
GC/MS-QP2010气相色谱-质谱仪:日本岛津公司产品,配有Aoc-20i自动进样器、Rxi-5MS色谱柱(30 m×0.25 mm×0.25 μm);MD200氮吹仪:杭州奥盛仪器有限公司产品;PL303电子天平:梅特勒-托利多上海有限公司产品;THZ-C-1全温振荡器:苏州培英实验设备有限公司产品。
果糖(Flu)、核糖醇(Ado)、葡萄糖(Glu)、半乳糖(Gal)、纤维醇(Ino)、甘露醇(Man)、山梨醇(Sor)、蔗糖(Suc)标准品:均为分析纯,美国Sigma公司产品;甲醇、氯仿、1-甲基咪唑、盐酸羟胺、乙酸酐、无水硫酸钠:均为分析纯,天津富宇精细化工有限公司产品。
1.2 乙酰化标准品的配制
精确称取各0.005、0.02、0.05、0.1、0.2 mg果糖、葡萄糖、半乳糖、纤维醇、甘露醇、山梨醇、蔗糖标准品,分别加入0.02 mg核糖醇,混匀,再加入少许的1-甲基咪唑悬浮;然后加入0.1 mL盐酸羟胺溶液,混匀后置于80 ℃水浴中振荡5 min,取出后加入0.15 mL乙酸酐,混匀,于室温下反应5 min;再加入1 mL氯仿萃取衍生化产物,然后用2倍体积水清洗4遍,有机相用无水硫酸钠干燥后,封装于色谱瓶中,即得质量浓度分别为5、20、50、100、200 mg/L的混合标准工作液,其中内标物核糖醇的浓度为20 mg/L。
1.3 样品提取以及乙酰化处理
对枸杞叶片与根系的单双糖及其可溶性糖醇类化合物进行GC/MS测定,具体步骤[1]为:取0.2 g枸杞鲜样,加入0.02 mg核糖醇作为内标,液氮环境中研磨成细碎粉末,加入4 mL甲醇-氯仿-水(12∶5∶3,V/V/V)碳水化合物抽提液,充分混匀,随后加入等体积水,混匀,静置片刻,将上清液过滤至试管中,氮气吹干,待其冷却后加入少许的1-甲基咪唑悬浮;然后加入0.1 mL盐酸羟胺溶液,混匀后置于80 ℃水浴中振荡5 min,取出后加入0.15 mL乙酸酐,混匀后于室温下反应5 min,加入1 mL氯仿萃取衍生化产物,用2倍体积水清洗4遍,有机相用无水硫酸钠干燥后,直接封装于色谱瓶中,待测。
1.4 实验条件
1.4.1色谱条件 载气He,流速0.8 mL/min;清洗流速3 mL/min,线速度32.4 cm/s;升温程序:柱温50 ℃,保持5 min,以15 ℃/min升至200 ℃,以10 ℃/min升至280 ℃,保持20 min;进样口温度250 ℃;进样量1 μL。
1.4.2质谱条件 轰击电压70 eV,界面温度280 ℃,离子源温度230 ℃,检测器电压0.9 kV,溶剂切割时间3 min,质量扫描范围m/z35~900。
2 结果与分析
2.1 8种乙酰糖的Scan模式定性分析
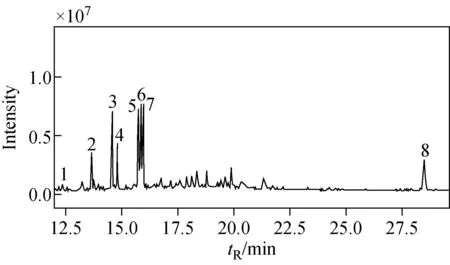
注:1.果糖;2.核糖醇(内标物);3.葡萄糖;4.半乳糖;5.纤维醇;6.甘露醇;7.山梨醇;8.蔗糖图1 8种乙酰化的糖和糖醇的总离子流图Fig.1 Total ion chromatogram of 8 acetylated sugars and sugar alcohols
将乙酰化后的标准品通过单标进样确定每种物质的保留时间,进混标样后优化升温程序、调整测试参数,从而达到较好的分离效果,得到的总离子流图示于图1。
2.2 SIM模式定量分析
SIM模式较Scan模式的灵敏度有很大提高[7]。本研究根据8种乙酰化标准品Scan模式的质谱图,选定特征离子创建了SIM方法,并对混合标样进行分析,得到的离子流图示于图2,乙酰化的糖和糖醇的SIM模式参考离子列于表1。由于糖和糖醇类物质含有较多的羟基,乙酰化处理后形成的酰氧键极易断裂形成m/z43碎片离子,且丰度较高,结合其他特征碎片和保留时间,可以高选择、高灵敏地检测糖和糖醇类物质的含量。

图2 8种乙酰化的糖和糖醇的SIM模式总离子流图Fig.2 Total ion chromatogram of 8 acetylated sugars and sugar alcohols at SIM mode
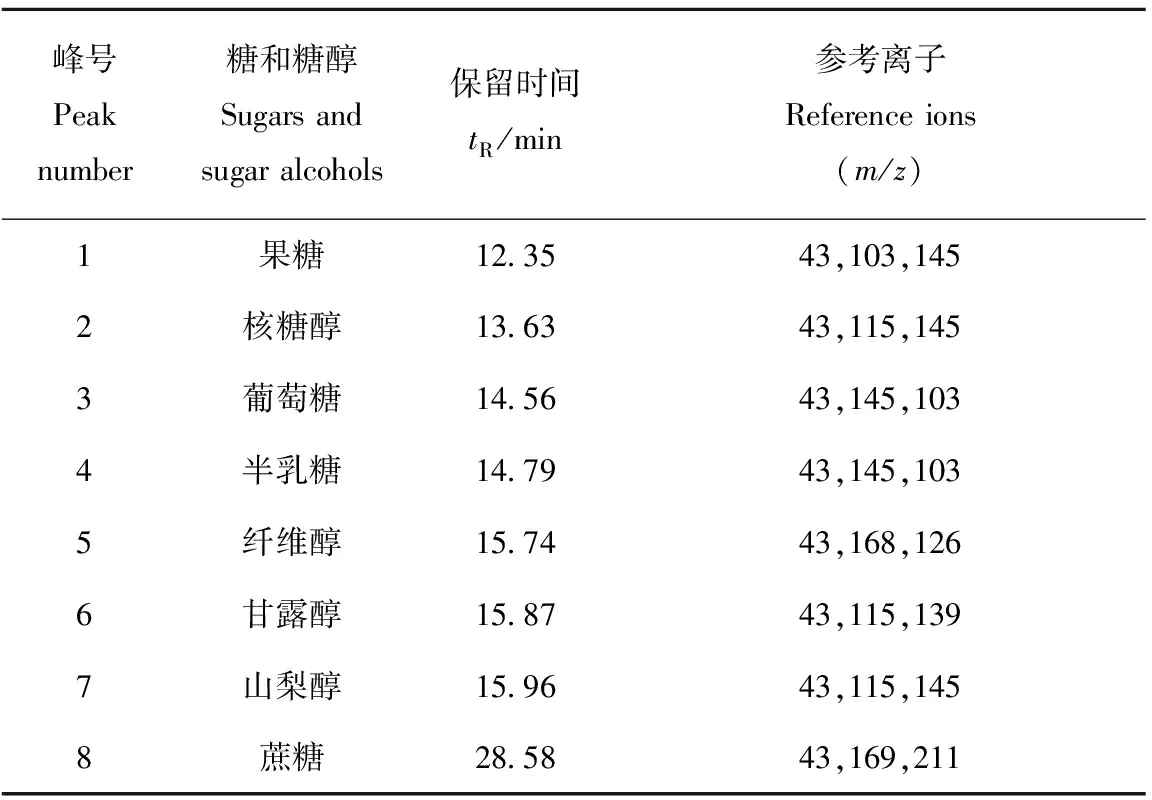
峰号Peaknumber糖和糖醇Sugarsandsugaralcohols保留时间tR/min参考离子Referenceions(m/z)1果糖12 3543,103,1452核糖醇13 6343,115,1453葡萄糖14 5643,145,1034半乳糖14 7943,145,1035纤维醇15 7443,168,1266甘露醇15 8743,115,1397山梨醇15 9643,115,1458蔗糖28 5843,169,211
2.3 SIM方法的检出限、回收率和精密度
分别取1.2节配制的标准混合工作液,采用1.3节方法对标准溶液乙酰化处理后,按1.4节条件上机测定。为了避免前处理过程导致的误差,选取植物组织中含量极少的核糖醇作为内标物,以其他标准品与核糖醇峰面积比y对7种标准物质量浓度与核糖醇比x做线性回归,以信噪比3计算检出限,信噪比10计算定量限,其结果列于表2。可见,除果糖的检出限为5.5 mg/L外,其他糖和糖醇的检出限均低于0.11 mg/L。
选取一组枸杞根样品,在前处理前添加一定量的可溶性糖进行分析检测,重复测定5次,考察该方法在实际样品中的回收率与精密度,结果列于表3。结果表明,回收率在96.98%~103.62%之间,相对标准偏差(RSD)为2.3%~4.9%,该方法精密度良好,能够满足定量分析的要求。
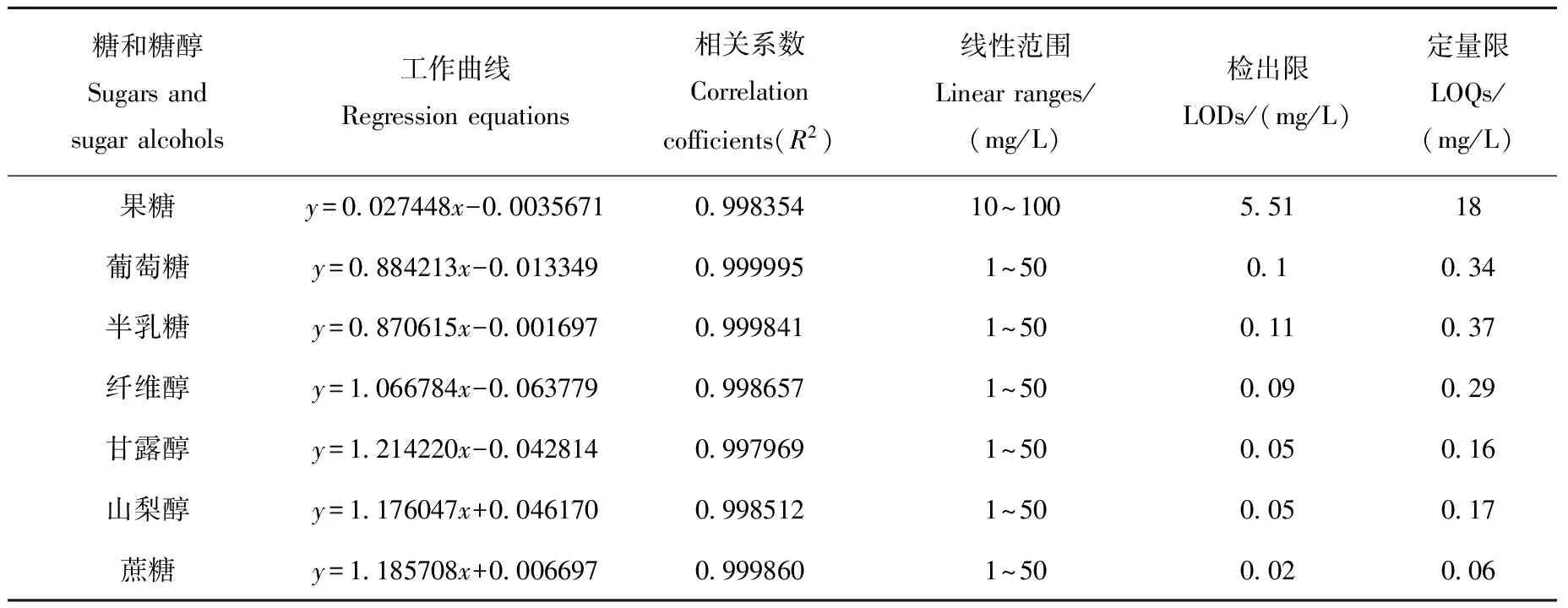
表2 乙酰化的糖和糖醇的工作曲线、相关系数、检出限和定量限Table 2 Regression equations, correlation coefficients,limits of detection and limits of quantification of 8 acetylated sugars and sugar alcohols
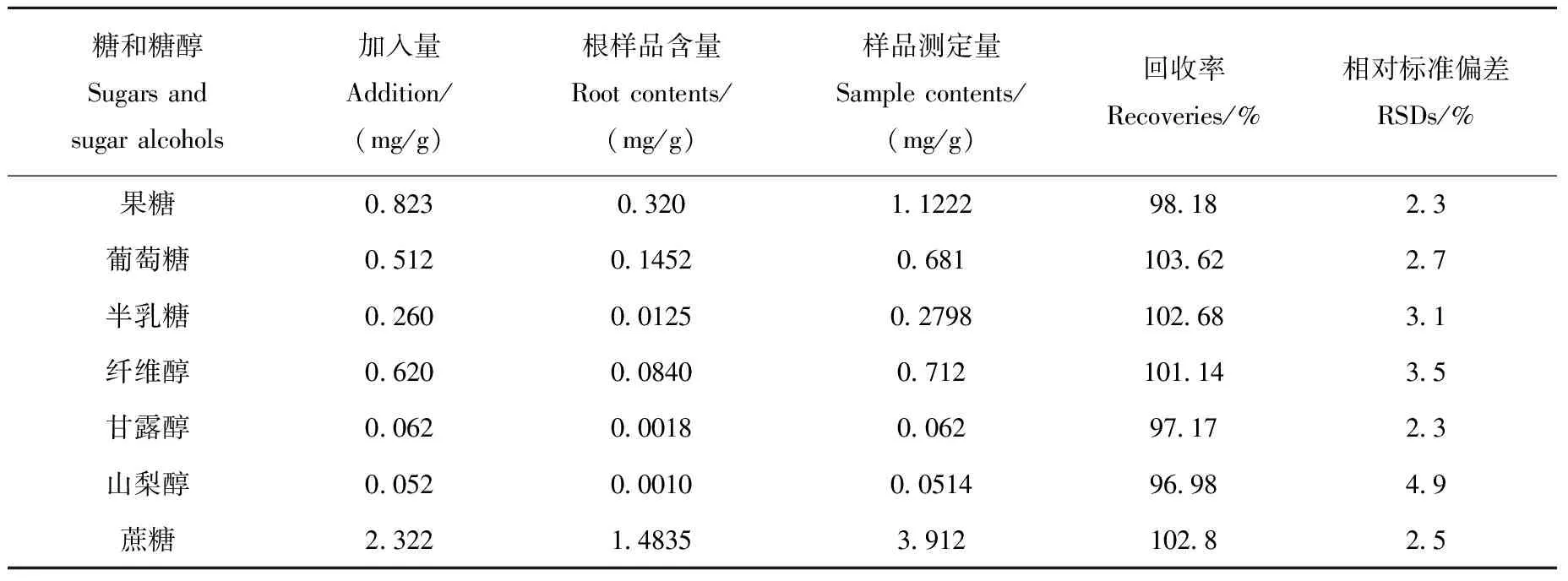
表3 SIM模式下方法的回收率和精密度Table 3 Recoveries and precisions at SIM mode
2.4 方法的应用
选取枸杞叶片与根系作为样本进行糖和糖醇的测定,结果列于表4。可见,枸杞根中的果糖、葡萄糖和蔗糖含量约是叶片中的2倍,这是因为根主要参与植物无机离子和水的吸收,需要大量的能量,这些糖类可为根提供更多的能量。半乳糖和纤维醇是植物细胞重要合成物的前体,其中,半乳糖是植物果胶类成分的重要组成,纤维醇可用于植物细胞壁的合成[8-9],二者对枸杞的根和叶细胞具有同等重要的作用,二者的含量差异不大。山梨醇和甘露醇是单糖的重要衍生物,主要用于调节细胞渗透压,提高植物抗逆性[10-11],由于根处于复杂环境中,需要对渗透压有良好的调节能力,所以山梨醇和甘露醇的含量较高。
实际的枸杞样品测定结果和理论分析表明,本实验采用的GC/MS选择离子监测(SIM)模式可以准确地测定植物组织中的糖醇含量。虽然样品的乙酰化处理增加了前处理步骤,但是操作简单,试剂为常规试剂,成本较低。同时,采用核糖醇作为内标物,有效地减小了误差。该方法可以去除背景干扰,得到清晰准确的色谱峰,比GC/MS法全扫描模式的灵敏度高,适合测定糖含量较低的植物组织。
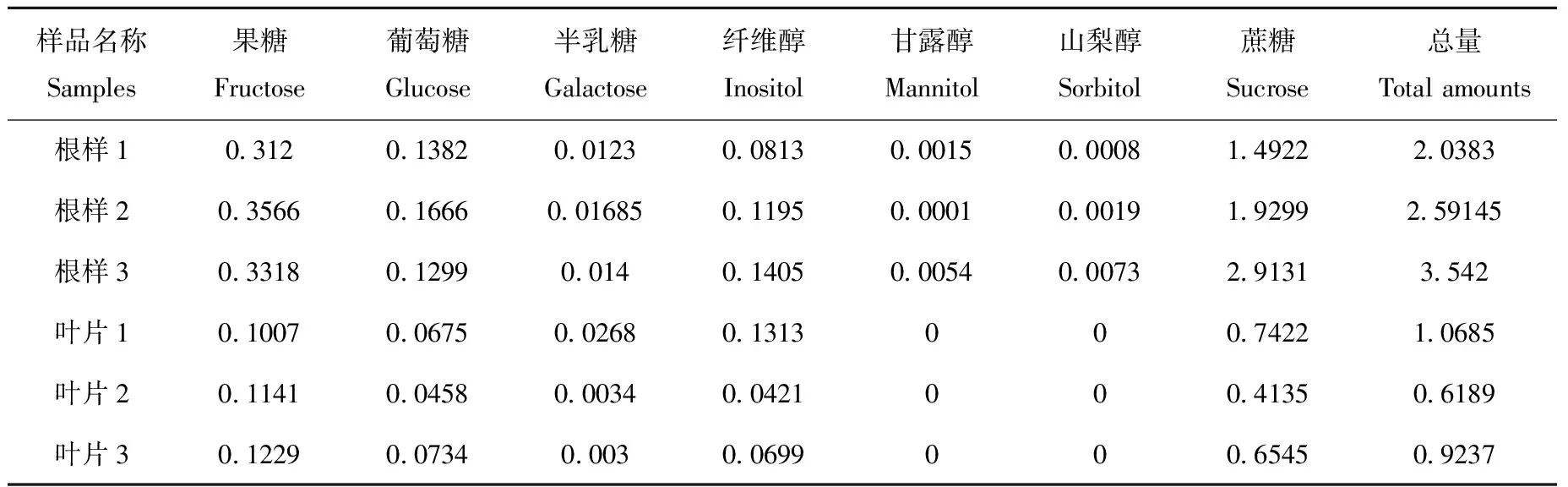
表4 枸杞叶片与根系中的糖和糖醇含量(mg/g)Table 4 Contents of sugars and sugar alcohols in leaves and roots of Lycium chinensis (mg/g)
3 结论
本研究采用GC/MS法SIM模式快速分析测定乙酰糖和乙酰糖醇,以枸杞的根和叶片为例进行了准确的定量分析。为了避免乙酰化过程影响测定结果,选择核糖醇作为内标物进行定量分析,同时SIM模式降低了基质干扰、提高了灵敏度。该方法可为糖和糖醇类物质的检测提供参考依据。
参考文献:
[1] 胡磊,郭蓓,陆海,等. 植物组织中糖与糖醇乙酰化及毛细管气相色谱分析[J]. 植物学报,2004,21(6):689-699.
HU Lei, GUO Bei, LU Hai, et al. Gas chromatographic analysis of sugar and sugar alcohol derivatives through 1-methylimidazole catalyzed acetylation[J]. Chinese Bulletin of Botany, 2004, 21(6): 689-699(in Chinese).
[2] 如克亚·加帕尔,孙玉敬,钟烈州,等. 枸杞植物化学成分及其生物活性的研究进展[J]. 中国食品学报, 2013,13(8):161-172.
RUKEYA Jiapaer, SUN Yujing, ZHONG Lie-zhou, et al. A review of phytochemical composition and bio-active ofLyciumbarbarumFruit (Goji)[J]. Journal of Chinese Institute of Food Science & Technology, 2013, 13(8): 161-172(in Chinese).
[3] 杨柳,王建立,王淑英,等. 糖类物质测定方法评价[J]. 北京农学院学报,2009,24(4):68-71.
YANG Liu, WANG Jianli, WANG Shuying, et al. A review on determination methods of sugar content[J]. Journal of Beijing University of Agriculture, 2009, 24(4): 68-71(in Chinese).
[4] 谭芳,刘甜. 烟草中糖类物质测定方法评价[J]. 延边大学学报:自然科学版,2013,39(1):37-40.
TAN Fang, LIU Tian. Appraisal on determination of sugars in tobacco[J]. Journal of Yanbian University: Natural Sciene, 2013, 39(1): 37-40(in Chinese).
[5] KATONA Z F, SASS P, MOLNR-PERL I. Simultaneous determination of sugars, sugar alcohols, acids and amino acids in apricots by gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 1999, 847(1/2): 91-102.
[6] FAN H, FAN W, XU Y. Characterization of key odorants in Chinese chixiang aroma-type liquor by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission studies[J]. Journal of Agricultural & Food Chemistry, 2015, 63(14): 3 660.
[7] ZHONG W J, WANG D H, XU X W, et al. A gas chromatography/mass spectrometry method for the simultaneous analysis of 50 phenols in wastewater using deconvolution technology[J]. Chinese Science Bulletin, 2011, 56(3): 275-284.
[8] 郁有健,沈秀萍,曹家树. 植物细胞壁同聚半乳糖醛酸的代谢与功能[J]. 中国细胞生物学学报,2014,36(1):93-98.
YU Youjian, SHEN Xiuping, CAO Jiashu. The metabolism and function of homogalacturonan in plant cell wall[J]. Chinese Journal of Cell Biology, 2014, 36(1): 93-98(in Chinese).
[9] 张梦,谢益民,杨海涛,等. 肌醇在植物体内的代谢概述——肌醇作为细胞壁木聚糖和果胶前驱物的代谢途径[J]. 林产化学与工业,2013,33(5):106-114.
ZHANG Meng, XIE Yimin, YANG Haitao, et al. Myo-inositol metamolism as the precursor of xylan and pectin in plants[J]. Chemistry and Industry of Forest Products, 2013, 33(5): 106-114(in Chinese).
[10] 孟艳玲,刘林,白涛,等. 干旱胁迫下外源山梨醇对平邑甜茶耐旱性影响[J]. 北方园艺,2009,(5):69-70.
MENG Yanling, LIU Lin, BAI Tao, et al. The effect of exogenous sorbitol on drought tolerance of malus hupehensis under drought stress[J]. Northern Horticulture, 2009, (5): 69-70(in Chinese).
[11] TARI I, KISS G, DEÉR A K, et al. Salicylic acid increased aldose reductase activity and sorbitol accumulation in tomato plants under salt stress[J]. Biologia Plantarum, 2010, 54(4): 677-683.

