p-JAK2蛋白在食管鳞状细胞癌中的表达及意义
谭豆豆, 马 蓉, 刘 涛, 刘 清, 郑树涛, 周 剑, 陈玉梅, 申铜雪, 张 潇, 卢晓梅
(新疆医科大学1附属肿瘤医院; 2临床医学研究院, 乌鲁木齐 830011)
食管癌是消化道最常见的恶性肿瘤之一,我国食管癌在全部恶性肿瘤中发病率排第3位,死亡率排第4位[1]。食管癌最常见的组织分型是鳞状细胞癌[2],其恶性程度高且预后差,5 a生存率不足20%[3]。由于大部分病例都在中晚期被发现而又没有理想的治疗策略[4],因此探讨ESCC的发病机制,探索新的治疗靶点就显得尤为重要。
酪氨酸激酶2(Janus kinase 2, JAK2)是Janus家族的非受体蛋白家族的成员,通过多种细胞因子受体调节JAK2/STAT3信号通路[5],而磷酸化的JAK2(phosphorylated JAK2,p-JAK2)是其活化形式并在大多数的肿瘤进展中都起着重要的作用[5-7]。本研究应用免疫组织化学SP法检测食管鳞状细胞癌组织芯片中p-JAK2的表达,并结合临床病理特征,探讨食管鳞状细胞癌组织中p-JAK2的表达与患者预后及临床病理参数的相关性。
1 材料与方法
1.1临床组织样本食管癌组织芯片 (购自上海芯超生物科技有限公司),其中食管鳞状细胞癌组织标本93例,癌旁正常组织85例,其中有8例食管癌组织无癌旁阴性对照组织。93例食管癌组织中,男性77例,女性16例,年龄49~85岁,平均年龄65.75岁。食管癌组织浸润肌层22例,浸润外膜层64例。根据美国癌症联合会(AJCC)2009年第7版TNM分期标准,1期11例,2期37例,3期40例,5例TNM分期缺失。发现有淋巴结转移49例,未发现淋巴结转移44例。
1.2主要试剂p-JAK2兔抗人单克隆抗体(美国Abcam公司),SP试剂盒、DAB显色剂购自北京中杉金桥生物制品有限公司。
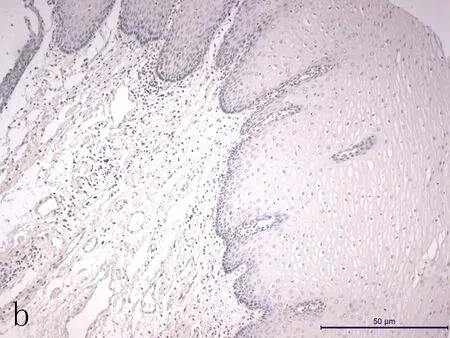
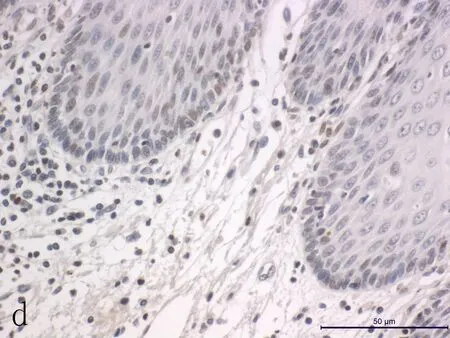
1.3免疫组化染色方法及结果判定食管癌组织芯片常规脱蜡,3%H2O2抑制内源性过氧化物酶,采用0.01 mol/L柠檬酸钠缓冲液微波加热修复抗原。免疫组化二步法操作步骤参照试剂盒说明书进行。p-JAK2工作液浓度为1:200。根据半定量积分法[8]及双盲法判读p-JAK2表达,每个组织随机选取10个高倍视野观察,按照染色强度分为:(-)、(+)、(++)、(+++),分别计为0、1、2、3分;按照阳性细胞占肿瘤细胞总数的百分比分为:<5%计0分,5%~25%计1分,26%~50%计2分,51%~75%计3分,≥75%计4分。将两项结果相加,0~1分判为阴性,≥2分判为阳性。
1.4统计学处理所得结果数据采用SPSS16.0进行统计分析,食管鳞癌组织和癌旁阴性组织p-JAK2表达及p-JAK2表达与临床病理参数的相关性分析比较采用χ2检验,单因素生存率分析则采用Kaplan-Meier检验,以P<0.05为差异有统计学意义。
2 结果
2.1p-JAK2表达及其与临床病理参数的相关性根据免疫组织化学SP法结果,p-JAK2阳性表达主要定位于细胞核,呈黄色或棕黄色(图1)。食管鳞癌组织p-JAK2的阳性表达率(76.3%)明显高于癌旁正常组织(54.1%),差异有统计学意义(P<0.05)(表1)。另外,p-JAK2表达与患者病理分级(P=0.044)呈显著相关,并且p-JAK2阳性率随着病理分级的升高出现下降趋势。在食管组织中p-JAK2的表达与患者的性别(P=0.644)、年龄(P=0.835)、肿瘤大小(P=0.404)、病理形态(P=0.357)、浸润深度(P=0.430)、临床分期(P=0.428)及淋巴结转移(P=0.389)的相关性差异无统计学意义(P>0.05) (表1)。

表1 p-JAK2表达与ESCC患者临床病理参数的相关性分析/例
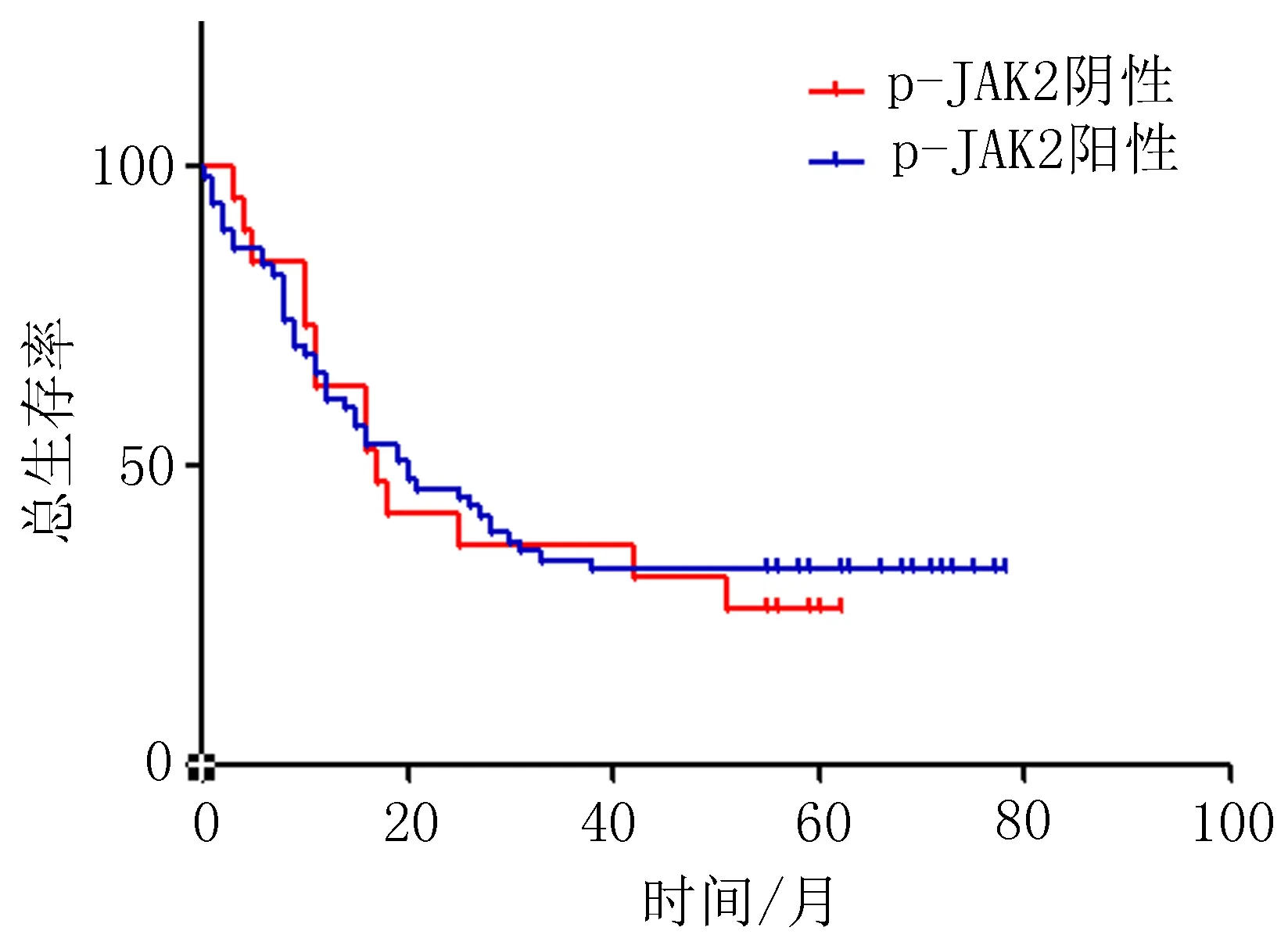
2.2生存分析93例食管癌患者手术时间:2009年1月~2010年12月,随访时间:2015年7月,随访4.6~6.5年,半数生存期32个月。从2009年~2015年,93例ESCC患者存活26例,死亡60例,失访7例,5 a生存率约为36%。生存分析显示,食管癌组织中p-JAK2阳性率与患者生存期无明显相关性(P=0.178)(图2)。


3 讨论
食管癌是消化道高侵袭恶性肿瘤之一,最常见的组织分型是鳞状细胞癌[2]。虽然食管癌的诊断和治疗有了很大进展,但患者总体预后不佳,5 a生存率低[3]。食管癌易发生转移,是死亡率高的重要原因[9]。研究发现,JAK2不仅作为原激酶介导STAT3的磷酸化,而且在大多数肿瘤活化中都起着至关重要的作用[6]。最新研究已表明JAK2/STAT3信号通路与人类肿瘤干细胞的维持有密切关系,并已报道JAK2/STAT3信号通路参与诱导肝脏肿瘤干细胞的多潜能因子Nanog和化学抗性表型[10],在胶质母细胞瘤中JAK/STAT3通路的激活可以维持肿瘤干细胞的表型和致瘤性[5]。相反,在乳腺癌中阻断JAK2激活将引起CD44+/CD24-肿瘤干细胞的减少和体内致瘤性的丧失[7]。同时还发现,在多种恶性肿瘤中中断JAK2/STAT3信号通路的激活将会抑制肿瘤的致瘤性及进展。
本研究采用免疫组化SP法检测食管鳞癌及癌旁正常组织中p-JAK2蛋白表达,结果发现,食管鳞癌组织中p-JAK2阳性表达率明显高于癌旁阴性组织(P<0.05),提示在食管鳞状细胞癌中p-JAK2表达上调可能参与食管癌的发生及进展。同时发现,p-JAK2表达与食管癌分化程度(P=0.044)呈显著相关,并且p-JAK2阳性率随着分化程度的降低出现下降趋势,即p-JAK2阳性率随着肿瘤恶性程度的升高而降低,进一步提示在食管癌发生早期,JAK2磷酸化水平较高,以此来激活JAK2/STAT3信号通路参与食管癌的进展。此结果与已有文献报道一致[11-13]。本研究还发现p-JAK2表达以定位于细胞核为主,也有少量在胞浆表达,提示可能存在p-JAK2活化形式入核参与核内基因或蛋白表达调控。食管鳞状细胞癌组织中p-JAK2异常表达提示JAK2/STAT3信号通路可能发生改变,其可能与食管鳞癌的发病机制有关。
综上所述,p-JAK2在食管癌组织中高表达,并与肿瘤分化程度相关,p-JAK2在肿瘤的发生发展过程中扮演着重要角色。但本研究只限于免疫组化水平的检测,p-JAK2与食管癌浸润转移的分子机制和细胞水平研究还有待于进一步证实。
参考文献:
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J].CA Cancer J Clin,2016, 66(2):115-132.
[2] GUPTA B, KUMAR N. Worldwide incidence,mortality and time trends for cancer of the oesophagus[J]. Eur J Cancer Prev,2017, 26(2):107-118.
[3] ZHANG L, MA J, HAN Y ,et al. Targeted therapy in esophageal cancer[J]. Expert Rev Gastroenterol Hepatol, 2016, 10(5):595-604.
[4] AJANI J A, D′AMICO T A, ALMHANNA K, et al. Esophageal and esophagogastric junction cancers, version 1.2015 [J]. J Natl Compr Canc Netw,2015, 13(2):194-227.
[5] GURYANOVA O A, WU Q, CHENG L, et al. Nonreceptor tyrosine kinase BMX maintains renewal self- and tumorigenic potential of glioblastoma stem cells by activating STAT3[J]. Cancer Cell,2011,19(4):498-511.
[6] YU H, PARDOLL D, JOVE R. STATs in cancer inflammation and immunity: a leading role for STAT3[J]. Nat Rev Cancer,2009, 9(11):798-809.
[7] MAROTTA LL, ALMENDRO V, MARUSYK A, et al. The JAK2/STAT3 signaling pathway is required for growth of CD44(+)CD24(-) stem cell-like breast cancer cells in human tumors[J]. J Clin Invest,2011,121(7):2723-2735.
[8] 赵志华,田研, 陈奎生.多发性骨髓瘤中c-myc和MDM2蛋白的表达及其临床意义[J].临床与实验病理学杂志,2017,33(2):165-168.
[9] NJEI B, MCCARTY T R, BIRK J W. Trends in esophageal cancer survival in United States adults from 1973 to 2009: a SEER database analysis[J]. J Gastroenterol Hepatol,2016 , 31(6):1141-1146.
[10] LEE T K, CASTILHO A, CHEUNG V C, et al. CD24(+) liver tumor-initiating cells drive self-renewal and tumor initiation through STAT3-mediated NANOG regulation[J]. Cell Stem Cell,2011, 9(1):50-63.
[11] IKEZOE T, KOJIMA S, FURIHATA M, et al. Expression of p-JAK2 predicts clinical outcome and is a potential molecular target of acute myelogenous leukemia[J]. Int J Cancer,2011, 129(10):2512-2521.
[12] WU H, HUANG M, CAO P, et al. MiR-135a targets JAK2 and inhibits gastric cancer cell proliferation[J]. Cancer Biol Ther,2012, 13(5):281-288.
[13] CHEN X, YING Z, LIN X, et al. Acylglycerol kinase augments JAK2/STAT3 signaling in esophageal squamous cells[J]. J Clin Invest,2013, 123(6):2576-2589.

