IL-1β促进食管鳞状细胞癌细胞迁移和侵袭的实验研究
李 鲁, 周 剑, 刘 涛, 刘 清, 郑树涛, 谭豆豆, 陈玉梅, 马 蓉, 卢晓梅
(新疆医科大学1第一附属医院医学检验中心, 2附属肿瘤医院, 3临床医学研究院, 乌鲁木齐 830011)
食管癌是最常见的消化道恶性肿瘤之一,在世界范围内其发病率和死亡率分别排在第8位和第6位[1]。食管癌的组织学类型包括腺癌和鳞状细胞癌,我国90%的食管癌属于食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)[2]。ESCC常发生转移,预后差,患者5 a生存率不足20%[3]。白细胞介素1-β(IL-1β)是一种促炎细胞因子,在炎症、机体免疫反应和维持组织稳态中起着重要作用。研究发现,IL-1β与多种肿瘤的进展有关,对肿瘤的迁移和侵袭具有促进作用[4-5]。本研究用IL-1β处理ESCC细胞,观察IL-1β对ESCC细胞迁移和侵袭能力的影响。
1 材料与方法
1.1材料食管鳞状细胞癌Eca109细胞(武汉大学细胞库)和KYSE-150细胞(中国医学科学院赠送)。抗体芯片(AAH-CYT-G5, 北京博奥晶典生物技术有限公司)。IL-1β(北京神州义翘科技有限公司),蛋白质抽提试剂盒购自碧云天生物技术公司。胎牛血清(FBS)、胰蛋白酶(Gibco公司),DMSO (Invitrogen公司)。
1.2方法
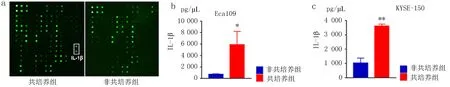
1.2.1 细胞培养和细胞培养上清的制备 食管癌Eca109细胞和KYSE-150细胞在37℃,5%CO2条件培养于含10%胎牛血清(FBS)、青霉素 (100 IU/mL)及链霉素 (100 IU/mL)的RPMI1640培养液中。建立食管癌细胞与M2 TAMs共培养体系,并将培养基换成无血清培养基,共培养48 h后收集培养液上清,采用蛋白质抽提试剂盒制备细胞蛋白。食管癌细胞加M2 TAMs作为共培养组,正常培养食管癌细胞作为非共培养组。
1.2.2 抗体芯片筛查 采用AAH-CYT-G5抗体芯片及其检测试剂盒,按试剂盒说明进行操作。抗体芯片放置孵育盒中,加人2 mL封闭缓冲液,室温振荡孵育l h;每张芯片加入2 mL含1.2 mg蛋白质的细胞培养上清和细胞裂解液,4℃振荡孵育过夜;去除样品液,加入约2 mL的1×洗液I于室温振荡清洗;去除洗液I,加入1×洗液II于室温振荡清洗;去除洗液II,加入1 mL生物素标记的混合抗体,于室温孵育2 h;抽去洗液II,加入2 mL 5 000倍稀释的荧光剂CW800标记的链霉亲和素,室温避光振荡孵育2 h;荧光扫描(Licor-Odyssey)获取图像(每组设3个重复,每组实验重复3次)。
1.2.3 IL-1β处理细胞 食管癌细胞Eca109细胞和KYSE150细胞接种于6孔板,细胞培养基更换为无血清培养基,培养基中加入IL-1β (100 ng/mL) 培养48 h,作为IL-1β处理组,加入PBS代替IL-1β作为未处理组(每组设3个重复,每组实验重复3次)。
1.2.4 细胞划痕实验 细胞接种于6孔板,恒温细胞培养箱中培养,用10 μL无菌枪头在6孔板底部轻划一条力度和角度一致、粗细均匀的直线(每组设3个重复,每组实验重复3次)。分别于0、24、48 h在倒置相差显微镜下观察同一视野划痕的宽度并拍照。
1.2.5 细胞侵袭实验 配制基质胶,将配好的基质胶加入到Transwell小室的上室,置于细胞培养箱中过夜使其充分干燥。Transwell小室下室加入500 μL含10%FBS的1640培养基作为趋化剂,细胞用无血清培养基混匀后加入上室面(5×104/孔),置于恒温细胞培养箱培养48 h后,用棉签轻轻擦去上室面未穿过膜的细胞,4%多聚甲醛固定,PBS清洗,结晶紫染色30 min后再用PBS清洗,显微镜下观察,每个样本随机选取4个视野,计数每个视野染色的细胞数量,即穿膜细胞数,取平均值(每组设3个重复,每组实验重复3次)。

2 结 果
2.1抗体芯片筛查细胞因子食管癌细胞与M2 TAMs共培养后,收集细胞培养液上清,用抗体芯片筛查共培养组与非共培养组细胞培养上清中差异表达的细胞因子(图1a)。结果显示,共培养组培养上清中IL-1β表达增加,与非共培养组相比,差异具有统计学意义(P<0.05, 图1b)。
2.2IL-1β对细胞迁移能力的影响与未处理组比较,IL-1β处理48 h后细胞划痕愈合能力明显增强,差异有统计学意义(P<0.05) (图2a),IL-1β处理相对宽度较未处理组窄,差异有统计学意义(P<0.005)(图2b)。
2.3IL-1β对细胞侵袭能力的影响与未处理组比较,IL-1β处理48 h后,穿过基膜的细胞数明显增加,差异有统计学意义(P<0.001) (图2c、d),表明IL-1β处理能增强ESCC细胞的侵袭能力。
3 讨论
本研究中,我们将食管癌细胞与M2 TAMs共培养,观察共培养后细胞培养上清中差异表达的细胞因子对食管癌迁移、侵袭能力的影响。结果发现,M2 TAMs与Eca109细胞及KYSE-150细胞共培养上清中IL-1β表达均显著增加,与非共培养组比较,差异具有统计学意义(P<0.05)。为了进一步验证IL-1β对ESCC细胞迁移和侵袭能力的影响,我们在细胞培养基中加入IL-1β,观察IL-1β作用后对ESCC细胞迁移和侵袭能力的影响。细胞划痕实验和细胞侵袭实验结果表明,IL-1β处理48 h后Eca109细胞和KYSE-150细胞的迁移和侵袭能力均显著增加,与对照组比较,差异有统计学意义(P<0.05)。我们的研究结果表明,共培养后分泌增加的细胞因子IL-1β可显著促进ESCC细胞的迁移和侵袭。

肿瘤发生浸润转移是导致患者预后不良的主要原因。IL-1β是一种促炎细胞因子,IL-1β不仅与机体炎症反应有关,还在肿瘤的侵袭转移过程中起着重要作用[6-8]。研究发现,在口腔鳞状细胞癌中,IL-1β表达增加[9]。同时IL-1β与其他免疫细胞一起形成炎性免疫微环境,促进肿瘤血管的形成,并通过释放一些促瘤的细胞因子如白细胞介素-6(IL-6)和人生长调节致癌基因α(GRO-α)等,促进肿瘤发生浸润转移[10-13]。另有研究发现,IL-1β可引起肿瘤细胞发生上皮-间质转化,从而促进结肠癌的浸润转移[14]。我们的研究结果表明IL-1β刺激后,促进ESCC细胞的迁移和侵袭,表明IL-1β在ESCC的侵袭和转移过程中起着重要作用。
肿瘤的浸润转移是一个多因素参与的复杂过程,本研究仅通过细胞功能学实验验证了IL-1β在ESCC迁移和侵袭过程中的重要作用,IL-1β是否会引起食管癌细胞发生上皮间质转化,以及IL-1β导致肿瘤细胞发生浸润转移的具体机制还有待于分子生物学实验和动物模型实验进一步验证。
参考文献:
[1] DOMPER-ARNAL M J, FERRANDEZ-ARENAS A, LANAS-ARBELOA A. Esophageal cancer:Risk factors, screening and endoscopic treatment in Western and Eastern countries[J]. World J Gastroenterol, 2015, 21(26):7933-7943.
[2] CHEN W, ZHENG R, ZUO T, et al. National cancer incidence and mortality in China, 2012[J]. Chin J Cancer Res, 2016, 28(1):1-11.
[3] ZHANG L, MA J, HAN Y ,et al. Targeted therapy in esophageal cancer[J]. Expert Rev Gastroenterol Hepatol, 2016, 10(5):595-604.
[4] WU T, HONG Y, JIA L, et al. Modulation of IL-1beta reprogrammes the tumor microenvironment to interrupt oral carcinogenesis[J]. Sci Rep, 2016, 6:20208.
[5] TARASSISHIN L, CASPER D, LEE S C. Aberrant expression of interleukin-1beta and inflammasome activation in human malignant gliomas[J]. PLoS One, 2014, 9(7):e103432.
[6] PALOMO J, DIETRICH D, MARTIN P, et al. The interleukin (IL)-1 cytokine family-Balance between agonists and antagonists in inflammatory diseases[J]. Cytokine, 2015, 76(1):25-37.
[7] SATOH T, OTSUKA A, CONTASSOT E, et al. The inflammasome and IL-1beta:implications for the treatment of inflammatory diseases[J]. Immunotherapy, 2015, 7(3):243-254.
[8] APTE R N, DOTAN S, ELKABETS M, et al. The involvement of IL-1 in tumorigenesis, tumor invasiveness, metastasis and tumor-host interactions[J]. Cancer Metastasis Rev, 2006, 25(3):387-408.
[9] LEE C H, CHANG J S, SYU S H, et al. IL-1beta promotes malignant transformation and tumor aggressiveness in oral cancer[J]. J Cell Physiol, 2015, 230(4):875-884.
[10] VOLOSHIN T, ALISHEKEVITZ D, KANETI L, et al. Blocking IL-1beta pathway following paclitaxel chemotherapy slightly inhibits primary tumor growth but promotes spontaneous metastasis[J]. Mol Cancer Ther, 2015, 14(6):1385-1394.
[11] HUANG Q, LAN F, WANG X, et al. IL-1beta-induced activation of p38 promotes metastasis in gastric adenocarcinoma via upregulation of AP-1/c-fos, MMP2 and MMP9[J]. Mol Cancer, 2014(13):18.
[12] HAN J, XIE Y, LAN F, et al. Additive effects of EGF and IL-1beta regulate tumor cell migration and invasion in gastric adenocarcinoma via activation of ERK1/2[J]. Int J Oncol, 2014, 45(1):291-301.
[13] JOOSTEN L A, NETEA M G, DINARELLO C A. Interleukin-1beta in innate inflammation, autophagy and immunity[J]. Semin Immunol, 2013, 25(6):416-424.
[14] LI Y, WANG L, PAPPAN L, et al. IL-1beta promotes stemness and invasiveness of colon cancer cells through Zeb1 activation[J]. Mol Cancer, 2012(11):87.

